自然越冬过程中鹿蹄草膜质过氧化及渗透调节物质含量的变化研究
王延松,白海东,逯锦春,李彦慧*
(1.河北农业大学园林与旅游学院,河北保定 071000;2.北京市园林设计工程有限公司,北京 100012)
近年来,随着工业化、城市化的不断发展,人们对城市园林绿化的要求越来越高。目前,我国北方地区地被植物的应用对建设生态园林城市发挥着重要作用。北方气候寒冷,乔木多高大,分枝点高,冬季落叶,适当地选择常绿的地被植物不仅可以填补林下的景观空缺,还能够严密地覆盖裸露地面,增加林下景观层次,营造复合型植物群落,健全绿地生态系统。低温影响植物的生长发育,也是限制植物分布和引种的重要因素。因此,急需对植物进行耐寒性研究并找到耐寒性强的植物来提高生态效益,解决地被植物的问题日益紧迫。近年来已有对茶树(Camelliasinensis)[1]、三角梅(Bougainvilleaglabra)[2]与睡莲(Nymphaeatetragona)[3]等耐寒性的相关报道,但对耐寒性地被植物研究相对较少,因此深入研究地被植物的耐寒性,完善评价标准体系,并结合生态效益原则,对园林植物的科学配置提供指导非常有必要。
鹿蹄草(PyrolacallianthaH.Andr.)是鹿蹄草科(Pyrolaceae)鹿蹄草属(Pyrola)多年生常绿野生草本花卉[4],其花大,广开,花瓣呈白色或粉红色,喜冷凉阴湿环境,其生命力顽强,具有突出的耐寒性,是四季观赏极佳的地被植物,在城市园林绿化中有巨大的发展前景。目前,关于其抗寒性已有部分研究,如陈忠等[5]对鹿蹄草在自然越冬过程中内源激素的研究表明,ABA/GA比值与抗寒性呈正相关。赵辉新等[6]研究发现,鹿蹄草的解剖结构和叶片表皮形态与其常绿抗寒的特性之间有很强的相关性。赵耀新[7]对鹿蹄草进行了形态解剖、组织培养研究,并对其引种试验进行了综合性分析。基于前人对鹿蹄草的研究,笔者以鹿蹄草的叶片和根状茎为试验材料,测定从越冬前到越冬后的地上部分叶片和地下部分根状茎的膜质过氧化产物、保护酶活性与渗透调节物质含量,旨在明确鹿蹄草地上部分和地下部分的生理生化机制,为耐寒植物培育、引种驯化及丰富园林地被植物资源提供理论基础和指导依据。
1 材料与方法
1.1 试验材料供试材料为鹿蹄草活体植物材料,采自河北省塞罕坝机械总场阴河林场白水盘区域。该区域位于河北省围场县与内蒙古赤峰市克什克腾旗和锡林郭勒盟多伦县的接壤处(116°51′~117°39′ E,42°02′~42°36′ N),为内蒙古高原东南缘与大兴安岭和冀北山地的交汇地带。
1.2 试验方法2016年9月根据鹿蹄草的分布和长势在该区域选定3个10 m×10 m的样方,2016年10月至2017年5月每月中旬取样。取样时每样方内随机选3组,每组取无病虫害、长势一致的鹿蹄草活体植物材料,放入冰块保鲜的保温箱内,运回保定,用蒸馏水清洗,一部分用于叶色指标测定,另一部分进行液氮处理,待液氮处理完成,存入超低温冰箱,用于生理指标的测定,每个指标3次重复。
1.3 指标测定与方法丙二醛(MDA)含量采用巴比妥酸(TBA)法测定,超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法测定,过氧化物酶(POD)活性采用愈创木酚法测定,过氧化氢酶(CAT)活性采用紫外吸收法测定[8],可溶性蛋白含量采用考马斯亮蓝G-250染色法测定,可溶性糖含量用蒽酮比色法测定,脯氨酸含量采用酸性茚三酮法测定[9]。
1.4 数据处理与分析试验数据用Excel软件进行记录处理,使用SPSS 20.0软件进行显著性分析。
2 结果与分析
2.1 自然越冬过程中鹿蹄草MDA含量动态变化由图1可知,叶片和根状茎MDA含量在自然越冬过程中均呈现先上升后下降的变化趋势。叶片的MDA含量在1月出现峰值,比10、11、12月分别升高了291.1%、208.1%、60.4%,与10、11月差异显著(P<0.05),2、3、4、5月MDA含量逐渐降低,与1月相比,分别降低了42.8%、52.4%、52.4%、59.3%,且与3、4、5月差异显著(P<0.05)。 根状茎的MDA含量最大值出现在1月,比10、11、12月分别升高了116.8%、3.0%、1.8%。2、3、4、5月,根状茎MDA含量逐渐降低,与1月相比,分别降低了4.5%、15.2%、43.6%、81.5%,但各月间差异均不显著。除11月份外,其他月份叶片的MDA含量高于根状茎。
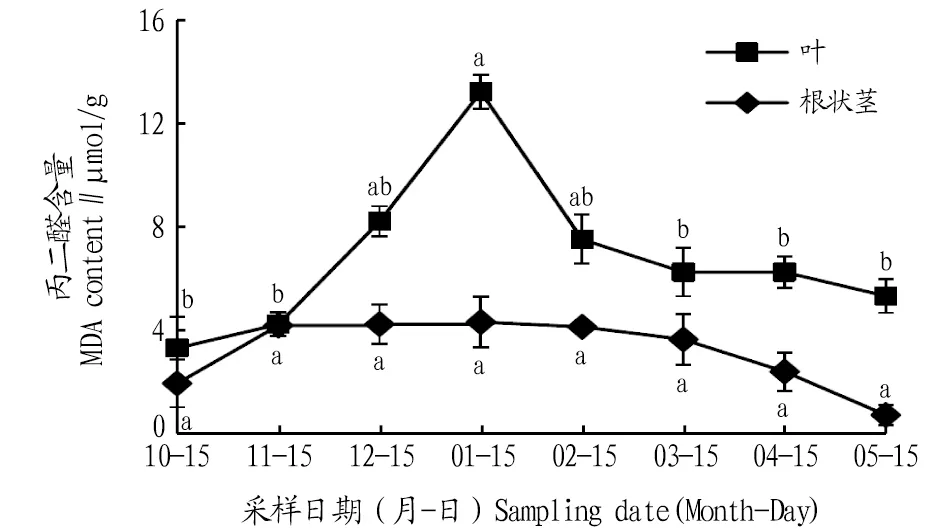
注:不同小写字母表示同一部位不同月份间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences between different months in the same location(P<0.05).
2.2 自然越冬过程中鹿蹄草保护酶活性动态变化
2.2.1SOD活性动态变化。由图2可知,叶片和根状茎SOD活性在自然越冬过程中均呈现先升高后降低的变化趋势。叶片的SOD活性在1月出现峰值,比10、11、12月分别升高了45.1%、42.5%、1.8%,与10、11月差异显著(P<0.05);进入2、3、4、5月叶片SOD活性逐渐下降,与1月相比,分别降低了5.9%、17.1%、19.9%、37.1%,1月叶片SOD活性与3、4、5月差异显著(P<0.05)。根状茎的SOD活性在1月达到最大值,比10、11、12月分别升高了0.2%、1.0%、14.5%;进入2、3、4、5月根状茎的SOD活性逐渐降低,与1月相比,分别降低了13.4%、21.3%、29.5%、40.0%,1月根状茎SOD活性与5月差异显著(P<0.05)。在10、11月叶片和根状茎的SOD活性相同,之后,叶片的SOD活性明显高于根状茎。
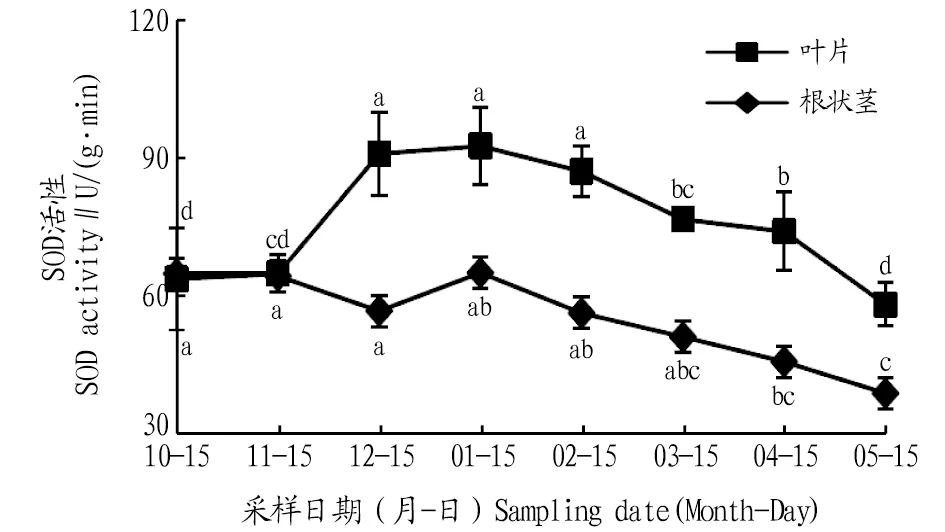
注:不同小写字母表示同一部位不同月份间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences between different months in the same location(P<0.05).
2.2.2POD活性动态变化。从图3可知,叶片POD活性在自然越冬过程中呈现先上升后下降的波动变化趋势,在1月达到最大值,比10、11、12月分别升高42.8%、24.9%、42.8%;进入2、3、4、5月叶片POD活性降低后升高,与1月份相比,分别降低了30.0%、39.9%、49.9%、9.9%,且差异不显著(P>0.05)。根状茎POD活性在自然越冬过程中呈现先下降后上升再下降的变化趋势,11月比10月下降了52.1%,二者间差异显著(P<0.05),1月比11、12月分别升高了90.9%、31.2%,且与11月差异显著(P<0.05);进入2、3、4、5月根状茎POD活性逐渐降低,与1月份相比,分别降低了52.3%、76.1%、76.1%、85.7%。
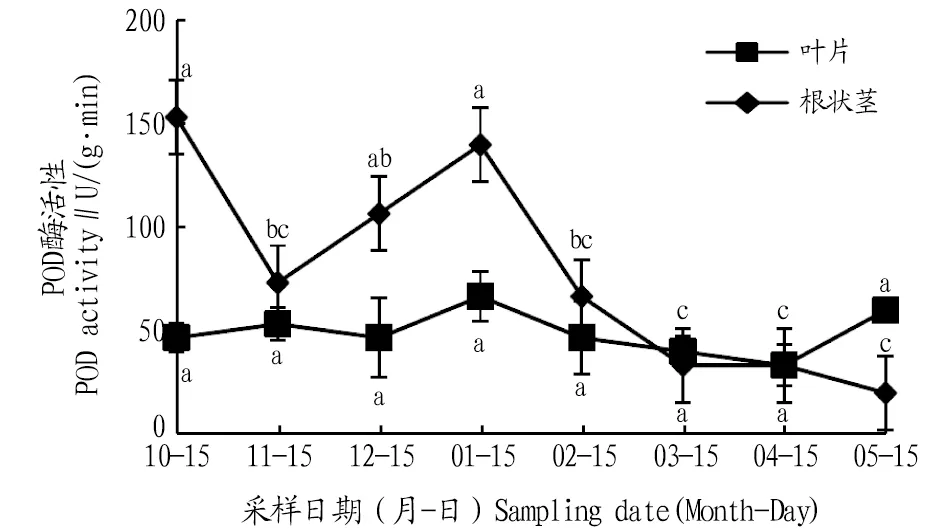
注:不同小写字母表示同一部位不同月份间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences between different months in the same location(P<0.05).
2.2.3CAT活性动态变化。由图4可知,其叶片和根状茎CAT活性在自然越冬过程中均呈现先上升后下降的变化趋势。叶片CAT活性在1月达到最大值,比10、11、12月分别上升了115.0%、61.1%、35.2%,且与10、11月差异显著(P<0.05);进入2、3、4、5月,叶片CAT活性逐渐降低,与1月份相比,分别降低了19.3%、19.3%、19.3%、58.4%,且1月与5月间差异显著(P<0.05)。根状茎CAT活性在1月达到最大值,比10、11、12月分别升高了231.1%、119.1%、88.6%,且差异显著(P<0.05);进入2、3、4、5月,根状茎CAT活性逐渐下降,与1月相比,分别下降了32.8%、73.1%、85.2%、92.6%,且均差异显著(P<0.05)。在各月份中叶片的CAT活性高于根状茎。
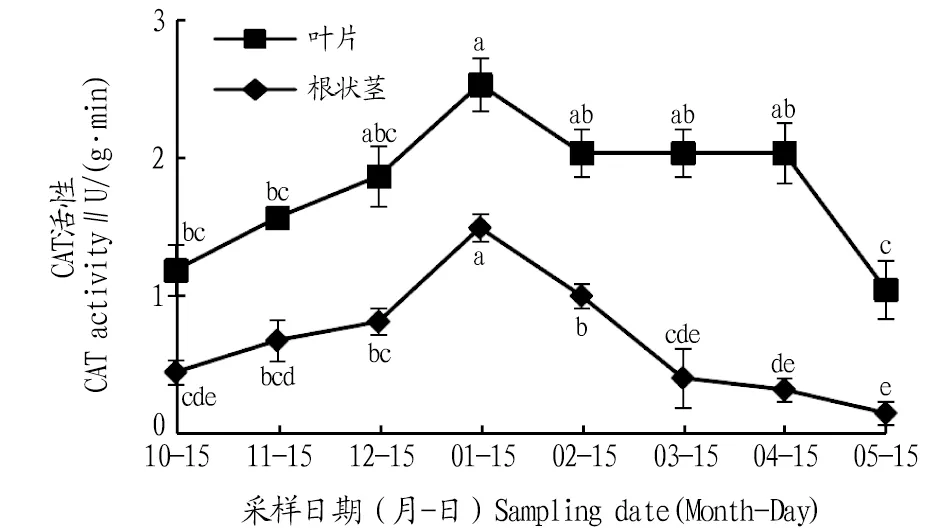
注:不同小写字母表示同一部位不同月份间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences between different months in the same location(P<0.05).
2.3 自然越冬过程中鹿蹄草渗透调节物质动态变化
2.3.1脯氨酸含量动态变化。由图5可知,其叶片和根状茎脯氨酸含量在自然越冬过程中均呈先上升后下降的变化趋势。根状茎脯氨酸含量在1月达到最大值,比10、11、12月分别升高了46.5%、21.7%、2.5%,且与10、11月差异显著(P<0.05),进入2、3、4、5月,脯氨酸含量显著下降,与1月相比,分别下降了7.9%、17.8%、24.3%、34.7%,且均差异显著(P<0.05)。叶片脯氨酸含量在1月达到最大值,比10、11、12月分别升高了58.3%、45.4%、17.4%,且与10月差异显著(P<0.05);进入2、3、4、5月脯氨酸含量逐渐下降,与1月相比,分别下降了27.9%、28.3%、34.9%、37.2%,且1月与4、5月差异显著(P<0.05)。

注:不同小写字母表示同一部位不同月份间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences between different months in the same location(P<0.05).
2.3.2可溶性蛋白含量动态变化。由图6可知,叶片和根状茎可溶性蛋白含量在自然越冬过程中均呈现先上升后下降的变化趋势。叶片的可溶性蛋白含量在1月达到最大值,比10、11、12月分别升高了35.0%、26.2%、0.5%,且与10、11、12月差异不显著(P>0.05);进入2、3、4、5月可溶性蛋白含量逐渐下降,与1月相比,分别下降了3.2%、7.8%、10%、10.3%,1月叶片可溶性蛋白含量与4、5月差异显著(P<0.05)。根状茎的可溶性蛋白含量在1月达到最大值,比10、11、12月分别升高15.1%、11.8%、0.4%,且与10、11、12月差异显著(P<0.05);进入2、3、4、5月,可溶性蛋白含量逐渐下降,与1月相比,分别下降了1.5%、2.4%、3.6%、8.6%,且1月根状茎可溶性蛋白含量与4、5月差异显著(P<0.05)。根状茎的可溶性蛋白含量始终高于叶片。

注:不同小写字母表示同一部位不同月份间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences between different months in the same location(P<0.05).
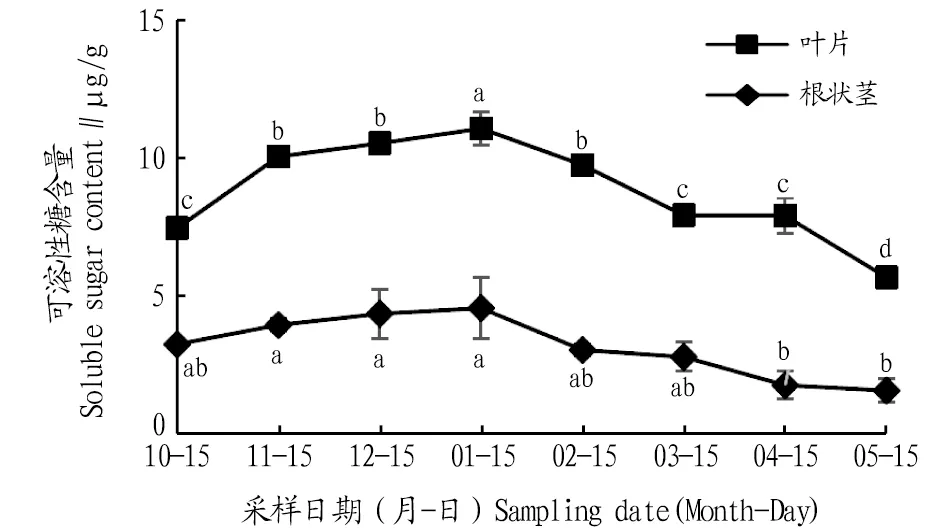
2.3.3可溶性糖含量动态变化。由图7可知,叶片和根状茎可溶性糖含量在自然越冬过程中均呈先上升后下降的变化趋势。叶片可溶性糖含量在1月达到最大值,比10、11、12月分别升高了48.3%、10.1%、5.1%,且与10、11、12月差异显著(P<0.05);进入2、3、4、5月可溶性糖含量逐渐下降,与1月相比,分别下降了11.9%、28.4%、28.6%、48.7%,且差异显著(P<0.05)。根状茎可溶性糖含量在1月达到最大值,比10、11、12月分别上升了40.1%、15.4%、4.8%;进入2、3、4、5月,可溶性糖含量逐渐下降,与1月相比,分别下降了33.2%、38.7%、61.2%、65.4%,1月根状茎可溶性糖含量与4、5月差异显著(P<0.05)。各月叶片可溶性糖含量高于根状茎。
注:不同小写字母表示同一部位不同月份间差异显著(P<0.05)。Note:Different lowercase letters indicate significant differences between different months in the same location(P<0.05).
3 讨论与结论
3.1 讨论MDA是膜质过氧化的最终分解产物。常温下,MDA含量较少,但遇到逆境时,MDA含量增多,表明植物受伤越严重[10]。对于同一植物来说,低温时植物地上部分与地下部分的MDA表现不同[11]。该研究发现,在低温状态下叶片和根状茎MDA含量上升幅度较大,1月含量达到最大,进入2、3、4、5月,当气温有所回升时,MDA含量又明显下降,说明初期机体自身代谢功能突然失去平衡,膜质过氧化加强,温度升高后,植物体自我调节和抵抗能力增强,使MDA含量降低。而根状茎MDA含量变化较小,这可能是由于叶片暴露在地上部分,细胞活动较为旺盛,温度等自然环境对叶片中细胞膜影响较大;而根系在地下部分受土层保护,受外界环境影响较小,活动较为稳定。
遇到逆境条件,植物体内产生的大量活性氧,会打破正常条件下活性氧的动态平衡,从而对植物造成伤害。SOD、POD、CAT以及其他保护酶类是植物体内重要的活性氧清除酶,逆境条件下植物体内的SOD、POD活性均会上升[12]。有研究也已证实保护酶在植物体内的浓度和活性高低与植物抗寒性强弱有密切关系,抗寒性强的植物具有更强的抗氧化能力[13]。该研究发现,叶片和根状茎的SOD、POD、CAT活性在1月达到最大,这主要是由于气温较低,植物体自身酶活性发挥最大,以抵御低温带来的伤害,而在试验期各月叶片的SOD、POD、CAT活性不同,说明叶片暴露于外部,受环境影响较大。在12月到翌年1月,植物处于抗寒保持期,叶片与根状茎差异显著,这是由于该时期叶片各酶活性变化较为剧烈,而根系处于地下部分较稳定。
脯氨酸是植物体内广泛存在的一种渗透保护物质,植物体通过脯氨酸代谢,使体内积累脯氨酸,增强对响应和抵御低温胁迫及生长发育的多重保护功能[14]。越来越多的学者认为,高等植物体内的脯氨酸代谢不仅仅局限于简单、静态的细胞内的脯氨酸积累过程,而且存在不同器官间脯氨酸的长距离运输和流通[15]。该研究发现,鹿蹄草根状茎和叶片的脯氨酸含量呈先上升后下降趋势,在气温最低时达到最大值,且叶片中的游离脯氨酸含量的相对增加量始终小于根状茎,这是由于同化物在根茎中合成,运输时“就近分配”、优先参与根系渗透作用有关。
可溶性蛋白含量的积累可作为渗透调节物质和防脱水剂,从而有利于植物抗寒[16]。该研究发现,叶片和根状茎的可溶性蛋白含量呈先上升后下降的趋势。在1月,可溶性蛋白的积累量达到最大,这可能是由于鹿蹄草在低温初期体内蛋白质合成受到抑制,而后产生大量抗逆性蛋白,使得体内渗透调节物质增加。10、11、12月和翌年3、4月叶片和根状茎的可溶性蛋白含量与4、5月差异显著(P<0.05),根状茎的可溶性蛋白含量略高于叶片,这表明在低温伤害较轻时,叶片在渗透调节方面起主导作用,低温强度增大时根状茎部分泌的功能性蛋白增多,渗透调节转变为叶部和根茎部共同作用。
可溶性糖对维持细胞膜在低温下的正常功能有着重要作用[17]。该试验中,随着低温时间的延长,鹿蹄草可溶性糖含量呈先上升后下降的趋势,且叶片的可溶性糖相对含量大幅高于根茎,分析可知鹿蹄草的可溶性糖对低温的变化更敏感,且低温时可溶性糖含量增加,提高了植物细胞的渗透调节能力,同时也降低了细胞原生质的凝固点,进而增强了抗冻能力。
3.2 结论自然越冬过程中鹿蹄草叶片和根状茎中MDA含量及SOD、POD、CAT活性均表现出先上升后下降的变化趋势。叶片MDA含量1月比上一年10月上升291.1%。叶片和根状茎SOD活性1月比5月分别上升了58.8%、66.7%。根状茎POD活性1月比4月上升了320.0%。根状茎CAT活性1月是5月的13.5倍,各月CAT活性叶片高于根状茎,说明叶片的细胞保护酶活动较为剧烈,根状茎活动较为稳定。鹿蹄草叶片和根状茎中脯氨酸、可溶性蛋白、可溶性糖含量均表现为先上升后下降的变化趋势。叶片和根状茎的脯氨酸含量1月比5月分别上升了53.2%、37.2%。叶片和根状茎的可溶性蛋白含量1月比上一年10月分别上升了35.0%、15.1%,叶片可溶性糖含量1月比5月上升了94.9%。各月根状茎的脯氨酸与可溶性蛋白含量始终高于叶片,而叶片中的可溶性糖含量则高于根状茎,由此可知脯氨酸和可溶性蛋白的合成部位为根状茎,可溶性糖的合成部位为叶片。

