急性心肌梗死后合并室间隔穿孔不同术式的回顾分析
王真真 孙子瑞 刘煜昊
1河南大学第一附属医院(河南 开封 475000);2阜外华中心血管病医院结构性心脏病区(郑州 451460)
心肌梗死后室间隔穿孔(post-infarction ventricular septal rupture,PIVSR)是急性心肌梗死(acute myocardial infarction,AMI)罕见但严重威胁生命的一种并发症,随着AMI 再灌注治疗的广泛实施,PIVSR 的发生率从1% ~2%降至0.25% ~0.31%[1]。PIVSR 病死率极高,药物保守治疗30 d的存活率不到8%,1 年的存活率不到3%[2],目前指南建议,无论患者血液动力学如何都应该紧急手术修复[3-4]。外科手术修复作为治疗PIVSR 的传统治疗手段,创伤较大,病死率高,另外大部分PIVSR 患者心功能较差而不能耐受手术。由于其自身的局限性,介入封堵术作为一种侵入性较小方法被引入[4],手术成功率很高[2,5],已经成为PIVSR 患者治疗的一种新选择。因此本研究通过分析选择不同术式的PIVSR 患者的临床特征及预后,来指导临床医生结合患者具体情况制定出最适合他们的手术方式,以改善PIVSR 患者的预后,降低病死率。
1 资料与方法
1.1 资料来源 选取2017-2020 年在河南省人民医院心脏中心就诊,诊断为PIVSR 患者共64 例,包括接受介入封堵治疗的患者50 例和接受外科手术修补的患者14 例,所有研究对象均已签署相关知情同意书。
1.2 纳入及排除标准 纳入标准:(1)根据心电图、冠脉CTA 或冠脉造影术等检查已明确诊断为AMI;(2)超声心动图结果回示室间隔回声连续性中断,并有左向右分流。
排除标准:(1)多器官功能衰竭,不能耐受介入封堵手术或外科修补手术;(2)既往有先天性心脏病史;(3)有严重的凝血功能障碍者。
1.3 方法 分组方法:患者血流动力学适合、有介入封堵治疗指征或无外科修补手术治疗指征且经过患者及家属同意介入封堵治疗的患者分为介入封堵术组;患者血流动力学稳定或经辅助装置治疗后相对稳定、无介入封堵治疗指征或介入封堵治疗失败、有等待外科手术指征且经过患者及家属同意外科修补手术治疗的患者分为外科修补手术组。通过分析两组患者的基线资料(年龄、性别、心功能分级、穿孔直径等)、术前[穿孔至手术时间、术前有无溶栓或经皮冠状动脉介入术(percutaneous coronary intervention,PCI)、呼吸机支持等]、术中(手术时间、残余分流等)、术后(重症监护室滞留时间、住院时间、住院费用等)相关结果及随访结局[左室射血分数(LVEF)、左室舒张末径(LVEDD)、6 min 步行试验(6MWT)]等,评估两组患者的预后有无差异及介入封堵治疗的安全性及有效性。
1.4 统计学方法 所有数据采用SPSS 23.0 软件进行统计学分析,对于符合正态检验的计量资料用均数±标准差表示,采用独立样本t检验进行比较,分类变量用百分比或频率进行描述,采用χ2检验进行比较,非正态分布资料采用M(P25,P75)表示,组间比较采用U检验。采用Cox 回归模型进行生存分析[主要指标分析包括治疗方式、穿孔直径、心功能Ⅲ-Ⅳ级(Killip 分级)、穿孔至手术时间、性别],先进行单因素回归分析,将单因素回归分析中的相关变量P<0.2 纳入模型,计算两组患者无死亡事件生存率的Kaplan-Meier 的曲线,并用对数秩检验(Log-rank)比较两组终点事件的无事件生存率。以P<0.05 为差异有统计学意义。
2 结果
2.1 患者基线资料 共纳入64 例PIVSR 患者,其中14 例患者因伴有外科手术指征(合并室壁瘤、冠脉三支严重病变、瓣膜大量返流等)行外科修补手术,余50 例行介入封堵术。与外科修补手术组相比,介入封堵术组女性多(64.0%vs.28.6%)、合并室壁瘤比例低(58.0%vs.92.9%)、联合主动脉球囊反搏(IABP)比例低(46.0%vs.92.9%)、血管活性药物使用率低(68.0%vs.100%)、呼吸机支持比例低(6.0%vs.35.7%)、住院费用低[(15.9 ±9.5)vs.(39.6 ± 15.7)],室间隔穿孔(VSR)直径小[(11.9 ± 4.1)vs.(24.3 ± 8.7)],其余患者基本资料差异均无统计学意义(P>0.05),见表1。
表1 患者基本资料对比Tab.1 Comparison table of basic patient data ±s
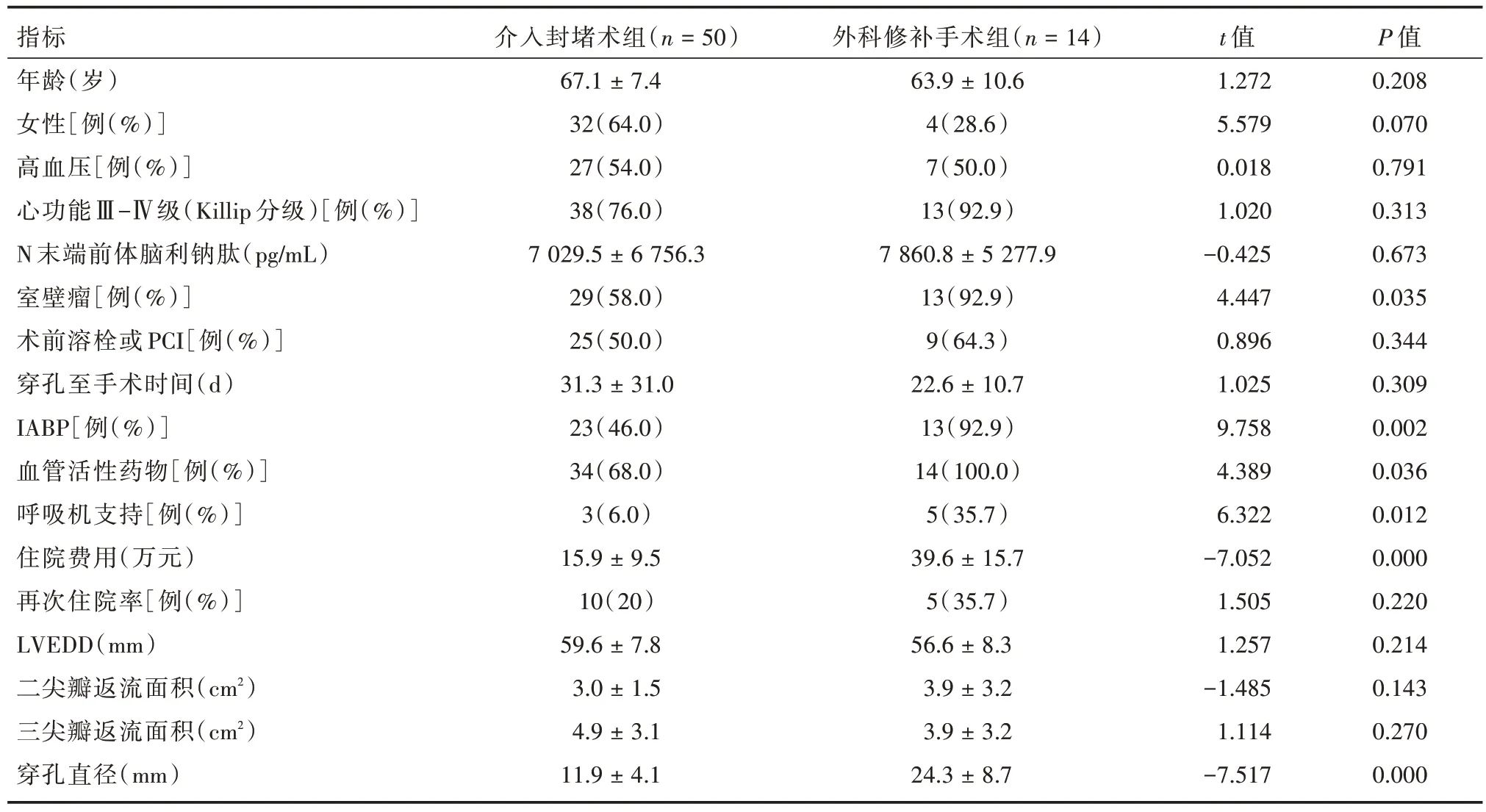
表1 患者基本资料对比Tab.1 Comparison table of basic patient data ±s
指标年龄(岁)女性[例(%)]高血压[例(%)]心功能Ⅲ-Ⅳ级(Killip 分级)[例(%)]N 末端前体脑利钠肽(pg/mL)室壁瘤[例(%)]术前溶栓或PCI[例(%)]穿孔至手术时间(d)IABP[例(%)]血管活性药物[例(%)]呼吸机支持[例(%)]住院费用(万元)再次住院率[例(%)]LVEDD(mm)二尖瓣返流面积(cm2)三尖瓣返流面积(cm2)穿孔直径(mm)介入封堵术组(n = 50)67.1 ± 7.4 32(64.0)27(54.0)38(76.0)7 029.5 ± 6 756.3 29(58.0)25(50.0)31.3 ± 31.0 23(46.0)34(68.0)3(6.0)15.9 ± 9.5 10(20)59.6 ± 7.8 3.0 ± 1.5 4.9 ± 3.1 11.9 ± 4.1外科修补手术组(n = 14)63.9 ± 10.6 4(28.6)7(50.0)13(92.9)7 860.8 ± 5 277.9 13(92.9)9(64.3)22.6 ± 10.7 13(92.9)14(100.0)5(35.7)39.6 ± 15.7 5(35.7)56.6 ± 8.3 3.9 ± 3.2 3.9 ± 3.2 24.3 ± 8.7 t 值1.272 5.579 0.018 1.020-0.425 4.447 0.896 1.025 9.758 4.389 6.322-7.052 1.505 1.257-1.485 1.114-7.517 P 值0.208 0.070 0.791 0.313 0.673 0.035 0.344 0.309 0.002 0.036 0.012 0.000 0.220 0.214 0.143 0.270 0.000
2.2 患者手术相关特征及并发症 所有患者术前均签署手术知情同意书,50 例经导管介入封堵成功患者中有3 例因术后出现二尖瓣大量返流、心包填塞、封堵器伴脱位,给予急诊外科修补手术。另外与外科修补手术相比,介入封堵术组手术时间短、ICU 滞留时间短、术后残余分流比例高,院内死亡率差异无统计学意义(P>0.05),见表2。

表2 患者手术相关变量Tab.2 Patient's surgery-related variablesM(P25,P75)
2.3 分析两组患者近期随访结果及远期随访结局 两组患者近期随访时间为6 个月,远期随访中位时间位409 d,近期随访两组患者的LVEDD、LVEF、6MWT 术后1、6 个月之间的差异及长期随访结局差异均无统计学意义(P>0.05),见表3。患者随访无死亡事件生存率差异无统计学意义(P= 0.21),见图1。
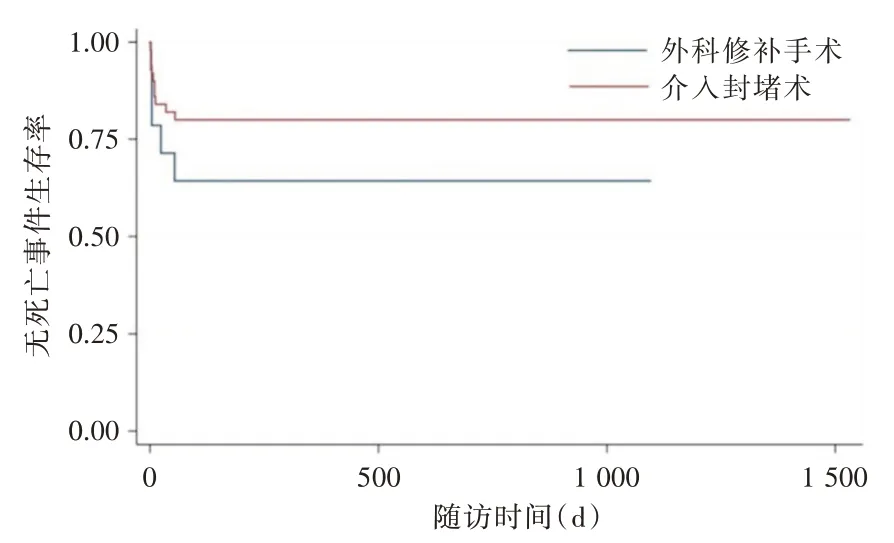
图1 患者随访无死亡事件生存率Fig.1 The event-free survival of patients followed up
表3 近期随访结果及远期随访结局Tab.3 Recent follow-up outcomes and long-term follow-up outcomes ±s
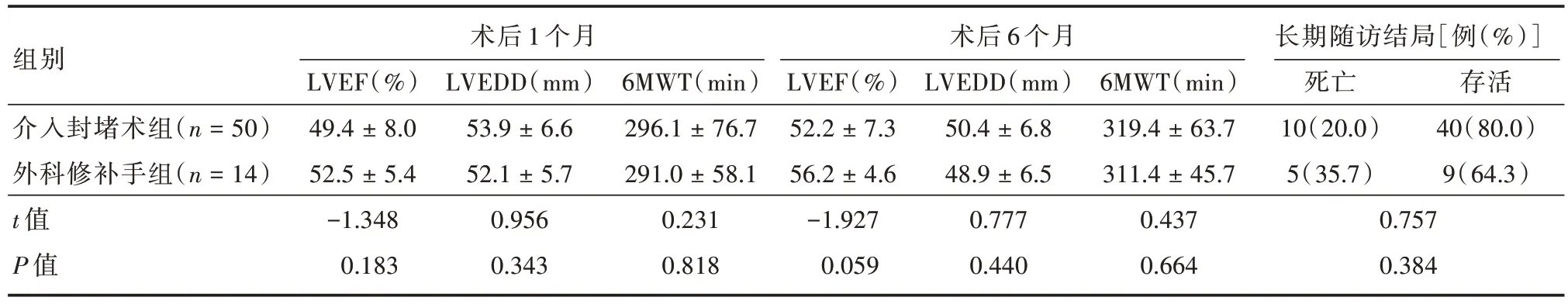
表3 近期随访结果及远期随访结局Tab.3 Recent follow-up outcomes and long-term follow-up outcomes ±s
组别介入封堵术组(n = 50)外科修补手组(n = 14)t 值P 值术后1 个月术后6 个月LVEF(%)49.4 ± 8.0 52.5 ± 5.4-1.348 0.183 LVEDD(mm)53.9 ± 6.6 52.1 ± 5.7 0.956 0.343 6MWT(min)296.1 ± 76.7 291.0 ± 58.1 0.231 0.818 LVEF(%)52.2 ± 7.3 56.2 ± 4.6-1.927 0.059 LVEDD(mm)50.4 ± 6.8 48.9 ± 6.5 0.777 0.440 6MWT(min)319.4 ± 63.7 311.4 ± 45.7 0.437 0.664长期随访结局[例(%)]死亡10(20.0)5(35.7)0.757 0.384存活40(80.0)9(64.3)
2.4 分析影响两组患者生存的因素及评估两组患者长期生存率有无差异 在Cox 回归分析中心功能Ⅲ-Ⅳ级(Killip 分级)是影响两组患者生存的危险因素(P<0.05),穿孔直径的大小、治疗方式的选择、穿孔至手术时间则无影响(P>0.05),见表4。

表4 影响患者生存的多因素Cox 分析Tab.4 Multivariate Cox analysis affecting patient survival
3 讨论
PIVSR 是一种罕见但预后极差的并发症,AMI后导致大量心肌细胞坏死,进而影响心肌功能,具有极高的致残率和致死率[6],既往在心肌再灌注治疗以前,PIVSR 多发生在AMI 后1 周左右,随着AMI 再灌注治疗的发展VSR 可发生在AMI 后1 d左右[7-8]。有研究表明,即使在获得最佳药物治疗及IABP 支持治疗下使缺血性心源性休克的患者的血流动力学达到稳定的情况下[9-10],52%的患者仍会在2 周内死亡。自1957 年首次报道VSR 外科修补术后,修补穿孔仍是目前治疗VSR 确切有效的治疗方式[11-12]。在没有手术干预的情况下,VSR 患者住院死亡率约为90%[4],本研究中无论是介入封堵术组还是外科修补手术组院内死亡率都明显降低。在这两组患者中,介入封堵术组IABP、血管活性药物、呼吸机支持使用率均较低,这些治疗措施的实施,都是通过减少左向右分流,改善心输出量和冠状动脉血流量以及维持血液动力学的稳定,同时也说明了介入封堵术组患者病情相对较轻。还有相关研究表明如若穿孔直径较大(>24 mm)则不适合行介入封堵术[13],本研究也证实介入封堵术组穿孔直径[(11.9 ± 4.1)mm]相对较小。介入封堵术是一种微创治疗,操作方便,手术时间较短,术后恢复较快,住院费用较低,但术后通常会留下不同程度的持续性残余分流,对于术后残余分流的管理有研究表明,大多数接受经导管介入封堵术的患者可能不需要进一步修复残余分流[14]。
本研究结果显示心功能Ⅲ-Ⅳ级(Killip 分级)是影响两组患者生存的危险因素,这一发现进一步强调了VSR 患者早期稳定血流动力学的重要性。目前指南也建议无论VSR 患者血流动力学如何,都应早期干预,及时修复穿孔,以缩短左右分流的持续时间和全身低灌注的持续时间,最终减少多器官衰竭、心源性休克和死亡的机会[15]。但由于早期PIVSR 患者周围心肌组织薄弱且易碎,穿孔形态不规则,梗死心肌组织被慢慢吸收后穿孔会扩大[16]。外科医生往往建议延迟3 ~4 周[17],待周围组织初始愈合和疤痕组织形成结束时进行外科修补手术,而介入封堵术作为一种侵入性较小的治疗方法,可允许立即完全VSR 闭合或者确保血流动力学的稳定,作为行外科修补手术的桥梁[18-19]。也有中心研究报道对于早期接受手术修复的患者,病死率可能会随着时间的缩短增加[20],穿孔至手术修补的时间是影响生存率的关键因素[21],而本研究结果表明穿孔至手术修补时间并不影响患者的生存率,这可能与入组患者选择偏差有关,本研究中入组患者手术大部分在穿孔2 周后进行,此时VSR 周围梗死心肌区域已经形成了疤痕组织,便于手术修复。
本研究另一重要发现是两组患者相比,院内生存率、远期随访无死亡事件生存率及术后两组患者1、6 个月的LVEDD、LVEF、6MWT 差异均无统计学意义(P>0.05),这也进一步说明了介入封堵术安全、有效。另外许多临床研究也证实了介入封堵术的安全、有效,术后生存率优于外科修补手术[22]。尽管AHA/ACC 指南推荐PIVSR 患者首选外科修补手术[23],但由于外科修补手术创伤大,手术风险高,术后患者恢复慢,许多患者因不能耐受手术而失去手术机会。自从Lock 等引入介入封堵术以来,作为一种治疗VSR 的微创治疗方法[18],即使不能被完全封堵,也可以减少左向右分流,改善心功能,作为下一步手术的桥梁,以成为残余分流修复的一种治疗手段[13],介入封堵术或将很快成为一种替代外科修补手术的治疗方法。
综上所述,PIVSR 患者接受介入封堵术治疗预后好,介入封堵术作为一种侵入性较小的治疗方法,创伤小、术后恢复快、住院费用低,虽然存在一定的局限性,但其安全性、有效性已经被很多临床研究所证实,很可能成为一种很有价值的外科修补手术替代治疗。但由于本研究是回顾性研究,入组患者数尚少,部分资料收集不够完善,且患者的治疗方式会因为医生和其自身偏好的选择存在一定的偏倚,还有待于更多的样本及长期随访时间进一步证实。
【Author contributions】WANG Zhenzhen designed the study and wrote the article.SUN Zirui and LIU Yuhao revised and reviewed the article.All authors read and approved the final manuscript as submitted.

