补肾强筋胶囊的体内安全性评价
柯明婧 梁嘉健 叶翔凌 吴淮 许学猛
1广州中医药大学第五临床医学院(广州 510405);2广东省第二中医院骨科(广州 510095)
补肾强筋胶囊(又名补肾活血胶囊)由杜仲、补骨脂、骨碎补、熟地黄、血竭和全蝎等组成,具有活血通络、祛风除湿、通络止痛等功效,经过前期临床GDP 研究,安全无毒副作用,已经成为广东省第二中医医院内制剂(批号:粤YZB-2002-005),广泛应用于骨关节炎等疾病的防治,取得较好的临床效果[1-2]。但尚缺乏动物实验安全性研究基础,因此本研究拟通过动物实验系统评估补肾强筋胶囊的体内安全性,为进一步探讨临床安全性用药提供科学和理论依据。
1 材料与方法
1.1 实验动物 所用动物均为SPF 级SD 大鼠,日龄45 ~50 d,体质量150 ~180 g,由广东省医学实验动物中心提供,所提供大鼠均具备《实验动物质量合格证》,许可证号为:SCXK(粤)2018-0002,实验单位许可证编号为:SCXK(粤)2020-0059。所有动物均在广东省第二中医院(广东省中医药工程技术研究院)饲养,均符合SPF 级饲养标准,所有动物实验均在广东省第二中医院(广东省中医药工程技术研究院)医学实验科完成,并在本院伦理委员会批准开展实验研究(伦理号为:048890)。在实验研究期间严格按照《实验动物福利伦理审查指南(GB/T 35892-2018)》要求开展相关研究,严格遵守《动物伦理学》所要求的3R 原则善待实验动物。
1.2 主要仪器与试剂 主要仪器与试剂TBA-40FR 全自动生化分析仪;Sysmex1800i 全自动血细胞分析仪;迈瑞BC-7500 血液细胞分析仪;罗氏Cobas702 全自动生化分析仪;SYSMEX CN-6000 凝血仪。
1.3 主要测试药物 补肾强筋胶囊,命名为BSQJ。
1.4 实验方法
1.4.1 实验动物分组 将40 只SPF 级SD 大鼠按照随机数字表法随机分为Control 组和BSQJ 组,每组各20 只,雌雄各半。
1.4.2 给药 SD 大鼠适应性喂养1 周后开始给药,给药前对大鼠禁食不禁水16 h。按最大给药量对BSQJ 组进行灌胃,补肾强筋胶囊用纯净水配制为大鼠灌胃针能够抽吸的最大浓度以生药含量计为0.8 g/mL,以大鼠能耐受的最大给药体积40 mL/(kg·d)为给药标准,1 d 内灌胃3 次(每次给药间隔8 h),给药量以生药计为32 g/(kg·d),相当于临床成人用药剂量[1.629 g/(kg·d)]的20 倍左右。Control 组予灌胃等量0.9%氯化钠溶液。给药结束后,两组连续观察14 d。
1.4.3 取材 给药结束14 d 后对SD 大鼠予戊巴比妥行腹腔麻醉。麻醉完全后,分别将Control 组和BSQJ 组的大鼠行心脏取血。取血完成后,所有动物予腹腔注射过量麻醉剂处死大鼠,随后取心、肝、脾、肺、肾等内脏组织用4%多聚甲醛固定以备用。
1.4.4 急性毒性反应观察 给药期间每天持续观察SD 大鼠有无死亡现象以及毒性反应,包括SD大鼠外观、行为活动、呼吸、精神状态、饮食、二便情况以及有无异常分泌物等,并且于第1、4、7、11、14 天时称量SD 大鼠体质量并记录。
1.4.5 血液学检查 将收集至血常规管的血液立刻送至医学检验科进行血液学分析,检查指标主要为:白细胞计数(white blood cell,WBC)、中性粒细胞(neutrophil,NEUT)、中性粒细胞比值(neutrophil%,NEUT%)、淋巴细胞(lymphocytes,LY)、淋巴细胞比值(lymphocytes%,LY%)、红细胞计数(red blood cell,RBC)、血红蛋白(hemoglobin,Hb)和血小板计数(platelet count,PLT)等。
1.4.6 血生化检查 将收集至生化采血管的血液放入离心机离心(3 500 r/min,15 min),随后对离心后的血清立刻送至医学检验科进行生化分析,检查主要肝肾功能指标为:谷丙转氨酶总蛋白(total protein,TP)、(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、ALP、血糖(glucose,Glu)、尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum creatinine,Scr)、尿酸(Uric acid,UA)等生化指标。
1.4.7 溶血实验 取SD 大鼠新鲜血浆2 mL,然后按照1∶10 的比例加入0.9%氯化钠溶液进行稀释,摇匀后放入离心机离心(1 500 r/min,10 min)。弃上清液后,将沉淀的红细胞用0.9%氯化钠溶液洗涤3 次。随后将红细胞用0.9%氯化钠溶液配成2%的红细胞混悬液供试验用。将补肾强筋胶囊内的生药按照1∶3 的比例加入0.9%氯化钠溶液进行稀释,将稀释后药液作为供试药液。取洁净透明离心管7 只并编号,其中1-5 号管为供试药液管,6 号管为阳性对照管,7 号管为阴性对照管。按表1 所示依次在所对应的离心管内加入2% 红细胞悬液、0.9% 氯化钠溶液、供试药液及蒸馏水,混匀后置于37 ℃水浴锅中孵育60 min。孵育时间结束后,将所有待测样品放入离心机离心(3 000 r/min,5 min)。离心结束后,取各组上清液200 μL 于酶标仪545 nm 波长处测OD值并根据公式(1)计算溶血率(HR):溶血率(HR)=(A 试-A 阴)/(A 阳-A阴)×100%
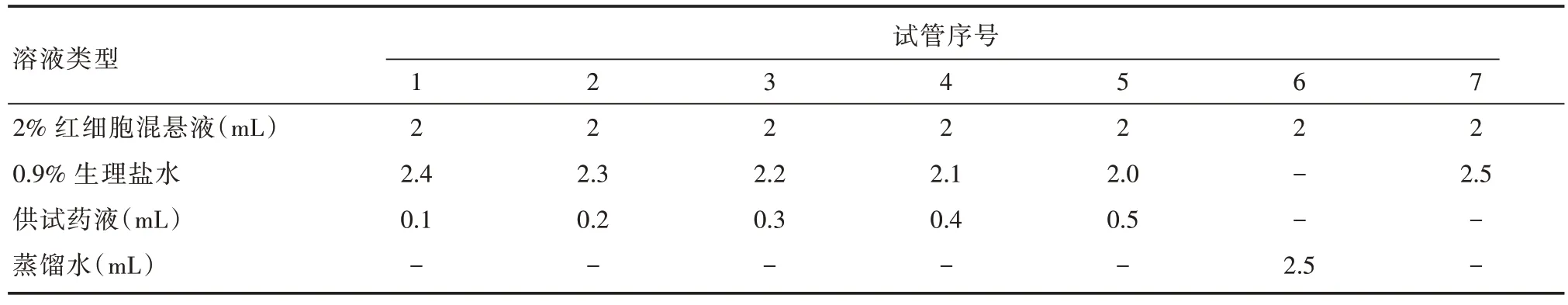
表1 溶血实验中溶液加入顺序Tab.1 Solution addition sequence in hemolysis experiment
表2 大鼠各个时间段体重Tab.2 Body weight in rats at different time periods ±s,g

表2 大鼠各个时间段体重Tab.2 Body weight in rats at different time periods ±s,g
注:BSQJ 组与Control 组比较,雄性和雌性SD 大鼠的不同时期体质量均P >0.05
时间Day 0 Day 1 Day 4 Day 7 Day 11 Day 14合计(只)雄雌Control 组184.00 ± 6.23 186.43 ± 6.74 206.88 ± 7.55 232.52 ± 8.43 257.54 ± 8.27 289.85 ± 7.02 10 BSQJ 组183.26 ± 6.74 186.43 ± 6.28 203.21 ± 8.32 228.75 ± 8.25 256.16 ± 7.79 284.63 ± 8.96 10 Control 组157.28 ± 3.89 160.53 ± 4.47 169.78 ± 4.97 179.02 ± 6.33 202.28 ± 6.24 223.41 ± 6.24 10 BSQJ 组156.24 ± 2.67 157.69 ± 2.97 169.21 ±4.85 175.84 ± 5.70 200.65 ± 6.34 220.24 ± 6.81 10
A 试为各供试药液管OD值,A 阴为阴性对照管OD值,A 阳为阳性对照管OD值。
1.4.8 组织学检查 将SD 大鼠内脏组织从4%多聚甲醛取出,随后将组织置于脱水盒内、依次梯度脱水、包埋、蜡块冷却、切片、脱蜡、依次冲洗、染色、再次梯度脱水、滴中性树胶、盖玻片封固。随后使用电子显微镜观察并采集图像。
1.5 统计学方法 本研究中的实验数据采用SPSS 25.0(IBM,USA)统计软件进行统计学分析,统计数据为计量资料,对于计量资料首先进行Shapiro-Wilk检验判断是否符合正态分布,满足正态分布的计量数据用均数±标准差表示。对于符合正态分布的计量资料,则按照两组独立样本t检验进行分析,并检验方差齐性,方差齐采用t检验进行分析,方差不齐采用t'检验进行分析。当P<0.05 时,差异有统计学意义。
2 结果
2.1 SD 大鼠毒性症状观察及体重变化情况 整个实验过程期间,实验动物未出现动物死亡。见图1,给药前,实验组和对照组的大鼠体重差异无统计学意义。给药后,BSQJ 组与对照组的雄性和雌性大鼠体质量均出现增长,且雄性组大鼠在第0、1、4、7、11 和14 天的体质量差异无统计学意义(P= 0.81、1.00、0.32、0.33、0.71、0.16),雌性组大鼠同样差异无统计学意义(P= 0.50、0.11、0.80、0.25、0.57、0.29)。

图1 大鼠急性毒性实验体质量Fig.1 Acute toxicity experiment weight in rats
2.2 血液学检查 见表3 和表4。分别为BSQJ 组与对照组之间雌性和雌性SD 大鼠体内2 周的血常规的检测结果。检测结果表明,与仅灌胃生理盐水的Control 组相比,BSQJ 组在雄性SD 大鼠所检测的各项指标均差异无统计学意义(P= 0.63、0.91、0.67、0.32、0.46、0.92、0.42、0.32),对雌性SD 大鼠所检测的各项指标也差异无统计学意义(P=0.49、0.47、0.95、0.58、0.93、0.37、0.56、0.80)。
表3 雄性大鼠2 周的血常规结果Tab.3 Blood routine results in male rats at 2 weeks ±s
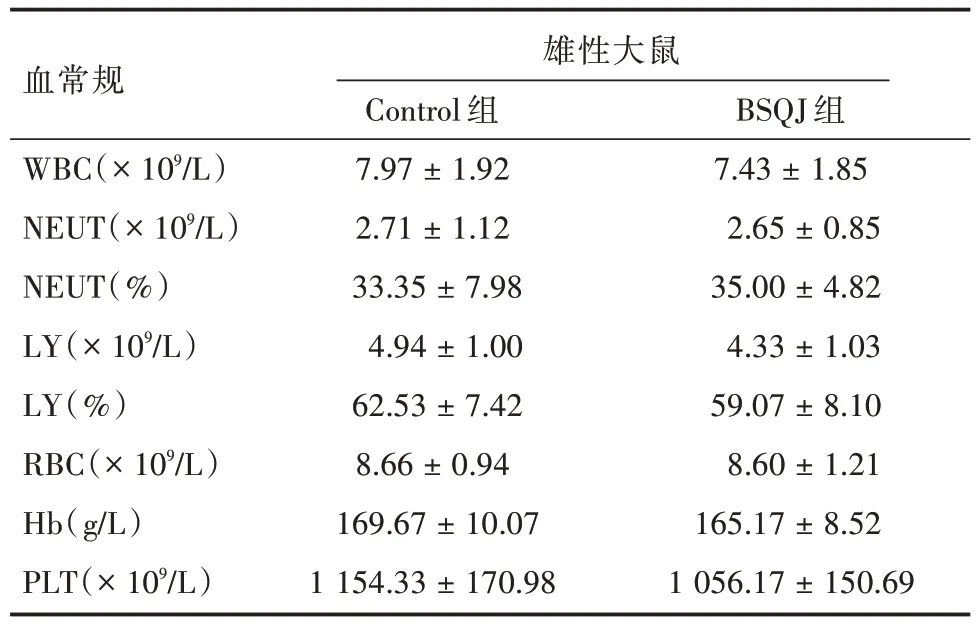
表3 雄性大鼠2 周的血常规结果Tab.3 Blood routine results in male rats at 2 weeks ±s
注:BSQJ 组与Control 组比较,雄性SD 大鼠灌胃2 周后主要血常规指标对比均P >0.05
血常规WBC(× 109/L)NEUT(× 109/L)NEUT(%)LY(× 109/L)LY(%)RBC(× 109/L)Hb(g/L)PLT(× 109/L)雄性大鼠Control 组7.97 ± 1.92 2.71 ± 1.12 33.35 ± 7.98 4.94 ± 1.00 62.53 ± 7.42 8.66 ± 0.94 169.67 ± 10.07 1 154.33 ± 170.98 BSQJ 组7.43 ± 1.85 2.65 ± 0.85 35.00 ± 4.82 4.33 ± 1.03 59.07 ± 8.10 8.60 ± 1.21 165.17 ± 8.52 1 056.17 ± 150.69
表4 雌性大鼠2 周的血常规结果Tab.4 Blood routine results in female rats at 2 weeks ±s
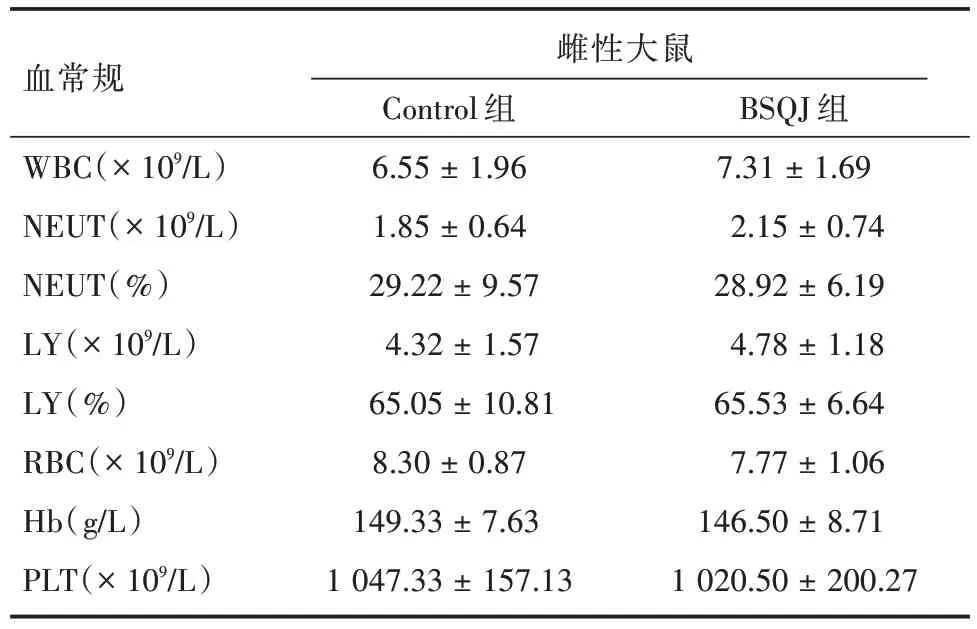
表4 雌性大鼠2 周的血常规结果Tab.4 Blood routine results in female rats at 2 weeks ±s
注:BSQJ 组与Control 组比较,雌性SD 大鼠灌胃2 周后主要血常规指标对比均P >0.05
血常规WBC(× 109/L)NEUT(× 109/L)NEUT(%)LY(× 109/L)LY(%)RBC(× 109/L)Hb(g/L)PLT(× 109/L)雌性大鼠Control 组6.55 ± 1.96 1.85 ± 0.64 29.22 ± 9.57 4.32 ± 1.57 65.05 ± 10.81 8.30 ± 0.87 149.33 ± 7.63 1 047.33 ± 157.13 BSQJ 组7.31 ± 1.69 2.15 ± 0.74 28.92 ± 6.19 4.78 ± 1.18 65.53 ± 6.64 7.77 ± 1.06 146.50 ± 8.71 1 020.50 ± 200.27
2.3 血生化检查 见表5 和表6。分别为BSQJ 组与对照组之间雄、雌性SD 大鼠体内2 周的血生化的检测结果。检测结果表明,与仅灌胃生理盐水的空白对照组相比,BSQJ 组在雄性SD 大鼠所检测的各项生化指标差异均无统计学意义(P= 0.65、0.67、0.95、0.21、0.72、0.17、0.15、0.12),雌性SD 大鼠所检测的各项生化指标差异无统计学意义(P= 0.67、0.11、0.30、0.17、0.21、0.95、0.63、0.59)。
表5 雄性大鼠2 周的肝肾功能结果Tab.5 Liver and renal function results in male rats at 2 weeks ±s

表5 雄性大鼠2 周的肝肾功能结果Tab.5 Liver and renal function results in male rats at 2 weeks ±s
注:BSQJ 组与Control 组比较,雄性SD 大鼠灌胃2 周后主要生化指标对比均P >0.05
肝肾功能TP(g/L)ALT(U/L)AST(U/L)ALP(U/L)Glu(mmol/L)BUN(mmol/L)Scr(μmol/L)UA(μmol/L)雄性大鼠Control 组48.28 ± 3.73 45.85 ± 2.75 152.67 ± 67.82 173.83 ± 33.24 12.22 ± 3.06 7.55 ± 1.77 29.67 ± 5.99 82.83 ± 35.11 BSQJ 组49.20 ± 3.06 49.83 ± 21.72 140.00 ± 65.40 201.83 ± 39.19 13.19 ± 5.60 6.17 ± 1.42 25.00 ± 4.34 53.00 ± 25.18
表6 雌性大鼠2 周的肝肾功能结果Tab.6 Liver and kidney function results in female rats at 2 weeks ±s
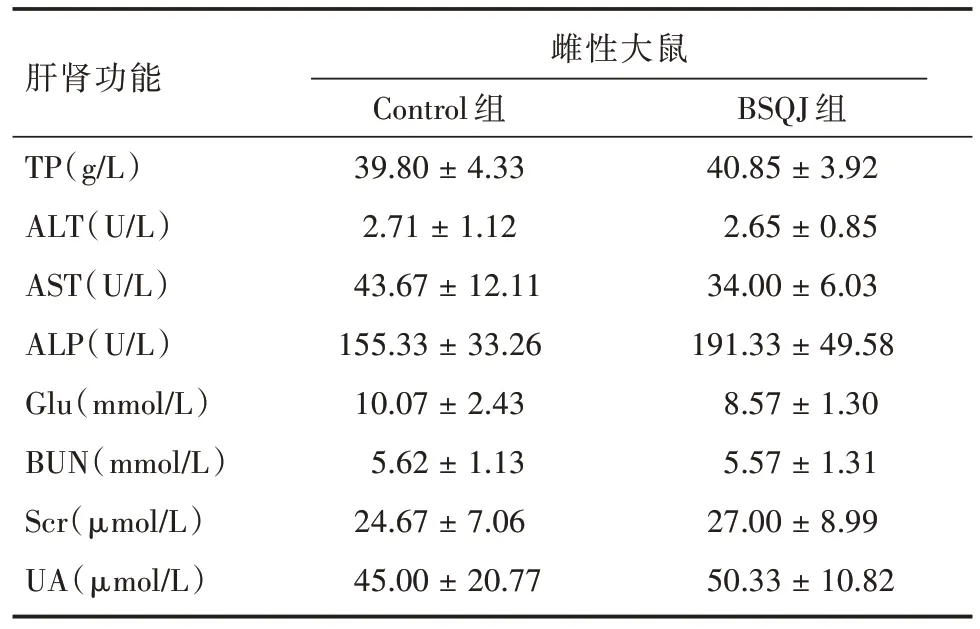
表6 雌性大鼠2 周的肝肾功能结果Tab.6 Liver and kidney function results in female rats at 2 weeks ±s
注:BSQJ 组与Control 组比较,雌性SD 大鼠灌胃2 周后主要生化指标对比均P >0.05
肝肾功能TP(g/L)ALT(U/L)AST(U/L)ALP(U/L)Glu(mmol/L)BUN(mmol/L)Scr(μmol/L)UA(μmol/L)雌性大鼠Control 组39.80 ± 4.33 2.71 ± 1.12 43.67 ± 12.11 155.33 ± 33.26 10.07 ± 2.43 5.62 ± 1.13 24.67 ± 7.06 45.00 ± 20.77 BSQJ 组40.85 ± 3.92 2.65 ± 0.85 34.00 ± 6.03 191.33 ± 49.58 8.57 ± 1.30 5.57 ± 1.31 27.00 ± 8.99 50.33 ± 10.82
2.4 溶血实验 见图2。BSQJ 不同剂量水溶液的溶血情况,图2(A)可以看到各组BSQJ 均未出现溶血现象,图2(B)反映了各组BSQJ 的溶血率情况,结果表明所测试BSQJ 样品溶血率均<5%。

图2 溶血实验Fig.2 Hemolysis experiment
2.5 组织学检查 实验结束时对SD 大鼠进行了剖检,随后对SD 大鼠的心、肝、脾、肺、肾等主要内脏组织进行组织学检查。见图3,H&E 染色结果表明,Control 组和BSQJ 组的各个内脏组织结构正常,未见任何病理性改变。其中,肝小叶结构存在,肝索肝窦未见明显异常,肝细胞体积未明显增大,肝细胞胞浆及胞核未见明显异常。此外,肾组织切片可见肾小球形态及大小正常、边界清晰,近曲和远曲肾小管未见明显异常,肾小管内毒刷状缘结构完整,肾小管上皮细胞未见明显异常,肾间质未见炎性细胞浸润。此外,两组心脏组织结构未见明显异常,未见炎症细胞浸润。肺组织可见正常肺泡及肺间质,未见肺泡腔广泛的缩小或消失,未见炎症细胞浸润。脾脏红、白髓结构清晰,小梁结构明显,白髓内淋巴小结可见。

图3 雄、雌SD大鼠2周心、肝、脾、肺、肾的H&E染色图片(比例尺=100 μm)Fig.3 H&E staining images of the heart,liver,spleen,lungs,and kidneys in male and female SD rats at 2 weeks(scale=100 μm)
3 讨论
补肾强筋胶囊是广东省名中医许学猛教授的经验方,方中选用杜仲、补骨脂、骨碎补进行补肝肾、强筋骨,熟地滋阴补肾,这四药共为君药,血竭活血通络为臣药,另外以全蝎祛风除湿、通络止痛为佐药,合用组方具有强筋壮骨、活血通络止痛等作用,适用于由肝肾不足,筋脉瘀滞所引起的各类骨科疾病的治疗。中医药角度防治骨关节疾病具有整体调节等优点[3]。现代药理学研究证实,方中所选用的中药大多具有促进调节免疫、促进成骨分化和调控炎症等作用。杜仲对多种原因导致的骨质疏松均有治疗作用[4];地黄多糖可以改善骨质疏松大鼠的骨结构[5];全蝎的提取物含有镇痛成分的多肽,可以治疗慢性炎性关节炎和脊椎炎[6];补骨脂素具有多种生物活性,可用于治疗骨质疏松症、肿瘤、病毒、细菌和炎症[7];补骨脂素抑制软骨细胞的炎性生产,可用于减弱骨性关节炎的进展[8];血竭产生类似和肝素抗凝的效果,还具有独特的抗血栓形成的作用[9]。
补肾强筋胶囊经过临床肝肾功能等安全性评价无明显的毒副作用,多年的临床应用中无明显不良反应,然而仍缺乏动物实验安全性研究。查阅相关文献,其中某些成分有肝肾毒性的相关报道。GAO 等[10]通过补骨脂成分的大鼠表皮生长因子受体鉴别试验(EGFR)研究鉴定出补骨脂素、异补骨脂素等107 个化合物,高剂量组小鼠,肝脏和肾脏可能是其主要靶器官,表现为肝细胞变性,肾脏出现脂滴和蛋白管型。YU 等[11]研究发现高剂量补骨脂素给药3 d 显著增加小鼠肝脏系数,降低肾脏系数。组织病理学检查显示肝脏内有少量炎性细胞灶和空泡变性,补骨脂素显著改变了血清中ALT、TBA、BUN 和CRE 的水平。补骨脂素可能会扰乱胆汁酸代谢的平衡通过抑制射流的表达,从而导致肝损伤[12]。
与中药安全性相关的因素主要有两个,即内在毒性化合物和外在有害物质[13-15],中药的疗效和毒性一般取决于其基本物质,中药诱导毒性的机制也非常多样化,可能对各种组织、器官、细胞和分子表现出不同的毒性作用[16]。中药的药物毒性试验中应重视对肝、肾的毒性研究[17]。通过肾病理损伤、血液生化学[18]、代谢组学[19],能够有效检测中药导致的肾损伤。在美国,传统医学药物引起的肝损伤和肝衰竭所占比例不断增加,已经成排名第二的因素[20]。由于肝脏在代谢和解毒方面的首要作用,该器官是药物诱导毒性的重要靶点[21]。中药中的某些成分能诱发各种毒副作用,过量摄入引起的药源性肝损伤也时有发生[22]。
根据《中药、天然药物长期毒性研究技术指导原则》、《药物临床前安全性评价指导原则》和《药物重复给药毒性研究技术指导原则》,血常规是评估中药毒性的基本指标之一。作为药物代谢和排泄的主要器官,肝、肾更容易受到药物毒性的影响。中药复方制剂成分复杂,靶点多,部分有毒的动物类中药可能对肝、肾产生不利影响。因此,中药的药物毒性试验中应重视对肝、肾的毒性研究[17]。溶血是指红细胞的细胞膜因物理、化学和生物等外源性因素受损破裂,进而引起红细胞死亡的现象。中药制剂的成分复杂,存在发生溶血的可能,因此中药溶血性实验也是安全性评价的组成部分。动物实验相对于人类临床试验的优势就是容易获得组织标本,应进行病理性检查。本研究对补肾强筋胶囊开展动物实验进行了体内安全性评价,对保障其安全性应用具有重要的意义。本实验发现:与仅灌胃生理盐水的Control 组相比,相当于临床成人用药剂量的20 倍的大剂量的BSQJ 组在1 日内间隔8 h 3 次最大剂量给药后,SD 大鼠全部存活,且均未出现明显毒性反应,体质量差异无统计学意义(P>0.05),表明BSQJ 组不会引起剧烈的生理变化;血常规(WBC、NEUT、NEUT、LY、RBC、HB、PLT)主要指标、生化主要指标(TP、ALT、AST、ALP、Glu、Bun、SCR、UA)差异均无统计学意义(P>0.05),未出现溶血现象。表明相对于Control 组,BSQJ 组良好的血液安全性,不会发生全身炎性反应、造成明显的肝肾毒性、发生溶血反应。
本研究首次对补肾强筋胶囊院内制剂进行了初步的药物安全性研究,表明大剂量补肾强筋胶囊未对SD 大鼠产生急性毒性反应,未发生肝肾毒性,对主要脏器组织未产生病理性损伤,具有良好的体内安全性。本实验还存在一些不足之处,如未对药物的极量、有效浓度,半数致死量等进行研究;未进行长期的药物安全性实验;未检测凝血指标等,有待进一步研究。
【Author contributions】KE Mingjing and YE Xiangling performed the experiments and wrote the article.LIANG Jiajian performed the experiments.WU Huai and XU Xuemeng revised the article.YE Xiangling designed the study, WU Huai reviewed the article.All authors read and approved the final manuscript as submitted.

