基于生物信息学分析人TXNDC12基因在肝细胞癌的预后价值和作用机制
杨彩婷 姜慧杰 王雨晴 来明名 陈艳 刘永新 王晓旋
【摘要】目的探讨人硫氧还原蛋白结构域蛋白12(thioredoxin domain-containing 12,TXNDC12)基因在肝细胞癌中的表达情况、临床价值以及TXNDC12参与肝细胞癌发生、发展的机制。方法基于TIMER2.0和GEPIA數据库分析TXNDC12在肝细胞癌组织和正常组织的表达差异;选用GEPIA数据库、TCGA数据库分析TXNDC12表达与肝细胞癌患者病理分期和生存预后的关系;选用Linked Omics数据库分析TXNDC12在 TCGA-LIHC 中共表达基因;进一步探究TXNDC12在肝细胞癌中发生、发展的上游调控机制,分析TCGA-LIHC中TXNDC12的甲基化探针与基因表达水平和患者临床预后的相关性。再选用TCGA-LIHC分析TXNDC12与免疫细胞的相关性。结果生物信息学分析表明TXNDC12在肝细胞癌组织中的表达显著高于正常组织。随着肿瘤分期的进展,TXNDC12的表达量明显升高,在肝细胞癌患者中TXNDC12高表达患者总体生存期明显低于低表达患者,且预后模型具有显著的预测效果。与TXNDC12正相关的差异性表达基因有PPIH、MAGOH和BTF3L4等,与TXNDC12负相关的差异性表达基因有IRF6、LOC100130093和GPR17等。在肝细胞癌中,TXNDC12的高表达可能与TXNDC12基因启动子区内的甲基化水平低相关,TXNDC12的表达与肿瘤的免疫细胞浸润有关。结论TXNDC12可作为肝细胞癌预后不良的标志物,TXNDC12在肝细胞癌中的高表达与甲基化有关,并且其可能通过免疫细胞浸润调控肝细胞癌的发生与发展。
【关键词】硫氧还原蛋白结构域蛋白12;肝细胞癌;预后标志物;甲基化;免疫浸润
中图分类号:R735.7文献标志码:ADOI:10.3969/j.issn.1003-1383.2023.08.003
Analysis of prognostic value and mechanism of human TXNDC12 gene
in hepatocellular carcinoma based on bioinformatics
YANG Caiting1, JIANG Huijie1, 2, WANG Yuqing1,
LAI Mingming CHEN Yan LIU Yongxin WANG Xiaoxuan
(1. School of Basic Medicine, Dali University, Dali 671000, Yunnan, China; 2. Department of Pathology of Shenshan
Center, Sun Yat-sen Memorial Hospital of Sun Yat-sen University, Guangzhou 510120, Guangdong, China)
【Abstract】ObjectiveTo explore the expression and clinical value of human thioredoxin domain-containing 12 (TXNDC12) in hepatocellular carcinoma, and the mechanism of TXNDC12 involved in the occurrence and development of hepatocellular carcinoma. MethodsThe expression difference of TXNDC12 in hepatocellular carcinoma tissues and normal tissues were analyzed based on TIMER2.0 and GEPIA database; GEPIA database and TCGA database were used to analyze relationship between TXNDC12 expression and pathological staging and survival prognosis of patients with hepatocellular carcinoma; Linked Omics database was used to analyze TXNDC12 co-expressed genes in TCGA-LIHC; the upstream regulatory mechanism of TXNDC12 in the occurrence and development of hepatocellular carcinoma was further explored, and correlation between TXNDC12 methylation probe and gene expression level in TCGA-LIHC and clinical prognosis of patients was analyzed. In addition, TCGA-LIHC was used to analyze correlation between TXNDC12 and immune cells. ResultsBioinformatics analysis showed that the expression of TXNDC12 in hepatocellular carcinoma tissues was significantly higher than that in normal tissues. With the progression of tumor staging, the expression of TXNDC12 significantly increased. Among patients with hepatocellular carcinoma, the overall survivals of patients with high TXNDC12 expressions were significantly lower than those of patients with low expressions, and prognosis model had significant predictive effect. Differentially expressed genes positively related to TXNDC12 included PPIH, MAGOH and BTF3L4, etc, and differentially expressed genes negatively related to TXNDC12 included IRF6, LOC100130093 and GPR17, etc. In hepatocellular carcinoma, the high expression of TXNDC12 might be associated with low methylation level within the promoter region of the TXNDC12 gene, and TXNDC12 expression was associated with immune cell infiltration of the tumor. ConclusionTXNDC12 can be used as a poor prognostic marker of hepatocellular carcinoma. The high expression of TXNDC12 in hepatocellular carcinoma is related to methylation, and it may regulate the occurrence and development of hepatocellular carcinoma through immune cell infiltration.
【Key words】thioredoxin domain-containing 12 (TXNDC12); hepatocellular carcinoma; prognostic markers; methylation; immune infiltration
肝癌是我国病死率居于第二位的恶性肿瘤,发病率和病死率随年龄增加而不断上升,已成为威胁人类生命健康的最主要的恶性肿瘤之一[1-2]。其中肝细胞癌(hepatocellular carcinoma,HCC)是肝癌的主要组织学亚型,约占原发性肝癌的90%。肝细胞癌的主要病因包括乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染、吸烟、饮酒及黄曲霉素B1感染等[3-9]。随着医疗技术的发展,手术、放化疗等治疗方式不断提高,肝细胞癌的发展得到一定程度的控制,但总体效果仍不理想[10]。因此,研究肝细胞癌的分子机制、靶向治疗肝细胞癌对于评估患病风险,指导临床治疗和提高患者远期生存率具有重要意义。
人硫氧还原蛋白结构域蛋白12(thioredoxin domain-containing 12,TXNDC12),又称作ERp16、ERp18或hTLP19,是蛋白质二硫键异构酶(PDI)家族的一个成员,蛋白质二硫键异构酶家族蛋白被证实在致癌过程中发挥着重要作用[11-14]。目前,TXNDC12已被证实可以通过促进细胞生长、迁移和侵袭来促进人胃癌的发展[15]。在肺腺癌患者中,TXNDC12的表达可能与患者的生存预后相关[16]。此外,在Hela细胞中,TXNDC12的表达可以抑制布雷非德菌素A、衣霉素和二硫苏糖醇诱导的细胞凋亡[17],TXNDC12可作为判断胶质瘤病理分级的分子标志物,且与胶质瘤预后不良相关[18]。近年来,已有研究报道TXNDC12与肝癌之间的关系,但基于生物信息学分析TXNDC12在肝细胞癌预后价值和作用机制仍较为空白。因此,本研究通过生物信息学方法分析TXNDC12在肝细胞癌中的表达、预后关系,并探讨其调控肝细胞癌的可能机制,为肝细胞癌的临床诊治和预后提供新思路。
1资料与方法
1.1数据获取和筛选选用UCSC Xena(https://xena.ucsc.edu/)数据库下载TCGA数据库包含的样本相关数据,其中包括:肝细胞癌(LIHC)RNA-seq的FPKM表达数据,Illumina Human Methylation 450 甲基化数据以及生存数据;选用TIMER2.0数据库、GEPIA数据库分析TXNDC12在肝细胞癌组织和正常组织的表达情况;通过GEPIA数据库分析TXNDC12表达水平与肝细胞癌患者临床病理特征的关系;选用Linked Omics数据库筛选共表达基因。
1.2分析TXNDC12在肝细胞癌和正常组织中的表达差异选用TIMER2.0(http://timer.cistrome.org/)数据库Exploration模块Gene-DE检索 TXNDC12基因在TCGA数据库中所有肿瘤组织和正常组织中的表达情况。利用GEPIA(http://gepia.cancer-pku.cn/)数据库进一步验证TXNDC12在TCGA-GTEx-LIHC中的表达。设定筛选条件如下:|Log2FC| Cutoff:1,p-value Cutoff:0.05,LIHC,Match TCGA normal and GTEx data,得到369 例肝细胞癌组织样品和160例正常组织样品进行表达差异分析。
1.3TXNDC12的表达与肝细胞癌患者病理分期和预后相关性分析通过GEPIA数据库分析TXNDC12的表达与LIHC患者临床病理分期和总体生存期的相关性。首先,选用Expression DIY-StagePlot模块,通过logistic 回归分析TXNDC12的表达与肝细胞癌患者临床分期的相关性。选用Survival Plots模块,根据TXNDC12表达量的中位数,将肝细胞癌患者分为高表达组与低表达组,通过 CoxPH 模型,计算危险比(HR)和P值,绘制总体生存期(overall survival,OS)曲線。采用R(v3.5.3)软件读取TCGA数据库中肝细胞癌样本的基因表达数据及临床数据,运用“survival”包、“survminer”包以及“timeROC”包分别绘制总体生存曲线、ROC曲线以及COX回归分析森林图。
1.4肝细胞癌中与TXNDC12共表达基因的筛选登录Linked Omics(http://www.linkedomics.org/login.php)数据库,设置过滤条件为:TCGA LIHC,Date Type:RNA seq,Statistical Method:Spearman Correlation test,可得到与TXNDC12表达呈正、负相关排名前50的基因。
1.5TXNDC12启动子区甲基化水平与基因表达水平和肝细胞癌患者总体生存期的分析通过UCSC Xena数据库下载Illumina Human Methylation 450 甲基化数据以及生存数据,采用R(v3.5.3)软件的“plyr”包和“ggpubr”包筛选出TXNDC12启动子区甲基化β值最高的11个探针,并绘制柱状图。接下来,采用R(v3.5.3)软件的“ggplot2”包、“ggpubr”包、“survival”包以及“survminer”包对甲基化β值最高的11个探针与基因表达水平和肝细胞癌患者总体生存期的相关性进行分析。
1.6肝细胞癌中TXNDC12与免疫细胞的相关性分析为了探究TXNDC12与肝细胞癌肿瘤微环境中肿瘤浸润免疫细胞(tumor-infiltrating immune cells, TIICs)的关系,通过CIBERSORT分析工具分析TIICs在TCGA数据库中肝细胞癌TXNDC12高表达组和低表达组的表达差异,以小提琴图显示,并采用R(v3.5.3)软件的“ggplot2”“ggpubr”“ggExtra”包分析TIICs与TXNDC12表达水平的相关性。
2结果
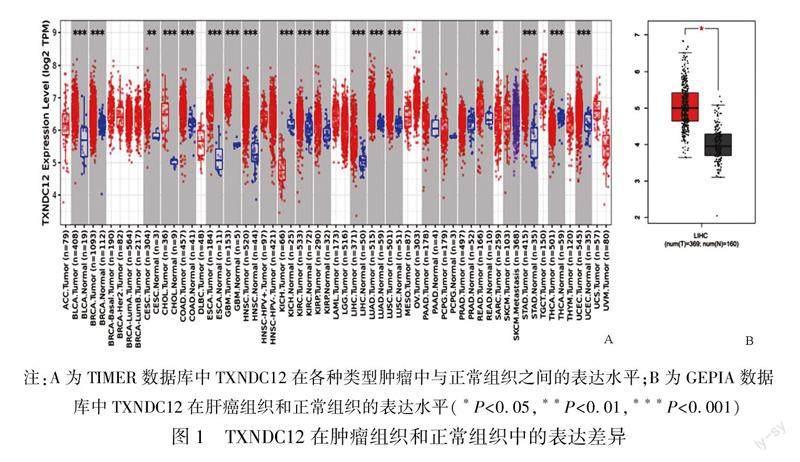
2.1TXNDC12在肿瘤中的表达水平选用TIMER2.0数据库分析人TXNDC12基因在TCGA数据库39种肿瘤中的表达情况,结果如图1A所示,TXNDC12在18种肿瘤组织和正常组织中存在差异表达,其中在乳腺癌、肝细胞癌以及肺细胞癌等肿瘤中显著高表达。在371例肝细胞癌组织中TXNDC12表达水平显著高于50例正常组织,差异有统计学意义(P<0.001)。基于GEPIA数据库进一步验证TXNDC12在TCGA-GTEx 369例肝细胞癌组织和160例正常组织中的表达情况,结果如图1B所示,TXNDC12在LIHC中的表达量显著高于正常组织,差异有统计学意义(P<0.05)。
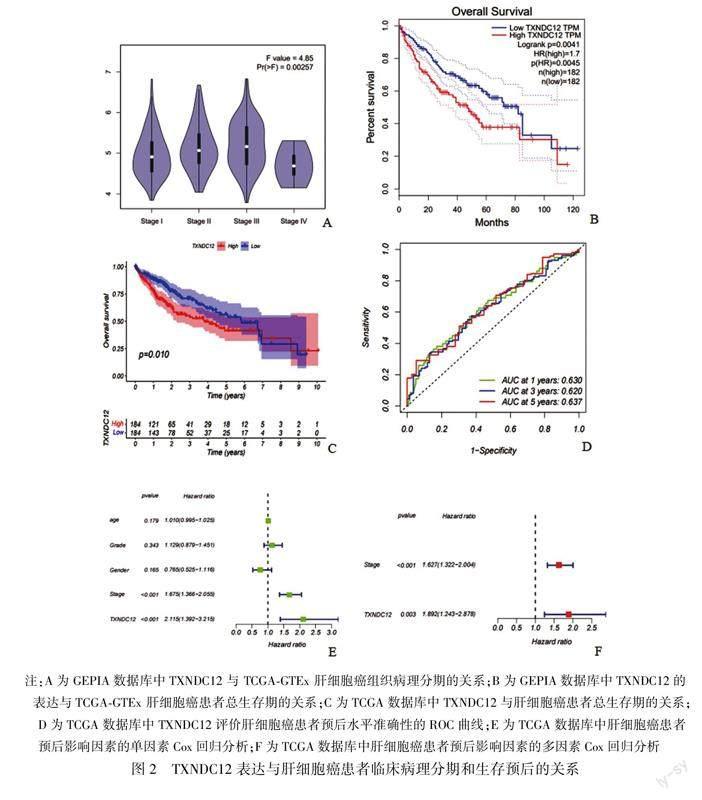
2.2TXNDC12表达与肝细胞癌患者临床病理特征和生存预后的关系为了探究TXNDC12表达水平与肝细胞癌患者临床病理特征的关系,我们选用GEPIA数据库分析TXNDC12与肝细胞癌患者肿瘤分期的关系,结果如图2A所示,随着肿瘤分期的进展,TXNDC12的表达量明显升高,差异有统计学意义[F=4.85,Pr(>F)=0.00257]。接下来,通过GEPIA数据库得到各182例TXNDC12高表达与低表达患者的OS曲线。结果如图2B所示,在肝癌患者中TXNDC12高表达患者总体生存期明显低于低表达患者[logrank P=0.0041,HR(high)=1.7,P(HR)=0.0045]。根据TXNDC12表达量将TCGA数据库中肝细胞癌患者分为高、低表达两组,绘制肝细胞癌患者的总体生存期曲线。结果如图2C所示,在TCGA数据库中TXNDC12的表达量与肝细胞癌患者的总体生存期显著相关,高表达TXNDC12患者的总体生存期显著低于低表达患者(P<0.05) 。我们再根据TCGA肝细胞癌样本绘制ROC曲线,其横坐标代表假阳性率,纵坐标代表真阳性率,结果如图2D所示,其1年、3年和5年的AUC值分别为0.630、0.620和0.637,说明通过TXNDC12的表达对患者预后水平的预测具有较强的准确性,其5年预测水平准确性最高。进一步对影响肝细胞癌患者预后的因素进行单因素和多因素Cox分析,单因素 Cox分析结果如图2E所示,患者肿瘤分级和TXNDC12表达水平均可能影响肝细胞癌患者的预后(P<0.001)。并将上述临床指标纳入多因素回归分析,结果如图2F所示,患者肿瘤分级和TXNDC12高表达是影响肝细胞癌患者预后的独立危险因素(P<0.01)。以上结果提示TXNDC12表达量的增加可能导致肝细胞癌患者的不良预后。
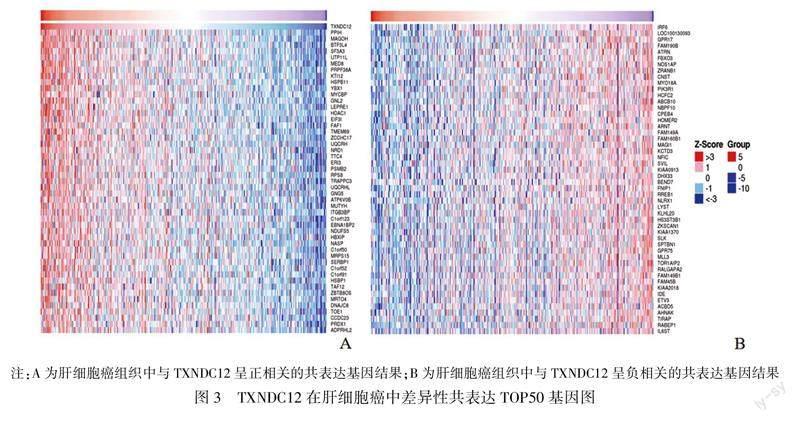
2.3TXNDC12在肝细胞癌中的共表达基因筛选为进一步探究TXNDC12基因参与肝细胞癌进程的潜在机制。我们选用Linked Omics数据库,筛选出与该基因具有正负相关性的50个共表达基因,并以可视化热图形式展示。结果表明:PPIH、MAGOH和BTF3L4等基因与TXNDC12基因表达呈正相关程度自上而下依次排列(图3A);而IRF6、LOC100130093和GPR17等基因与TXNDC12基因表达呈负相关程度自上而下依次排列(图3B)。
2.4TXNDC12启动子区甲基化水平与基因表达相关性的分析采用R(v3.5.3)软件的“ggpubr”和“plyr”包对Illumina Human Methylation 450 甲基化芯片数据进行分析,鉴定出肝细胞癌TXNDC12基因启动子区内的甲基化位点。结果如图4所示,横坐标代表甲基化位点,纵坐标代表甲基化程度的β值。在肝细胞癌中,TXNDC12基因启动子区内共有11个位点,分别是cg20125159、cg11666690、cg09178844、cg04349311、cg27168976、cg1056592、cg10887547、cg25745713、cg26010095、cg05794325、cg00463885,这些位点甲基化水平的β值均小于0.2,处于完全未甲基化。接下来,我们进一步分析在肝细胞癌内,TXNDC12基因启动子区甲基化位点与TXNDC12基因表达的相关性,结果如图5A-K所示,横坐标代表基因的甲基化水平,纵坐标代表基因的表达水平,在筛选出的11个探针中,cg09178844(R=-0.24,P=3e-06)、cg04349311(R=-0.14,P=0.0079)、cg1056592(R=-0.11,P=0.036)、cg25745713(R=-0.13,P=0.012)、cg26010095(R=-0.15,P=0.0044)、cg05794325(R=-0.17,P=7e-04)探针的甲基化β值和TXNDC12表达水平呈负相关。
2.5TXNDC12基因启动子区甲基化位点与肝细胞癌患者生存预后的关系为了探究TXNDC12基因启动子区内的甲基化位点是否参与肝细胞癌的调控,我们对TXNDC12启动子区内的甲基化位点进行生存预后分析。根据TXNDC12甲基化位点表达量将TCGA数据库中肝细胞癌患者分为高、低表达两组,绘制肝细胞癌患者的总体生存期曲线。结果如图6A-K所示,在TCGA数据库的肝细胞癌患者中cg09178844、cg04349311、cg10887547、cg25745713、cg26010095甲基化位点与总体生存期显著相关,其中高表达cg10887547患者的总体生存期显著低于低表达患者,而高表达cg09178844、cg04349311、cg25745713、cg26010095患者总体生存期顯著高于低表达患者,差异有统计学意义(P<0.05)。
2.6TXNDC12的表达与免疫细胞浸润的关系为了进一步探究TXNDC12可能调控肝细胞癌发生的机制,我们根据TXNDC12在TCGA数据库肝细胞癌患者中的表达量将患者分为高、低表达两组,然后对高、低表达两组中的免疫细胞表达水平进行比较。结果如图7所示,幼稚B细胞、记忆B细胞、被激活的CD4记忆T细胞、滤泡辅助性T细胞、M0型巨噬细胞在TXNDC12高、低TXNDC12表达组内差异有统计学意义(P<0.05)。为了进一步验证TXNDC12与免疫细胞的相关性,我们将TXNDC12与免疫细胞之间的表达量进行分析。结果如图8A-G所示,TXNDC12基因的表达水平与记忆B细胞、M0巨噬细胞、被激活的CD4记忆T细胞、滤泡辅助性T细胞呈正相关(P<0.05);TXNDC12与幼稚B细胞、静息肥大细胞以及静息记忆CD4 T细胞呈负相关(P<0.05)。以上结果表明TXNDC12可能通过影响免疫细胞来调控肝细胞癌的发生发展。
3讨论
肝细胞癌是我国发病率和病死率最高的肿瘤之一,也是威胁全球人类生命健康的重大危险因素。因此,筛选出新的肝细胞癌预后标志物对降低患者病死率,改善预后和实现个体化靶向治疗具有重要的意义。TXNDC12属于PDI的重要成员,目前已有报道表明,PDI家族成员在癌症的发生发展过程中扮演重要角色,TXNDC5可以作为一种重要的应激存活因子来维持缺氧条件下CRC细胞的肿瘤发生[19],ERp5在淋巴结微环境中呈现高表达,通过阻断霍奇金淋巴瘤中的NKG2D配体识别来促进免疫逃逸[20]。而TXNDC12作为β-连环蛋白上游的一个新的调控因子,可能通过EMT参与肝细胞癌的转移[11]。然而,基于生物信息学对TXNDC12在肝细胞癌中发生发展的报道,目前仍较为空白。
因此,本研究通过生物信息学对肝细胞癌的多个数据库数据进行分析。基于TIMER2.0数据库,分析TXNDC12在TCGA数据库中多种肿瘤的表达情况,结果显示TXNDC12在TCGA 数据库中18种肿瘤中均高表达,在肝细胞癌中的表达具有极显著的统计学意义。基于GEPIA数据库进一步验证TXNDC12在肝细胞癌中的表达,TXNDC12在肝细胞癌中的表达量显著高于正常组织,与 TIMER2.0 数据相符。基于 GEPIA数据库和TCGA数据库分析TXNDC12表达与肝细胞癌患者病理分期及生存预后的相关性,显示TXNDC12随着肿瘤分期的进展表现为升高趋势,此外,TXNDC12高表达患者总体生存率显著低于TXNDC12低表达患者,TXNDC12可作为判断 LIHC 生存预后的指标。为了进一步探究TXNDC12在肝细胞癌发生发展中的下游调控机制。我们选用LinkedOmics 数据库分析TXNDC12在 TCGA-LIHC 表达的互作基因,显示与TXNDC12存在互作的差异性表达基因有PPIH、MAGOH和BTF3L4 等,可为TXNDC12调控肝细胞癌的分子机制的进一步研究奠定基础。接下来,为了探究TXNDC12在肝细胞癌中高表达的上游机制,我们对TCGA数据库肝细胞癌中TXNDC12的甲基化探针进行分析发现,cg09178844、cg04349311、cg1056592、cg25745713、cg26010095、cg05794325这几个位点的甲基化水平与TXNDC12表达水平呈负相关,其中cg09178844、cg04349311、cg25745713、cg26010095与肝细胞癌患者总体生存期显著相关。目前暂未有文献报道TXNDC12的表达是如何被调控,而它的家族成员:m6A甲基转移酶METTL3通过介导TXNDC5甲基化促进原发性肢端黑色素瘤的进展[21];TXNDC11基因高甲基化患者的预后优于低甲基化患者[22],而TXNDC12的表达是否受到甲基化水平的调控仍需做实验加以验证。最后,我们对肝细胞癌中TXNDC12与免疫细胞进行相关性分析发现,TXNDC12高、低表达组中幼稚B细胞、记忆B细胞、被激活的CD4记忆T细胞、滤泡辅助性T细胞、M0型巨噬细胞存在显著差异。此外,TXNDC12与记忆B细胞、M0巨噬细胞、被激活的CD4记忆T细胞、滤泡辅助性T细胞、幼稚B细胞、静息肥大细胞以及静息记忆CD4 T细胞呈显著相关。提示调控肿瘤免疫反应相关通路可能是TXNDC12促进肝细胞癌进展的重要机制之一,可能与肝细胞癌显著的免疫炎症驱动有关。TXNDC12在免疫调控中的具体作用,以及是否能够作为免疫治疗的生物标志物或联合治疗靶点有待进一步研究。
综上所述,TXNDC12在肝细胞癌中呈高表达,可作为肝细胞癌预后不良的标志物之一,并且为肝细胞癌的个体化诊疗提供新的治疗方向。参考文献[1] CAO W,CHEN H D,YU Y W,et al.Changing profiles of cancer burden worldwide and in China:a secondary analysis of the global cancer statistics 2020[J].Chin Med J,2021,134(7):783-791.
[2] 曹毛毛,李贺,孙殿钦,等.全球肝癌2020年流行病学现状[J].中华肿瘤防治杂志,2022,29(5):322-328.
[3] ZHANG K W,WANG D,CAI H,et al.IL-6 plays a crucial role in epithelial-mesenchymal transition and pro-metastasis induced by sorafenib in liver cancer[J].Oncol Rep,2021,45(3):1105-1117.
[4] LI X,YUAN M,SONG L,et al.Silencing of microRNA-210 inhibits the progression of liver cancer and hepatitis B virus-associated liver cancer via targeting EGR3[J].BMC Med Genet,2020,21(1):48.
[5] 郭蘭伟,张韶凯,刘曙正,等.河南省城市地区肝癌筛查依从性及其影响因素分析[J].中华肿瘤杂志,2021,43(2):233-237.
[6] CHU Y J,YANG H I,WU H C,et al.Aflatoxin B1 exposure increases the risk of hepatocellular carcinoma associated with hepatitis C virus infection or alcohol consumption[J].Eur J Cancer,2018,94:37-46.
[7] JIAO Y,LI Y,JIA B,et al.The prognostic value of lncRNA SNHG4 and its potential mechanism in liver cancer[J].Biosci Rep,2020,40(1):BSR20190729.
[8] PARK H,SHIN S K,JOO I,et al.Systematic review with meta-analysis:low-level alcohol consumption and the risk of liver cancer[J].Gut Liver,2020,14(6):792-807.
[9] 于天怡,朱晓芹,刘志强,等.甘草次酸药物代谢动力学评价及其抗肝细胞癌机制研究[J].井冈山大学学报(自然科学版),2021,42(5):28-34.
[10] SANCHEZ-MEJIAS A,KWON J,CHEW X H,et al.A novel SOCS5/miR-18/miR-25 axis promotes tumorigenesis in liver cancer[J].Int J Cancer,2019,144(2):311-321.
[11] YUAN K F,XIE K L,LAN T,et al.TXNDC12 promotes EMT and metastasis of hepatocellular carcinoma cells via activation of β-catenin[J].Cell Death Differ,2020,27(4):1355-1368.
[12] WANG M,KAUFMAN R J.The impact of the endoplasmic reticulum protein-folding environment on cancer development[J].Nat Rev Cancer,2014,14(9):581-597.
[13] FERNANDO S R,KOTTAWATTA K S A,JIANG L H,et al.Differential expression of protein disulfide isomerase (PDI) in regulating endometrial receptivity in humans[J].Reprod Biol,2021,21(2):100498.
[14] GUO L L,MA L L,LIU C,et al.ERp29 counteracts the suppression of malignancy mediated by endoplasmic reticulum stress and promotes the metastasis of colorectal cancer[J].Oncol Rep,2019, 41(3):1603-1615.
[15] WU J,CHEN X H,WANG X Q,et al.ERp19 contributes to tumorigenicity in human gastric cancer by promoting cell growth,migration and invasion[J].Oncotarget,2015,6(14):11794-11805.
[16] GALVAN A,FRULLANTI E,ANDERLINI M,et al.Gene expression signature of non-involved lung tissue associated with survival in lung adenocarcinoma patients[J].Carcinogenesis,2013,34(12):2767-2773.
[17] JEONG W,LEE D Y,PARK S,et al.ERp16,an endoplasmic reticulum-resident thiol-disulfide oxidoreductase:biochemical properties and role in apoptosis induced by endoplasmic reticulum stress[J].J Biol Chem,2008,283(37):25557-25566.
[18] WANG X,YANG Q,LIU N,et al.Clinical value of TXNDC12 combined with IDH and 1p19q as biomarkers for prognosis of glioma[J].Pathol Oncol Res,2021,27:1609825.
[19] TAN F B,ZHU H,HE X A,et al.Role of TXNDC5 in tumorigenesis of colorectal cancer cells:in vivo and in vitro evidence[J].Int J Mol Med,2018,42(2):935-945.
[20] ZOCCHI M R,CATELLANI S,CANEVALI P,et al.High ERp5/ADAM10 expression in lymph node microenvironment and impaired NKG2D ligands recognition in Hodgkin lymphomas[J].Blood,2012,119(6):1479-1489.
[21] YUE Z H,CAO M,HONG A L,et al.m6A methyltransferase METTL3 promotes the progression of primary acral melanoma via mediating TXNDC5 methylation[J].Front Oncol,2022,11:770325.
[22] PENG P,CHENG F L,DONG Y T,et al.High expression of TXNDC11 indicated unfavorable prognosis of glioma[J].Transl Cancer Res TCR,2021,10(12):5040-5051.
(收稿日期:2023-01-10修回日期:2023-03-21)
(編辑:梁明佩)

