11C-MET-PET/CT 成像对脑胶质瘤1p/19q 共缺失状态预测价值的研究
张 超,于 鹏,赵 恺
(1.天津市人民医院神经外科,天津300122;2.解放军总医院第一医学中心核医学科,北京100853;3.解放军总医院第一医学中心神经外科,北京100853)
0 引言
神经胶质瘤是最常见且异质性很高的原发性中枢神经系统恶性肿瘤[1]。随着基因测序技术的发展,神经胶质瘤的基因组分析已成为临床诊疗的重要工具,通过其发现的核苷酸序列和突变信息是神经胶质瘤细胞的生物学标志物,相关分子及基因突变等特征已经与传统形态学和病理学特征一同被纳入到2016 年世界卫生组织(World Health Organization,WHO)神经肿瘤病理分类指南中[2]。病理学家根据异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变和染色体1p/19q 共缺失的状态将神经胶质瘤分为不同亚型,因此这些突变特征和基因状态已成为诊断和判断预后的重要因素[3-6]。目前研究表明,无论组织学结果如何,神经胶质瘤细胞中IDH 的突变、染色体1p/19q 共缺失的状态和端粒酶逆转录酶(telomerase reverse transcriptase,TERT)启动子突变的发生都可以作为判断预后的独立因素,判断预后效果甚至优于组织学检测[7]。也有研究表明,虽然应用氨基酸PET、MRI 或CT、灌注或弥散MRI 成像等方法能够预测基因突变状态,但目前影像学检查还不能较好地判断胶质瘤染色体1p/19q 共缺失状态[8-9]。氨基酸PET 技术在诊断神经肿瘤方面的应用已有数十年历史,尽管其应用的氨基酸类放射性示踪剂的半衰期较短,但11C-蛋氨酸(11C-methionine,11C-MET)PET/CT(11C-MET-PET/CT)检查仍然是揭示神经胶质瘤代谢状态最有价值的工具。该技术有助于观察颅内肿瘤组织的特征,描述其恶性程度、进展状态等[10],因其具有较高的敏感度、特异度和诊断准确性而得到广泛应用[11-12]。在最新的神经肿瘤反应评估(response assessment in neuro-oncology,RANO)标准中,推荐在神经胶质瘤治疗的每个阶段使用11CMET-PET/CT 评估病情变化及治疗效果[13]。
胶质瘤细胞对氨基酸的需求增加,导致11C-MET的摄取增加。胶质瘤细胞的基因状态,尤其是1p/19q共缺失等特征基因变化,同样会使氨基酸代谢水平发生变化[14]。本研究通过11C-MET-PET/CT 成像技术收集和分析神经胶质瘤的成像和纹理信息,研究1p/19q 共缺失状态与蛋氨酸(methionine,MET)摄取之间的关系,探讨11C-MET-PET/CT 成像对脑胶质瘤1p/19q 共缺失状态是否具有预测价值。
1 资料和方法
1.1 临床资料
选取2016 年1 月至2018 年9 月解放军总医院第一医学中心的56 例术前使用11C-MET-PET/CT扫描获得影像和代谢信息,且经术后病理确诊的新诊断的神经胶质瘤患者。其中男性35 例、女性21例,年龄为(46.46±15.81)岁。手术取得的肿瘤组织均进行病理及基因检测。术后病理显示,23 例为WHOⅡ级胶质瘤,6 例为WHO Ⅲ级间变性肿瘤,27 例为WHO Ⅳ级胶质母细胞瘤。56 例患者中,1p/19q 共缺失阳性患者和阴性患者分别为16 例和40 例。23 例WHO Ⅱ级胶质瘤患者中,1p/19q 共缺失阳性患者和阴性患者分别为11 例和12 例。对上述1p/19q 共缺失阳性患者和阴性患者分组进行进一步分析。本研究通过医院伦理委员会审核和批准。
1.2 1p/19q 共缺失检测
使用荧光毛细管电泳分析检测1p 和19q 启动子的缺失[15],在1p 和19q 常见缺失区域1p36.1~1p36.3和19q13.3 各选择3 个位点进行引物合成并标记荧光。使用石蜡包埋组织基因组DNA 提取试剂盒(Qiagen DNA FFPE Tissue Kit)和天根外周血抽提试剂盒进行肿瘤组织DNA 抽提。然后进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,其扩增体系为:2×Glodstar master Mix 10 μL,引物混合液(10 pmol/μL)1.0 μL,DNA 模板2.0 μL,双蒸水(ddH2O)7.0 μL。反应条件为:95 ℃预变性10 min,变性95 ℃30 s,退火61 ℃40 s,延伸72 ℃10 s,进行2 个循环;随后变性95 ℃30 s,退火53 ℃40 s,延伸72 ℃30 s,进行25 个循环。应用3730 测序仪分析毛细管电泳结果。
1.3 PET/CT 图像及数据采集
进行11C-MET PET/CT 检查前患者禁食至少6 h。静脉注射5.55 MBq/kg(0.15 mCi/kg)11C-MET,并让其在安静的房间里休息。11C-MET 注射10 min 后使用专用的PET/CT 扫描仪(Biograph 40,西门子)在120 kV、206 mSv、3 mm 切片厚度、0.6 mm 间距和300 mm 视野(field of view,FOV)的条件下进行大脑的CT 扫描。持续扫描15 min,在矩阵为400×400、缩放为2 的1 个床位上执行3D PET 采集。使用迭代重建方法(5 次迭代,21 个子集)执行图像重建。采用研究机构开发的定制软件(AnimaM3P)进行数据分析[16],手动执行图像融合并通过数学三线性内插法在内部进行调整,手动匹配和融合参考解剖标志。根据解剖图像和PET 图像,由2 名神经放射科医生(分别具有10 年和2 年经验)手动计算肿瘤的感兴趣区体积(volume of interest,VOI)。2 名医生均不知患者临床信息。然后,AnimaM3P 软件基于强度-体积直方图(intensity-volume histograms,IVH)生成一组一阶纹理特征参数[17](如图1 所示),包括标准差(standard deviation,SD)、中位数(Median)、前25%和后25%(75%)的平均摄取值、Volume、Skewness、Kurtosis、DiffEntropy、DiffVariance、Contrast 和Entropy。此外,记录肿瘤最大标准摄取值(SUVmax)、平均摄取值(SUVmean)、平均标准摄取值(SUVrmean)、肿瘤/正常组织比最大值TNRmax(TNRmax=SUVmax/SUVrmean)和肿瘤/正常组织比平均值TNRmean(TNRmean=SUVmean/SUVrmean)等常规特征。
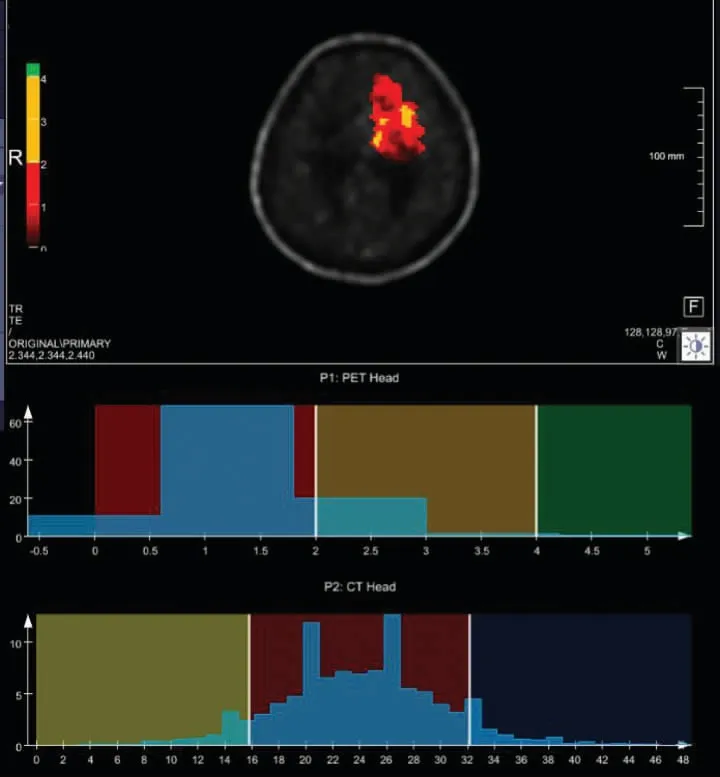
图1 神经胶质瘤纹理分析视图
1.4 统计学分析
所有研究数据均使用IBM SPSS 26.0 统计软件(IBM Corp.)进行分析,ROC 曲线分析采用Medcalc统计软件,用于确定各参数对1p/19q 共缺失状态的预测能力及最佳临界值。参数值组间比较:单因素分析采用独立样本t检验,多因素分析采用Logistics 回归分析。P<0.05 表示差异具有统计学意义。
2 结果
56 例患者中1p/19q 共缺失阳性及阴性患者的11C-MET-PET/CT 参数比较结果见表1。可以看出,非1p/19q 共缺失(阴性)患者的SUVmax(7.92±6.38)和SUVmean(2.92±2.29)高于1p/19q 共缺失(阳性)患者的SUVmax(3.93±1.50)和SUVmean(1.33±0.33)。ROC 曲线分析结果表明,SUVmax的AUC 值为0.724,截断值(最佳临界值,cutoff)为4.900,敏感度为81.25%,特异度为65.00%;SUVmean的AUC 值为0.780,截断值为1.533,敏感度为87.50%,特异度为67.50%;SD 的AUC 值为0.714,截断值为0.757,敏感度为87.50%,特异度为57.50%;Median 的AUC 值为0.770,截断值为1.415,敏感度为81.25%,特异度为72.50%。其中SUVmean表现出了最强的预测能力(AUC 值为0.780),同时,上述几个参数的AUC 值都在0.7 以上,提示具备一定诊断价值(如图2 所示)。但是其他参数ROC 曲线分析并未发现足够的诊断潜力。

表1 所有胶质瘤患者中1p/19q 共缺失阳性及阴性患者的11CMET-PET/CT 参数比较
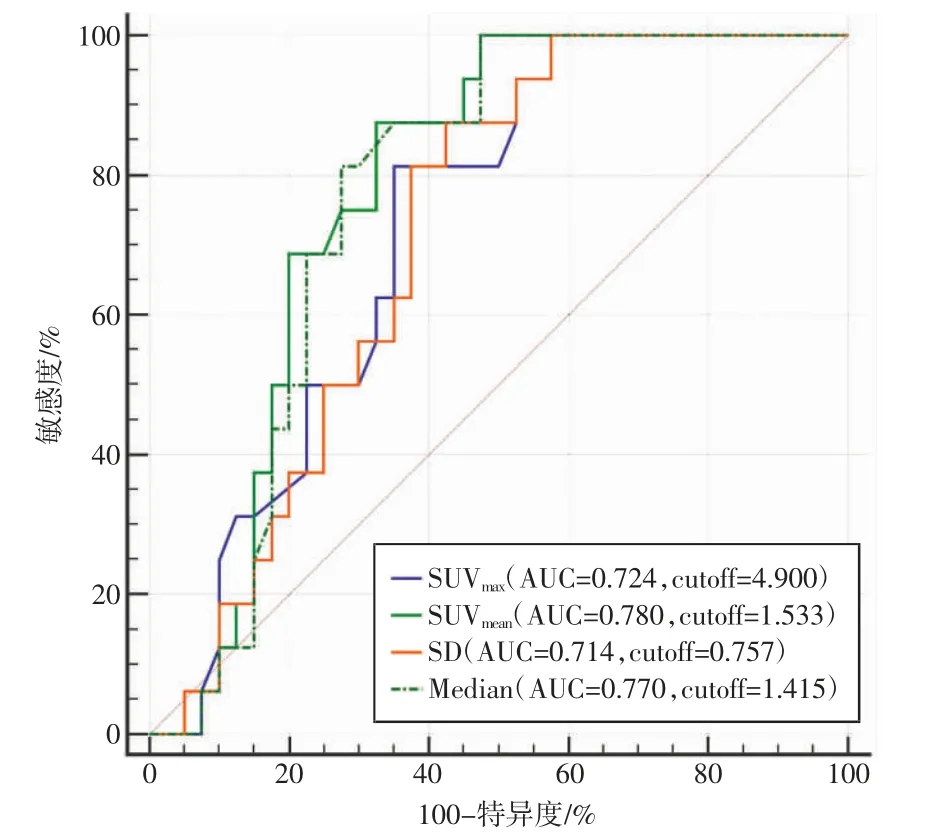
图2 所有胶质瘤患者中各参数(AUC 值大于0.7)预测1p/19q状态的ROC 曲线
对WHOⅡ级胶质瘤患者进一步行亚组分析,可见与全部患者病例分析结果不同的是,具备1p/19q 共缺失的病例,其TNRmax(4.61±1.42)和TNRmean(1.64±0.51)较高,见表2。同时,在纹理分析中,1p/19q共缺失阳性及阴性患者的Entropy 和DiffEntropy 2个纹理参数的差异具有统计学意义,提示这些参数对胶质瘤1p/19q 基因状态可能具有一定的预测潜力。其中TNRmax的AUC 值为0.826,截断值为2.730,敏感度为100.00%,特异度为58.33%;TNRmean的AUC 值为0.731,截断值为1.220,敏感度为90.91%,特异度为75.00%;DiffEntropy 的AUC 值为0.731,截断值为0.662,敏感度为72.73%,特异度为75.00%;Entropy 的AUC 值为0.758,截断值为1.439,敏感度为81.82%,特异度为66.67%,如图3 所示。
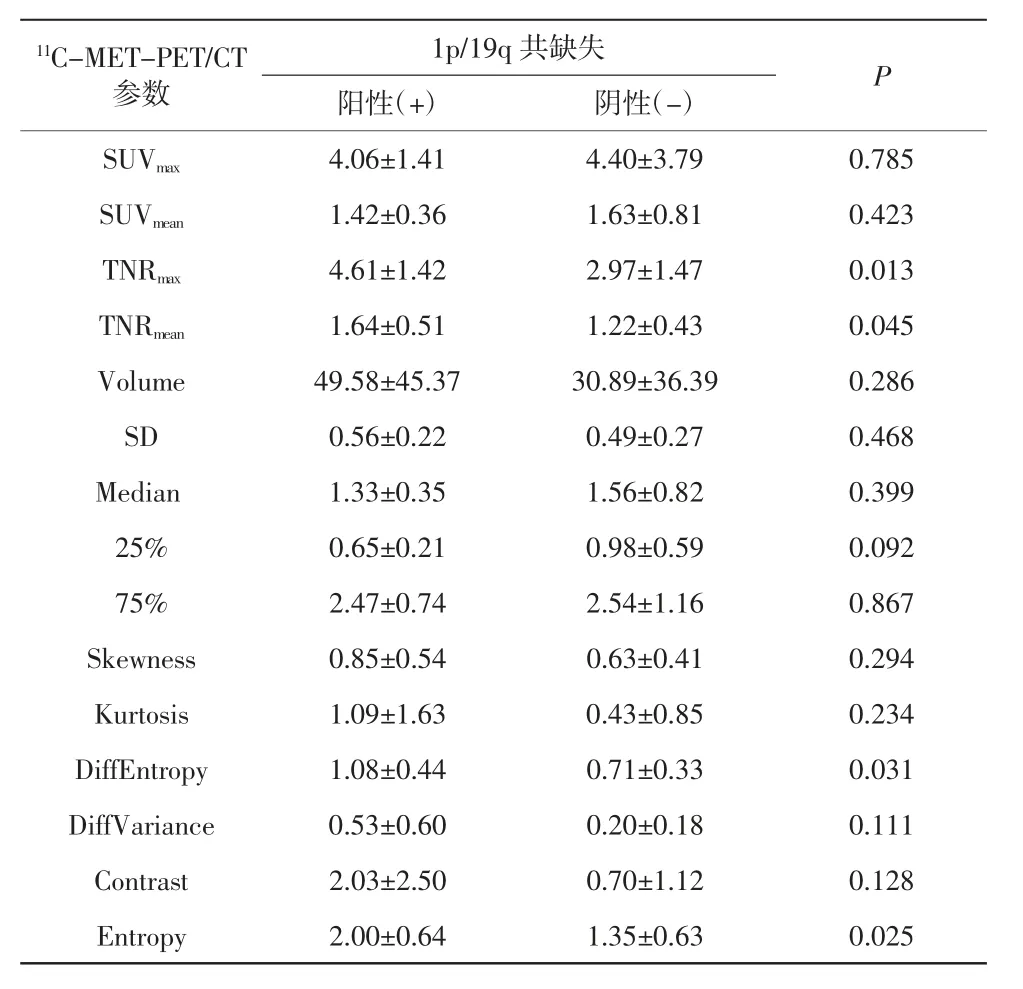
表2 23 例WHOⅡ级患者中1p/19q 共缺失阳性及阴性患者的11C-MET-PET/CT 参数比较
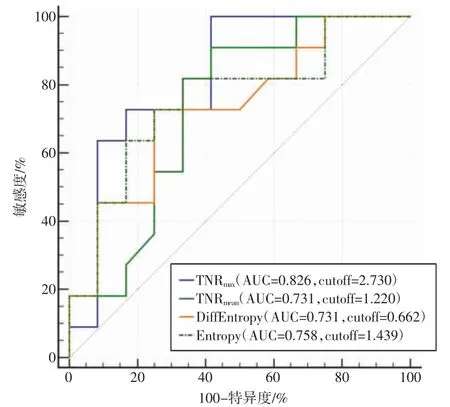
图3 在WHOⅡ级胶质瘤患者中各参数预测1p/19q 状态的ROC 曲线
3 讨论
胶质瘤的分子病理特征逐渐成为重要的预后影响因素,是临床医生制订合适的治疗策略的重要依据。随着基因测序技术的迅速发展,基因突变等检测的临床价值已得到证实。从2016 年WHO 脑肿瘤分类标准开始,已经将胶质瘤的分子病理特征加入到传统的基于形态学的分类标准中,并且越来越多的神经外科医师将核苷酸突变和甲基化状态作为制订综合治疗策略的重要参考,在低级别胶质瘤的治疗中较为明显。目前,IDH 突变和染色体1p/19q 共缺失已经成为诊断低级别胶质瘤的重要标准[2,18-19]。此外,肿瘤分类应主要根据其突变状态,而不是基于其形态学等级[3]。随着基因测序技术的发展,除了传统的病理特征外,胶质瘤的分子病理诊断也被进一步细化。最新的《NCCN 临床实践指南:中枢神经系统肿瘤》中,通过基因和分子检测手段对组织学相似的中枢神经系统肿瘤预后及治疗方案进行了更精准的区分并提出了个体化措施,对临床医师制订诊疗策略具有重要意义[2,20]。同时,最新的一项多中心回顾性研究发现,1p/19q 共缺失患者的手术治疗效果并不理想[3]。
突变和基因表达决定了肿瘤细胞的生物学行为。不同的细胞生物学行为会产生不同的组织学特异性,从而导致神经影像学的异质性。虽然目前的成像技术并不能像组织学和分子病理一样准确描述细胞的基因状态,但CT、MRI、PET-CT 和PET-MRI 等神经成像技术在这个领域仍能提供包括组织学分级、肿瘤细胞增殖、微血管状态等在内的大量信息。同时,基于影像学检查无创性和便捷性的优点,各种成像技术是胶质瘤患者不可或缺的术前评估工具。其中11CMET-PET/CT 因其对胶质瘤的诊断具有较高的敏感度和特异度,而适用于大多数恶性肿瘤的病灶描述和立体定向活检取材[21-22],同时可用于观察辅助治疗效果及病变进展状态。
本研究探讨了神经胶质瘤分子病理标志物与11C-MET-PET/CT 之间的关系。研究结果显示,胶质瘤1p/19q 共缺失状态与MET 摄取之间存在相关性,非1p/19q 共缺失患者MET 摄取能力可能更强。肿瘤的MET 代谢特征与病理分级、1p/19q 共缺失之间密切相关,组织学分级较高且非1p/19q 共缺失的肿瘤患者显示出较高的SUVmax和SUVmean;分级为WHO Ⅱ级胶质瘤患者中,1p/19q 共缺失患者的病灶显示出较高的TNRmax、TNRmean、Entropy 和DiffEntropy。
本研究发现,一些11C-MET-PET 参数与染色体1p/19q 共缺失状态相关。尽管可能的机制尚待进一步的研究,但有理由认为纹理分析参数的Entropy 和DiffEntropy 可以作为1p/19q 共缺失的重要预测因子。本研究结果发现,全部患者中,1p/19q 共缺失患者的SUVmax和SUVmean较低,而在WHO Ⅱ级胶质瘤患者的亚组分析中,1p/19q 共缺失患者的TNRmax和TNRmean均较高。WHOⅡ级胶质瘤患者所显示的结果与2012 年Saito 等[23]所提交的报告中的结果一致。鉴于高级别胶质瘤存在血脑屏障(blood-brain barrier,BBB)的潜在破坏和血管通透性增加的现象,本研究结果表明MET 值与1p/19q 状态相关,且不受肿瘤内微血管通透性等情况的影响。同时,通过对所有患者的分析得出,肿瘤内微血管的状态对PET/CT 中的MET 值有较大的影响。
研究表明,11C-MET-PET/CT 图像平均标准摄取值与L 型氨基酸转运载体1(L type amino acid transporter 1,LAT1)呈现相关性[24]。LAT1 是一种中性氨基酸转运系统,对包括MET 在内的几种人体必需氨基酸具有高亲和力[25]。在高级别胶质瘤中,随着肿瘤内皮细胞中微血管的增加以及LAT1 的密度或活性的增加,MET 的摄取也可能增加[26]。同时,1p/19q 共缺失可能调节下游通路网络,导致少突胶质细胞瘤中氨基酸转运系统的表达和激活以及微血管特征的改变[26-28]。这些变化是否会影响11C-MET-PET/CT 检查结果仍需进一步的研究。
虽然胶质瘤具有不同特征,但SUVmax、SUVmean、TNRmax、TNRmean仍是诊断和判断预后的最有价值的参数。同时,纹理分析进一步提高了11C-MET-PET/CT对神经胶质瘤分类、分型的效能,为神经外科医师对疾病做出合理的诊疗决策提供了更多的参考。
本研究仍具有一定的局限性,主要体现在以下2 个方面:(1)研究纳入了WHO Ⅲ级和Ⅳ级肿瘤患者,患者的异质性可能导致呈现不同的生物学特征,应用亚组分析将与病变等级相关的选择性偏差降至最低,得到了与之前研究一致的结果。但由于治疗手段的不同和样本量的限制,未评估患者的生存期及预后情况,未来将针对上述局限进行进一步研究。(2)由于研究样本的限制,无法避免选择性偏差,期待后续研究可以通过增加样本量对研究结果进行验证,探索更好的技术手段,以为胶质瘤患者的临床诊断和治疗提供更好的帮助。

