滇池不同湖区浮游动物群落稳定性及其驱动因子分析*
杨姣姣,陈 冬,黄立成,李 杨,董晋延,黄 超,王纯波,刘永定,杜劲松,潘 珉**
(1:昆明市滇池高原湖泊研究院,昆明 650228) (2:中国科学院水生生物研究所,武汉 430072) (3:滇池湖泊生态系统云南省野外科学研究观测站,昆明 650228)
群落稳定性是决定生态系统结构和功能能否正常运作的重要特征之一[1],生物多样性与环境因子都对其有较大影响[2]。稳定性是一个非常难以量化的指标,Donohue等[3]根据不同的研究方向主要可以划分为:时间序列稳定性、空间的稳定性、群落更替稳定性、恢复力稳定性。时间序列稳定性主要是指群落中每个生物的数量或者密度会因为时间的推移而有所改变,一般使用群落中每个生物数量的变化系数来进行计算;空间的稳定性主要是泛指群落中的生物量或者丰度会随着空间的变化而有所改变,通常使用不同的群落中生物量在相对于空间的变化系数来进行计算;群落更替的稳定性主要是指群落中物种随一段时间的变化而发生的更新换代,采用群落更替指数进行计算,更替指数值越高,稳定性就会越差;恢复能力的稳定性主要是指微生物群落遭到外界因素破坏而恢复至原状的能力[4-5]。MacArthur 和 Elton 在研究中首次提出,拥有更多物种或者更多物种之间联系的复杂群落比简单群落稳定性更强[6-7]。然而,Gardner等[8]、May[9]通过模型研究得出了相反的结论,即认为包含更多物种以及物种间连接的复杂系统稳定性更低,由于群落处于动态变化中,群落的稳定性与多样性没有直接相关关系。除此之外,最新研究还发现环境因子对群落稳定性与多样性关系也有很多影响,环境因子对生物生长代谢速率、密度和生物量有重要作用,其变化波动可直接导致生物群落结构发生演替[10]。
浮游动物是湖泊生态系统食物链及生物生产力的基本环节,将能量从初级生产者传递给高级消费者[11], 对维持水生态系统的物质循环和能量流动等生态过程的稳定具有重要作用[12-13]。浮游动物的种类组成、数量变化、优势种及污染指示种的变化受湖泊的自然地理环境、水体类型以及人类活动影响较大,不同的种类对环境的敏感性和适应性不同,所做出的响应也不同[14-15]。当水体理化环境及其他水生生物群落发生改变时,浮游动物能够迅速响应,其物种多样性、生物量、稳定性等指标也随之发生变化[5],此外,衡量浮游动物群落结构变化的这几种指标之间也存在复杂的因果关系,相关研究表明,浮游动物多样性对群落稳定性影响很大,但是该效应会受到群落组成和环境的影响。因此,在水环境发生稳态转换的关键时期,研究浮游动物群落结构变化及稳定性具有重要意义[16]。
滇池属长江流域金沙江水系,自1980s后期开始水体富营养化进程急剧加速,水质恶化为劣Ⅴ类,蓝藻水华频频暴发,成为我国污染最严重的湖泊之一[17-18]。“十一五”以来,随着环湖截污、入湖河道整治、农业农村面源治理、生态清淤、生态修复与建设、外流域调水等六大治理工程的实施[19],滇池保护治理工作取得了阶段性成效[20]。2016 年,滇池水质出现明显好转,水质类别由持续13年的劣Ⅴ类转变为Ⅴ类,2018-2020 年滇池全湖平均水质为Ⅳ类[21],但是湖体北部个别监测点位水质仍为劣Ⅴ类,部分水质指标变化不稳定,特别是进入雨季后水质指标会出现较大波动[22]。目前滇池仍然存在水资源匮乏、流域面源污染负荷重、水生态受损等一系列突出问题[21]。水生态修复作为滇池下阶段保护治理的重点方向,对提升滇池水环境生态功能具有重要作用。而水生生物作为水生态系统的关键因素,其群落结构可对水环境变化作出最直接的响应。
受自然条件及历史上的人工干预,滇池自北向南可分为草海、大泊口和外海3个相对独立的水域[23]。在不同程度的人工治理修复下,近年来3个水域营养盐、叶绿素a、透明度等水质指标出现不同程度的改善,水环境状况表现出显著差异。浮游动物作为水生态系统的重要组成部分,能够指示水环境和水生态现状,因而探究水环境改善条件下浮游动物群落稳定性及其驱动因子对生物多样性保护和生态系统健康发展具有重要意义。本研究通过开展滇池3个不同区域浮游动物群落结构的调查,厘清不同湖区浮游动物群落结构特征,并探讨滇池水环境改善下不同湖区浮游动物群落稳定性变化,以期为滇池水环境保护和生态修复提供基础资料。
1 材料与方法
1.1 研究区域概况
滇池湖面高程1887.5 m,水域面积约 309.5 km2,平均水深 5.3 m。滇池水域自1996年修建了船闸以后就被分割为既相互联系,但又几乎互不交换的草海、外海两部分。外海为滇池的主体,平均水深5 m,面积298.36 km2,约占全湖面积的 96.4%;草海位于滇池北部,平均水深2.5 m,面积10.62 km2,约占全湖的3.6%[23];大泊口水域位于滇池草海南部,其与外海间仅由堤埂衍生的海埂相隔,北部透水堤岸与草海相通,面积为0.52 km2,平均水深约 2 m,2015年起开展生态修复,是滇池水生态修复的重要示范水域。其南部水域面积 0.20 km2通过浮游植物微滤净化和水生植被恢复等措施,由以浮游植物为主的浊水稳态转变为以水生植物为主的清水稳态,水质清澈见底[24]。
1.2 样点设置
本研究共设置29个采样点(图1)。草海水域设置6个采样点,编号为C1~C6;大泊口水域设置6个采样点,编号为D1~D6;外海设置17个采样点,编号为W1~W17。

图1 滇池采样点位Fig.1 Sampling sites in Lake Dianchi
1.3 样品采集与处理
分别于2020年1月(冬)、4月(春)、7月(夏)和10月(秋)的上旬开展滇池浮游动物和水环境要素调查。采用Patala’s有机玻璃采水器在每个点的水面下0.5 m处采集水样,20 L水用64 μm的浮游生物网过滤,装入50 mL的小方瓶中,现场加入4%甲醛溶液固定,作为浮游甲壳动物定量样品,同时取1 L混合水样加入10 mL的鲁哥试剂固定,回到实验室静置 48 h 后吸取上清液浓缩定容至 30 mL,用于轮虫样品的鉴定与计数,同步测定水温(Tem)、pH值、溶解氧(DO)、透明度(SD)等理化因子。水样冷藏带回实验室后依据《地表水环境质量标准》(GB 3838-2002)对总氮(TN)、总磷(TP)、生化需氧量(BOD5)、化学需氧量(CODCr)、悬浮物(SS)、叶绿素a(Chl.a)等指标进行测定[25]。浮游甲壳动物用5 mL计数板在显微镜下对所有出现的种类进行鉴定和计数,鉴定主要参考《中国动物志(淡水桡足类)》[26]和《中国动物志(淡水枝角类)》[27]等相关资料描述进行。轮虫样品充分摇匀浓缩后,用移液枪快速吸取1 mL样品置于1 mL计数板内,全片计数,每个样品计数3片,求平均值,主要参照《中国淡水轮虫类》对物种进行鉴定[28]。浮游动物生物量的计算中,枝角类和桡足类生物量湿重根据体长-体重回归方程换算,轮虫生物量根据其平均湿重进行换算[29]。
1.4 数据分析
1)采用非参数多元方差分析(PERMANOVA)进行3个区域群落结构差异性检验[30],利用相似性百分比分析(SIMPER)确定导致不同区域间群落结构差异的物种种类[31]。
2)Shannon-Wiener多样性指数H、Pielou均匀度指数J均使用R4.0.4软件的Vegan包计算;群落优势属选用Mcnaughton优势度指数(Y,Y>0.02确定为优势属),公式为:
(1)
式中,N为采样点浮游动物总个体数,ni/N为第i种的个体数与样品中总个体数的比值,fi为第i种在各采样点出现的频率[32]。
3)采用物种种群密度变异系数(CV)的倒数ICV表示稳定性指数,公式为:
(2)
式中,μ为样方内各物种的平均密度,σ为样方内各物种密度标准差。ICV值越大,各物种密度的变异性越小,群落稳定性越高[33-34]。
4)运用单因素方差分析(One-Way ANOVA)检验区域间水体理化浓度差异。运用t检验分析不同区域间、月份间浮游动物密度、生物量、物种多样性等参数是否有显著性差异。
5)运用Pearson相关分析和冗余分析(RDA)分析滇池浮游动物群落稳定性与水环境因子的关系,分析前对稳定性指数和水环境因子数据进行lg (x+1)转换。
以上统计分析方法都是在R4.04中进行的,RDA分析使用Vegan包完成,每个环境因子对浮游动物群落稳定性贡献及显著性用rdacca.hp包[35]结合RDA分析结果进行层次分割。
2 结果与分析
2.1 滇池3个区域水体理化因子
2020年滇池3个区域水体理化指标年平均值如表1所示,各区域环境因子差异显著,说明滇池不同区域水环境条件存在差异,水体营养状况整体表现为大泊口优于草海,草海优于外海。SS、TP、Chl.a和BOD5浓度均表现为外海>草海>大泊口,但TN浓度则表现为草海>外海>大泊口,CODCr浓度表现为外海>大泊口>草海,草海和大泊口的DO浓度显著高于外海。
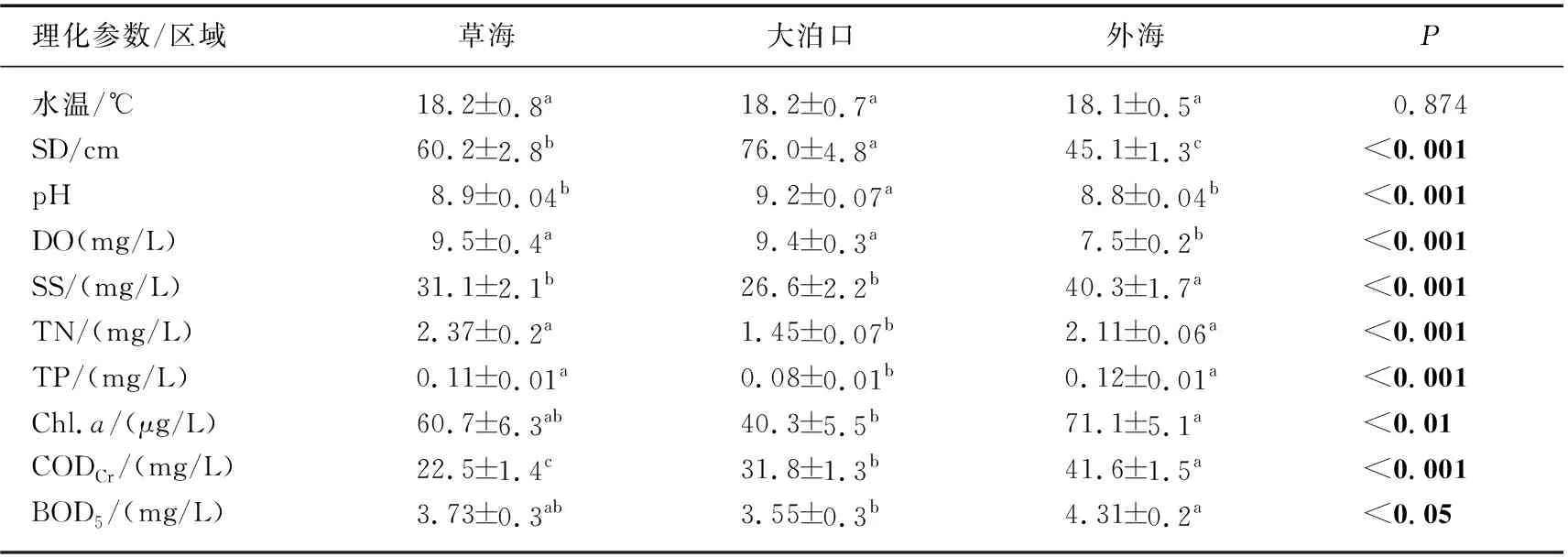
表1 滇池3个区域水环境参数Tab.1 Environmental parameters of three lake regions in Lake Dianchi
2.2 浮游动物群落结构特征
草海共鉴定出浮游动物36属(不包括桡足幼体和无节幼体)(附表Ⅰ),其中枝角类10属、桡足类7属、轮虫19属,分别占物种总数的27.8%、19.4%、52.8%,优势属种为多肢轮属(Polyarthra)、龟甲轮属(Keratella)和异尾轮属(Trichocerca)等轮虫类群的种类;大泊口共鉴定出浮游动物34属(不包括桡足幼体和无节幼体),其中枝角类9属、桡足类6属、轮虫19属,分别占物种总数的26.5%、17.6%、55.9%,优势属种为异尾轮属(Trichocerca)、龟纹轮属(Anuraeopsis)和龟甲轮属(Keratella)等轮虫类群的种类;外海共鉴定出浮游动物32属(不包括无节幼体),其中枝角类10属、桡足类8属、轮虫14属,分别占物种总数的31.2%、25%、43.8%,优势属种为龟甲轮属(Keratella)、异尾轮属(Trichocerca)和盘肠溞属(Chydorus)等多个类群的种类。3个区域浮游动物群落结构均呈现出小型浮游动物物种数多,大型浮游动物物种数少的结构特点。
滇池3个区域浮游动物群落结构组成非参数多元方差分析(PERMANOVA)发现,滇池浮游动物群落结构组成受区域差异影响极显著(P<0.01),3个区域两两间差异也达到极显著水平(图2)。相似性百分比分析SIMPER(附表II)显示,导致草海和大泊口浮游动物群落结构形成极显著差异的物种为龟纹轮属(Anuraeopsis)、疣毛轮属(Synchaeta)、无柄轮属(Ascomorpha)等轮虫类群的种类;导致草海和外海浮游动物群落结构形成极显著差异的物种有基合溞属(Bosminopsis)、溞属(Daphnia)和裸腹溞属(Moina)等枝角类类群的种类,中剑水蚤属(Mesocyclops)和温剑水蚤属(Thermocyclops)桡足类类群的种类以及聚花轮属(Conochilus)、三肢轮属(Filinia)和六腕轮属(Hexarthra)等轮虫类群的种类;导致大泊口和外海浮游动物群落结构形成极显著差异的物种有小剑水蚤属(Microcyclops)和温剑水蚤属(Thermocyclops)桡足类类群的种类以及臂尾轮属(Brachionus)、龟纹轮属(Anuraeopsis)和龟甲轮属(Keratella)等轮虫类群的种类。

图2 基于Bray-Curtis距离的滇池3个区域浮游动物群落结构的主坐标分析(PCoA)排序Fig.2 PCA ordination of zooplankton community structure in three regions of Lake Dianchi based on Bray-Curtis distance
2.3 浮游动物密度和生物量
调查结果显示,3个区域浮游动物密度存在显著差异,浮游动物总密度年平均值大泊口>草海>外海(图3A),且以轮虫为主,而枝角类与桡足类的密度较低。总密度时间变化如图3B所示,草海密度最大值出现在4月,最小值出现在7月;大泊口密度最大值出现在4月,最小值出现在1月;外海密度最大值出现在7月,最小值出现在1月。不同类群浮游动物密度也表现出明显差异,就枝角类而言,年平均密度外海>草海>大泊口(图3C)。枝角类密度时间变化如图3D所示,草海最大值出现在10月,最小值出现在1月;大泊口最大值出现在1月,最小值出现在7月;外海最大值出现在4月,最小值出现在7月。就桡足类而言,年平均密度大泊口>草海>外海(图3E)。桡足类密度时间变化如图3F所示,草海与大泊口最大值均出现在7月,最小值均出现在1月;外海最大值出现在4月,最小值出现在1月。就轮虫而言,年平均密度大泊口>草海>外海(图3G)。轮虫密度时间变化如图3H所示,因3个区域浮游动物密度组成均以轮虫为主,所以轮虫密度时间变化与浮游动物总密度时间变化趋势一致。
3个区域浮游动物生物量无显著差异,浮游动物总生物量年平均值草海>大泊口>外海(图4A),草海和外海总生物组成以枝角类为主,大泊口则以轮虫为主。总生物量时间变化如图4B所示,草海生物量最大值出现在10月,最小值出现在1月;大泊口生物量最大值出现在4月,最小值出现在10月;外海生物量最大值出现在1月,最小值出现在10月。不同类群浮游动物生物量也表现出明显差异,就枝角类而言,年平均生物量外海>草海>大泊口(图4C)。枝角类生物量时间变化如图4D所示,草海最大值出现在10月,最小值出现在7月;大泊口与外海最大值均出现在1月,最小值均出现在7月。就桡足类而言,年平均生物量大泊口>外海>草海(图4E)。桡足类生物量时间变化如图4F所示,草海最大值出现在7月,最小值出现在1月;大泊口最大值出现在4月,最小值出现在1月;外海最大值出现在10月,最小值出现在1月。就轮虫而言,年平均生物量大泊口>草海>外海(图4G)。轮虫生物量时间变化如图4H所示,草海最大值出现在4月,最小值出现在10月;大泊口最大值出现在4月,最小值出现在1月;外海最大值出现在7月,最小值出现在1月。
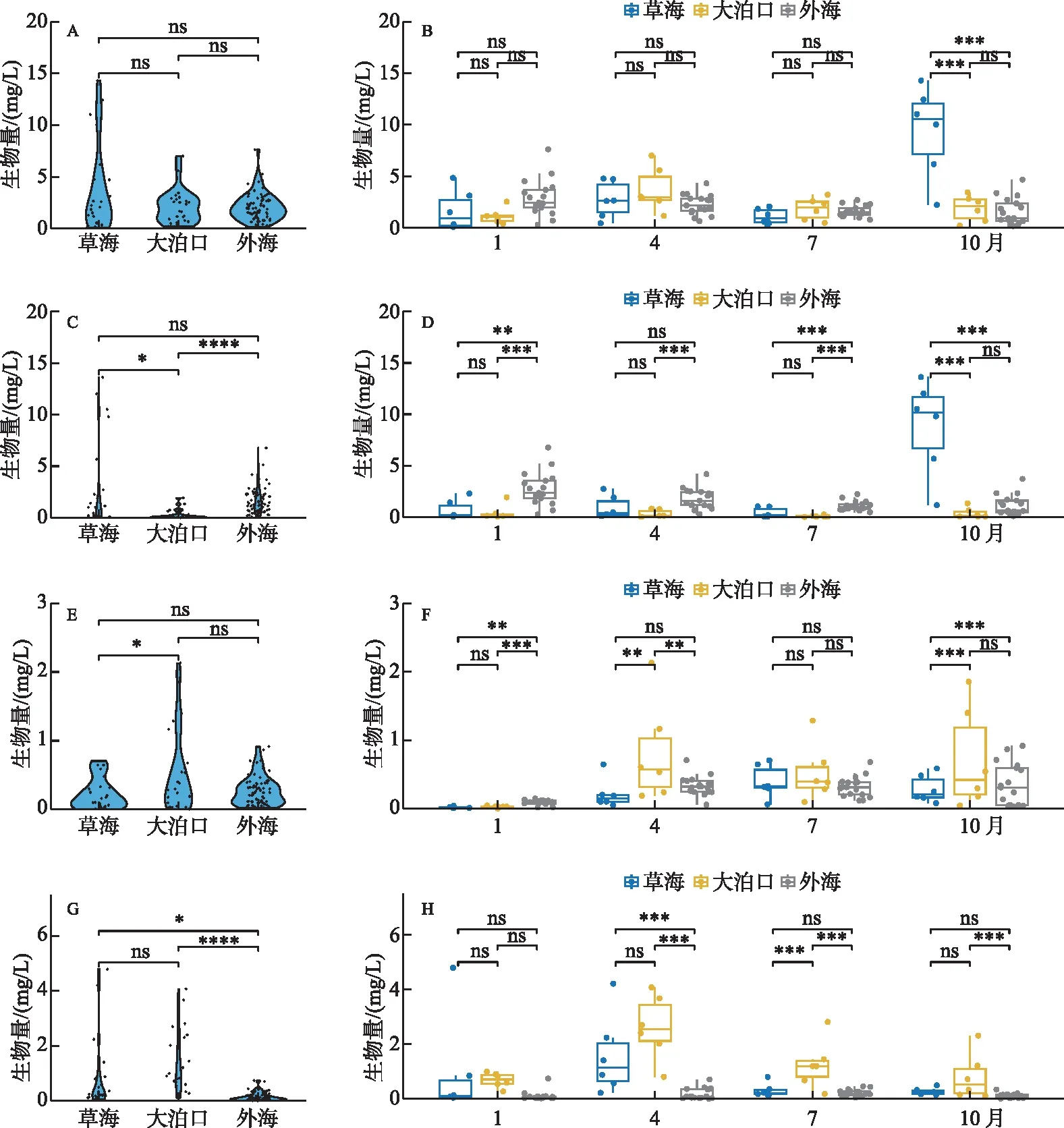
图4 滇池3个区域浮游动物生物量时空变化(A、B: 浮游动物总生物量;C、D:枝角类;E、F:桡足类;G、H:轮虫)Fig.4 Seasonal and spatial variation of zooplankton biomass in three regions of Lake Dianchi(A, B: Total biomass; C, D:Cladocera; E, F: Copepods; G, H: Rotifer)
2.4 浮游动物群落稳定性
浮游动物群落稳定性结果表明,3个区域枝角类、桡足类和轮虫稳定性指数存在较明显差异(图5)。枝角类与桡足类群落稳定性趋势一致,外海稳定性显著高于草海和大泊口,草海与大泊口没有显著差异;轮虫群落稳定性外海显著高于草海,大泊口与外海、草海差异均不显著。总体而言,外海浮游动物群落稳定性指数高于草海和大泊口。
2.5 浮游动物群落稳定性驱动因子
2.5.1 群落稳定性与物种多样性 浮游动物群落稳定性指数和物种多样性关系如图6所示。从图中可以看出,3个区域枝角类群落、桡足类群落和轮虫群落的稳定性与多样性指数(H)和均匀度指数(J)均呈正相关关系,表明随着群落物种多样性的增加,浮游动物群落稳定性有升高趋势。但对比3个区域浮游动物群落稳定性与多样性指数相关性发现,外海正相关关系弱于草海与大泊口。
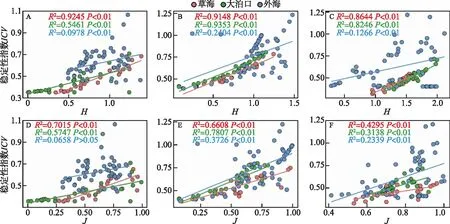
图6 滇池3个区域浮游动物群落稳定性与物种多样性的关系 (A、D:枝角类;B、E:桡足类;C、F:轮虫)Fig.6 The relationship between the stability of zooplankton community and species diversity in three regions of Lake Dianchi (A, D: Cladocera; B, E: Copepod; C, F: Rotifer)
2.5.2 群落稳定性与环境因子 对3个区域浮游动物群落稳定性指数与环境因子进行相关分析,结果共筛选出7个与浮游动物群落稳定性指数存在相关性的环境影响因子,即DO、pH、CODCr、SS、SD、Chl.a和 TP(表2)。
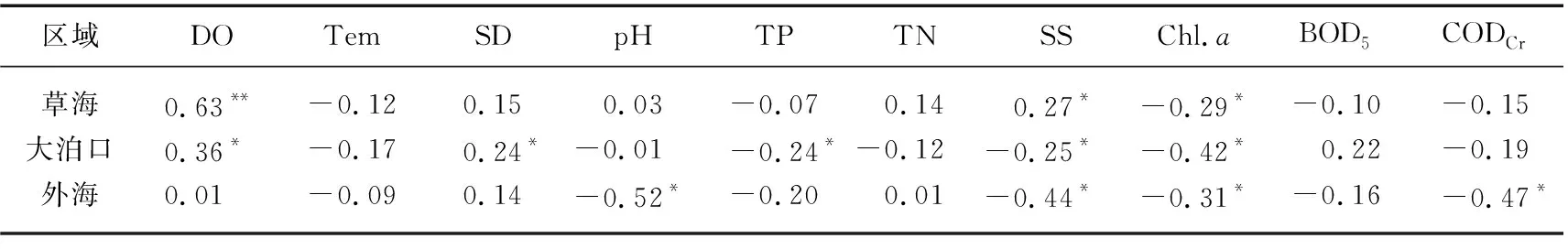
表2 滇池3个区域浮游动物群落稳定性指数与环境因子的Pearson相关系数Tab.2 Pearson correlation coefficient between stability index of zooplankton community and environmental factors in three regions of Lake Dianchi
3个区域浮游动物群落稳定性指数与7个环境因子的 RDA 分析结果显示(图7),就草海而言,7个环境因子共同解释了23.2%的浮游动物群落稳定性信息,其中DO占环境因子总解释率的44.7%,pH占29.6%;就大泊口而言,7个环境因子共同解释了62.3%的浮游动物群落稳定性信息,其中DO占环境因子总解释率的33.3%,pH占24%,Chl.a占22.4%;就外海而言,7个环境因子共同解释了34.4%的浮游动物群落稳定性信息,其中CODCr占环境因子总解释率的24.8%,DO占16.3%,Chl.a占16.2%。

图7 滇池3个区域浮游动物群落稳定性指数与环境因子的RDA排序分析(A:草海;B:大泊口;C:外海)Fig.7 Redundancy analysis of zooplankton community stability index and environmental factors in three regions of Lake Dianchi(A: Caohai; B: Dabokou; C: Waihai)
3 讨论
3.1 滇池理化因子的变化
大泊口水域SD、pH、DO、SS、TN、TP、Chl.a、CODCr和BOD5等理化因子浓度均显著高于或低于外海,草海水域环境因子浓度则介于大泊口与外海之间。其中,大泊口理化因子优于草海和外海的原因是在对滇池开展六大工程综合治理的基础上,自2015年开始大泊口设置了移动式除藻船去除蓝藻水华的措施,并通过人工辅助与自然恢复结合的方式恢复了沉水植物[36]。Wang等在大泊口的研究结果表明,移动式除藻船使蓝藻生物量的去除率超过95%,明显降低了水体叶绿素a浓度,并显著提高了大泊口水体透明度[37]。沉水植物可通过减少风浪引起的底泥再悬浮、过量吸收营养、分泌克藻有机物、保护浮游动物进而增加对浮游植物的捕食等作用来降低水体营养盐浓度维持清水状态[38-40]。大泊口水域CODCr浓度仍然处于较高水平的原因是CODCr组成中溶解性有机物占较大比例(待发表数据),而移动式除藻船去除溶解性有机物效果不明显[37]。
3.2 滇池浮游动物群落组成结构特征
根据1944-1945年张玺和易伯鲁对滇池浮游甲壳动物的调查,发现滇池浮游甲壳动物共22属,其中枝角类18属,桡足类4属[41]。1957年黎尚豪等发现,滇池浮游动物常见种包括龟甲轮虫、臂尾轮虫、同尾轮虫、象鼻溞、低额溞、盘肠溞、秀体溞和剑水蚤等,总密度为520 ind./L[42]。1994 年彭琼英调查发现滇池浮游动物共29属,其中轮虫14属,枝角类8属,桡足类7属,总密度为7563 ind./L[43],优势属种为象鼻溞属、溞属、真剑水蚤属、温剑水蚤属、三肢轮虫属、聚花轮虫属和龟甲轮虫属等。2011 年刘春燕等人调查发现滇池共有浮游动物20属,其中轮虫9属,桡足类7属,枝角类4属,总密度为11371 ind./L[44-45],剑水蚤、盘肠溞为主要优势物种,中剑水蚤、圆形盘肠溞为次优势物种。本研究调查结果与滇池污染治理历程对比发现,2020年3个区域累计有枝角类12属,低于滇池污染前(1980年以前),但又高于滇池污染时期(1987-2010年)。桡足类8属从滇池水质污染到逐渐改善以来变化不大,轮虫目前的21属高于1994年的14属和2011年的9属,浮游动物总密度为3689 ind./L,优势属为象鼻溞属、盘肠溞属、溞属、无节幼体、三肢轮属、臂尾轮属、龟甲轮属和异尾轮属等。浮游动物的种类组成和丰度可以反映水体富营养化程度[46]。与甲壳动物相比,轮虫对水体营养状态的指示作用更为明显,裂痕龟纹轮虫、叶轮属、等棘异尾轮虫、暗小异尾轮虫等种属的轮虫常出现在贫营养水体中,而臂尾轮属、长三肢轮属等是富营养化水体中的常见指示种[47]。另外,甲壳类浮游动物主要类群的相对组成也可以用以指示水体的营养状况。通常,哲水蚤更适应贫营养化的环境,而枝角类和剑水蚤则以富营养化状态下的生物量较高[46-47]。本研究中,大泊口浮游动物贫营养水体指示物种密度高于草海和外海,表明浮游动物群落组成可以一定程度地反映滇池不同区域间富营养化状态差异。
从物种数变化来看,1990-2010年滇池浮游动物种数呈逐渐减少的趋势,原因可能是自1980s以来,随着滇池流域人口不断聚集与工业发展,大量废水、污水直排入湖,污染程度超出了滇池的自净能力,水生态环境的不断恶化使水生生物群落结构发生演替;此外,由于对滇池的人为改造,如围湖造田、修建防浪堤等,滇池生境短期发生较大改变对浮游动物群落也产生了一定的影响。通过对比滇池水质污染严重时期发现,本次调查浮游动物物种数与有升高趋势,浮游动物总密度有下降趋势,但物种组成仍以富营养水体指示种为主。
在优势物种方面,滇池水质污染前的主要优势物种,如对棘同尾轮虫、螺形龟甲轮虫为寡污型,曲腿龟甲轮虫、角突臂尾轮虫、奇异巨腕轮虫为α-中污染型[42],而滇池水质污染严重时期主要优势物种,如萼花臂尾轮虫、曲腿龟甲轮虫、角突臂尾轮虫、迈氏三肢轮虫、广布中剑水蚤、圆形盘肠溞为α-中污型或β-中污型,可见滇池浮游动物逐渐从寡污型演替为β-中污型或α-中污型[44],本次调查发现滇池3个区域常见优势种除α-中污型或β-中污型中之外,还出现了裂痕龟纹轮虫、等棘异尾轮虫、暗小异尾轮虫、螺形龟甲轮虫等为寡污型指数物种的种类。滇池浮游动物群落结构组成发生改变的原因在于富营养化程度的改变,滇池水环境持续综合治理对浮游动物多样性的升高和优势物种出现寡污染阶段的种类有积极的影响。
本研究调查结果显示,滇池3个区域浮游动物总密度受轮虫影响最大,轮虫密度占绝对优势(图3),这与国内大多数大型淡水湖泊、水库等研究结果相似[48]。滇池浮游动物以轮虫占优势的原因可能是鱼类下行效应和富营养化的影响。一方面,滇池以鱼控藻项目增殖放流的鲢、鳙对大型浮游动物有较强的摄食压力,从而减小了轮虫被捕食的压力,使轮虫密度显著高于枝角类和桡足类[49]。另一方面,由于轮虫头冠传感细胞可以感知并且躲避不可食的无机颗粒物,使其与其他物种相比能更好地适应浑浊的水体[50]。同时,透明度较低的水体可以降低其捕食者(如剑水蚤)和食物竞争者(如枝角类)的生长速度,进而提高轮虫的密度[50]。Jeppesen等[51]则认为,在富营养化湖泊中,不论浮游植物的优势种群是对浮游动物滤食率干扰较大的蓝藻还是可食性的绿藻,牧食力较低的小型浮游动物都会成为优势种群。大泊口轮虫密度显著高于其他两个水域,主要原因可能是由于其水草覆盖率较高,而水草可以改变水体的生境特征[52],使附着藻类生物量随着水草覆盖率的增加而增多,且附着藻类可以作为某些依附于水草的轮虫种类的食物资源,从而促进轮虫的密度升高[53]。
很多研究表明水体的营养状况[54]、湖泊面积[55]或是浮游植物的空间特异性都会影响浮游动物群落结构[56]。目前滇池3个区域浮游动物群落结构组成存在极显著差异(P<0.05),但由于本研究中滇池3个区域的面积、水生态状况、边界条件及换水周期等均存在差异,使得解释群落结构组成差异原因存在困难[57]。但从3个区域群落结构形成差异的种类来看,轮虫群落作为大泊口与草海、外海浮游动物群落结构形成极显著差异的主要种类,水草覆盖率不同可能是导致这种差异的主要原因。此外,导致草海和外海两个区域浮游动物结构形成极显著差异的原因除水生态状况和富营养化状况差异外,外流域调水先经草海使得换水周期缩短可能也是形成差异的重要原因之一。
3.3 群落稳定性驱动因子
Shurin等[16]研究表明,浮游动物的群落稳定性与物种多样性有非常复杂的关系。Romanuk等[58]发现物种多样性对稳定性的影响随着营养盐浓度的增加而降低。本研究发现浮游动物群落稳定性与多样性呈正相关,但外海的正相关关系显著弱于大泊口和草海。相关研究认为物种多样性与稳定性的关系与群落自身特征有关[59],同时一些研究表明非生物因子也会同时影响群落稳定与多样性的关系,使得物种多样性对群落稳定性的影响难以预测[60]。
通过RDA分析得出影响滇池浮游动物群落稳定性的环境因子为DO、pH、Chl.a和CODCr等指标,其中,DO浓度对滇池3个区域枝角类、桡足类群落稳定性变化有较高解释率。滇池水环境受到污染后,浮游动物群落中对污染耐受度低的敏感种不断减少和消失,群落结构组成逐渐演变成耐污种,因此DO浓度相对较低的情况下,群落结构单一的枝角类和桡足类群落稳定性更好。Elliott[61]的研究发现在DO浓度下降的情况下,绝大多数轮虫种群密度降低,仅极少数种类如螺形龟甲轮虫和长刺盖氏轮虫等对溶解氧浓度适应范围较宽,在低氧情况下也能维持种群密度。浮游动物进行呼吸作用时需要消耗氧气,这也能解释浮游动物与DO浓度之间的相关关系[62]。此外,相关研究表明pH在6.5~8之间是大多数水生生物生长的最适宜条件[63],在pH值较高(>10)的水体中,臂尾轮属的生物量会显著升高,且过高的pH(>10)值会降低滤食性浮游动物的繁殖力和存活率[64]。因此,滇池3个区域目前的pH值并不利于浮游动物群落稳定性的提高,且大泊口pH值显著高于草海和外海,这可能是导致大泊口枝角类群落稳定性低于草海和外海的重要原因。Chl.a浓度作为表征水体浮游植物的指标,可以代表浮游动物的食物来源。食物的可获得性以及对食物的竞争也是影响浮游动物行为和群落组成的重要因子[65]。本研究发现滇池3个区域Chl.a浓度存在明显的差异,外海浓度显著高于大泊口和草海,说明丰富的食物资源能够维持浮游动物群落结构的稳定性。Timms和Moss[66]比较了一个具有较高睡莲现存量的小型水体和一个无水生植被覆盖的大型水体,小水体中的叶绿素a浓度小于10 μg/L,浮游动物主要由个体较大且与水草相关的枝角类组成,而大水体内的叶绿素浓度较高(>100 μg/L),浮游动物主要由轮虫和小型枝角类组成。
除理化因子外,生物因素也是影响浮游动物群落稳定性的重要因素,其中捕食是影响浮游动物群落结构的重要因素之一。昆明市水产研究所2020年开展的鱼类资源调查表明,目前滇池鱼类资源量最大的种类为红鳍原鲌和鲢、鳙,且红鳍原鲌以小个体种群为主(未发表数据)。相关研究表明[67],滇池红鳍原鲌为杂食性鱼类,小个体红鳍原鲌(<130 mm)主要以浮游动物为食,大个体红鳍原鲌(>160 mm)的饵料食物中小型鱼类和虾类的比重开始增加,随着体长的增加食性发生了明显的转变。此外,浮游动物还是滤食性鱼类鳙的主要饵料[68]。因此,滇池鱼类组成与资源量对浮游动物群落稳定性也有重要影响。
整体来看,外海浮游动物群落稳定性高于草海与大泊口,原因可能是随着水环境状况的不断改善,以耐污种为优势属种建立的浮游动物群落结构开始发生演替,使得水质改善程度较大的草海与大泊口浮游动物群落稳定性相对较差。且受生态修复扰动的影响,水生态修复初期群落稳定性可能会低于修复前的生态系统,而随着生态修复的不断完善,浮游动物群落结构逐渐恢复演替,其多样性和群落稳定性也将有所提高。此外,本文仅研究了环境因子对浮游动物群落稳定性的影响,基于水生态系统结构功能的复杂性,滇池上行和下行效应对浮游动物群落结构的影响是接下来需要研究的重要问题。
致谢:感谢中国科学院水生生物研究所水生生物分析数据管理平台与中国科学院南京地理与湖泊研究所对本研究中浮游动物鉴定提供的帮助。
4 附录
附表Ⅰ、Ⅱ见电子版(DOI: 10.18307/2023.0534)。

