基于DCs探讨芍药苷治疗银屑病的机制
王艾琳,危建安,韩 凌,卢传坚,胡祥宇*
(1. 重庆市中医院/重庆市第一人民医院,重庆 400011; 2. 广东省中医院,广东 广州 510120)
既往研究表明芍药苷可降低Th17细胞相关细胞因子水平[1],抑制IMQ诱导银屑病动物模型中炎症细胞的浸润[2],并且可通过NF-κB和ERK通路抑制TNF-α诱导的血管内皮细胞趋化因子产生和白细胞迁移从而发挥抗炎作用[3],在一定程度上阐明了芍药苷治疗银屑病的机制。但基于DCs研究芍药苷治疗银屑病的具体作用靶点及调控机制尚不明确。
成熟树突状细胞(Mature dendritic cells,mDCs)通过淋巴管迁移至二级淋巴组织内,在此过程中其细胞表型发生了很大的变化,DCs成熟标志物 CD83等表达量逐渐增多,并分泌多种趋化因子及细胞因子(如IL-4、IL-10、IL-12、IL-23等),从而发挥调控T淋巴细胞的作用。总的来说,未成熟树突状细胞(Immature dendritic cells,imDCs)功能主要有抗原识别、摄取及处理,而mDCs的功能主要有抗原提呈及细胞因子分泌,可激活Naïve CD4+T细胞,使其分化成Th1、Th2、Thl7或Treg细胞等。
1 材料与方法
1.1 实验动物
BALB/c小鼠和C57小鼠,雄性,6周龄,体重18g~22g,购于广东省医学动中心。动物许可证书编号 SYXK(粤)2018-0094。
1.2 实验设备和材料
1.2.1 实验试剂
芍药苷(纯度≥95%)购自成都曼斯特公司;红细胞裂解液购自博士德生物公司;Imiquimod(IMQ)购自阿拉丁公司;RPMI-1640培养液、胎牛血清购自Gibco公司;LPS购自SIGMA公司;小鼠细胞因子集落刺激因子(GM-CSF)和白细胞介素-4(IL-4)购自Pepro Tech公司;FITC Anti-Mouse CD11c、FITC Anti-Mouse CD11c、BV421 Anti-Mouse CD86、PerCP-Cy5.5 Anti-Mouse CD80、PE Anti-Mouse CD83、BV510 Anti-Mouse CD83、Alexa Fluro®647Anti-MouseI-A/I-E抗体购自BD公司;PrimeScript RT reagent Kit反转录试剂盒购自Takara公司。
1.2.2 实验仪器
超高速流式细胞分选仪(BD,FACSAriaⅢ)、自动细胞计数仪(Countstar,IC1000)、低温高速离心机(Eppendorf,5810R)、超净台(Esco Airstream,ClassⅡ)、电子分析天平(梅特勒-托利多仪器有限公司)、显微镜(奥林巴斯,BX51T-PHD-J11)、CO2培养箱(Galaxy 170S)、荧光定量PCR仪(Thermo life,ViiA7)、紫外分光光度计(Thermo,SMA2000)、细胞培养板及培养瓶(Corning公司)、全自动免疫磁珠细胞分选仪(Miltenyi,AutoMACS Pro)。
1.3 方法
1.3.1 BMDCs诱导培养
分离C57小鼠股骨、胫骨,收集骨髓腔中骨髓细胞,裂解红细胞,细胞计数后用含10%FBS的RPMI-1640培养液调整浓度为(0.5~1)×106/mL,铺至6孔培养板内,每孔2mL细胞,同时加入小鼠GM-CSF(20ng/mL)和IL-4(10ng/mL),37℃,5%CO2培养箱培养;每2天轻晃培养板,更换3/4体积培养液,补足细胞因子;第6或7天,收集细胞。
1.3.2 Naïve CD4+T细胞的分选
获取BALB/c小鼠脾脏制备单细胞悬液,孵育Naïve CD4+T细胞磁珠,MASC自动分选仪分选收集 Naïve CD4+T细胞。
1.3.3 Naïve CD4+T细胞与BMDCs共培养
BMDCs与Naïve CD4+T细胞按1∶9的比例调整细胞浓度至0.5×106个/mL,铺至6孔培养板内,每孔2mL细胞,芍药苷(5μM、20μM、100μM)提前干预24h,LPS(1μg/mL)或IMQ(10μg/mL)刺激共培养体系48h,5% CO237℃培养箱继续培养24h。
1.3.4 流式检测
收集细胞,标记染色,采用FlowJo V10软件分析流式细胞术数据。
1.3.5 荧光定量PCR检测细胞因子mRNA的表达
芍药苷和IMQ(10μg/mL)干预BMDCs8h,提取总RNA,逆转录合成cDNA,用ViiA7荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。表1为引物上下游碱基序列。

表1 RT-PCR引物序列
1.3.6 统计学处理
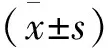
2 结果
2.1 芍药苷对 BMDCs成熟的影响
流式检测结果见图1,与空白对照组对比,IMQ组BMDCs表面CD83、CD86表达显著增高(P<0.0001),但芍药苷不能抑制CD83、CD86的表达(P>0.05),差异无统计学意义。说明芍药苷不能抑制体外IMQ诱导的BMDCs成熟。
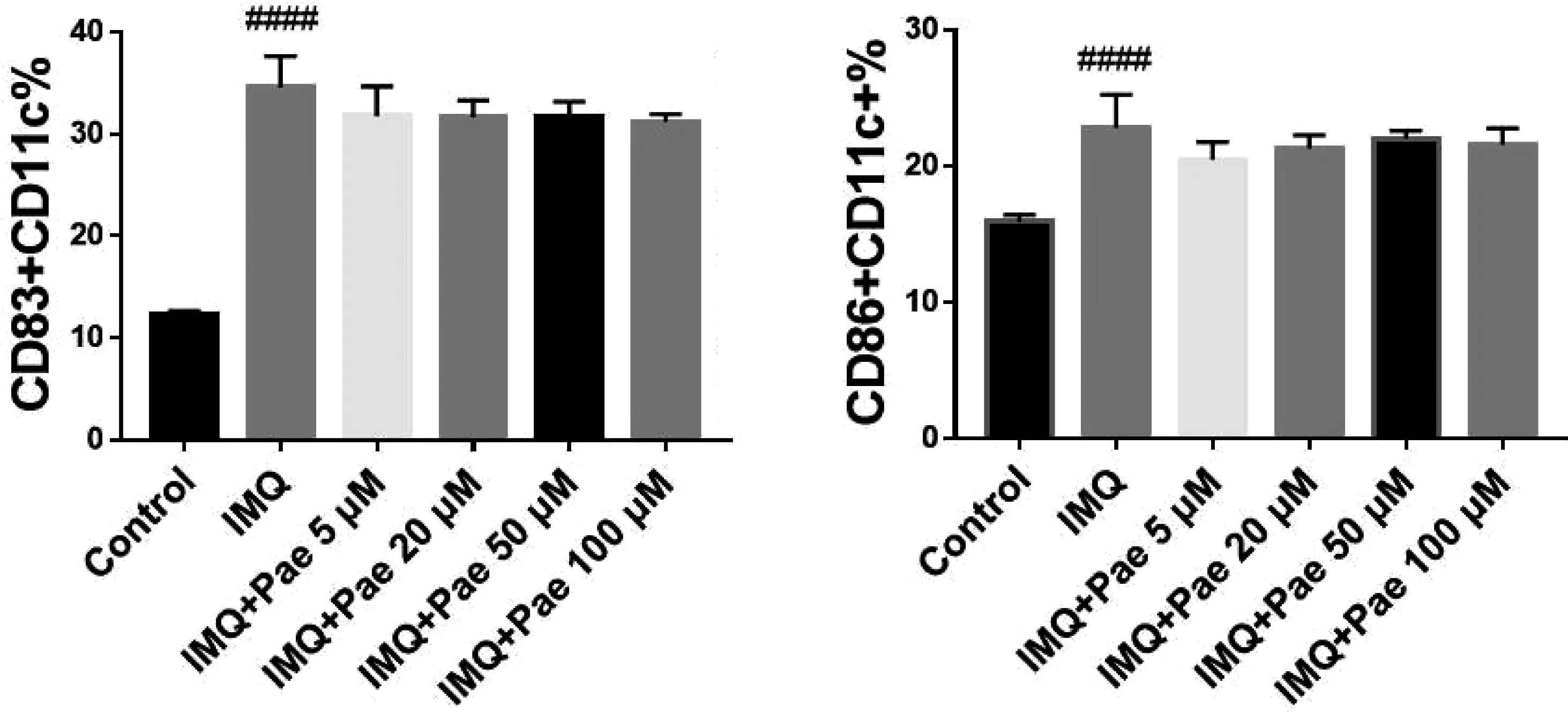
图1 芍药苷 IMQ干预的小鼠 BMDCs成熟的影响 注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001,vs IMQ,#P<0.05,##P<0.01,###P<0.001,####P<0.0001,vs Control.
2.2 芍药苷对 BMDCs 细胞因子 mRNA的影响
RT-PCR检测结果见图2,与空白对照组对比,IMQ造模组BMDCs中基因IL-1β、IL-6、IL-12A、IL-23、IFN-γ及TNF的mRNA的表达显著增高(P<0.05);与IMQ组对比,5μM、100μM芍药苷不能抑制BMDCs中上述细胞因子mRNA的表达,甚至促进炎症因子基因IL-1β、IL-6、IFN-γ、IL-23和TNF的表达(P<0.05)。说明芍药苷不能抑制 IMQ诱导的 BMDCs中炎症因子 mRNA的表达。
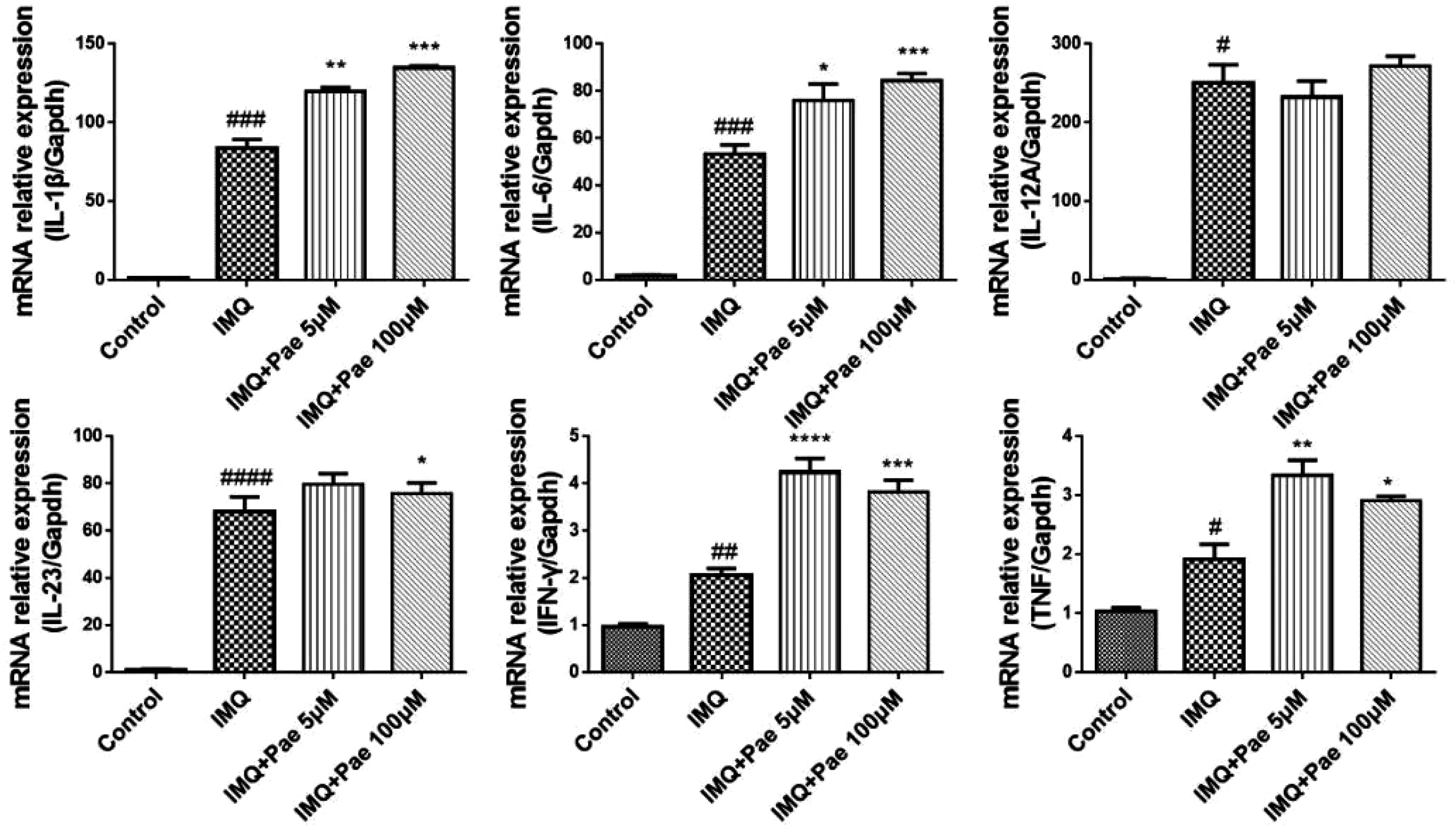
图2 芍药苷对 IMQ 刺激 BMDCs 细胞因子 mRNA的影响 注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001,vs IMQ,#P<0.05,##P<0.01,###P<0.001,####P<0.0001,vs Control.
2.3 芍药苷对 BMDCs调控Treg细胞分化的影响
BMDCs与Naïve CD4+T细胞共培养3天,收集细胞,流式检测Naïve CD4+T细胞的分化。结果见图3,LPS组CD4+CD25+、CD4+CD152+细胞比例与空白对照相比显著减少(P<0.01);5μM、20μM和100μM浓度芍药苷干预后,CD4+CD25+、CD4+CD152+细胞比例具有增高的趋势,其中20μM、100μM芍药苷组CD4+CD25+、CD4+CD152+细胞比例显著增高(P<0.01)。说明芍药苷可能通过上调Treg细胞的表达,从而发挥抗炎抗银屑病的作用。
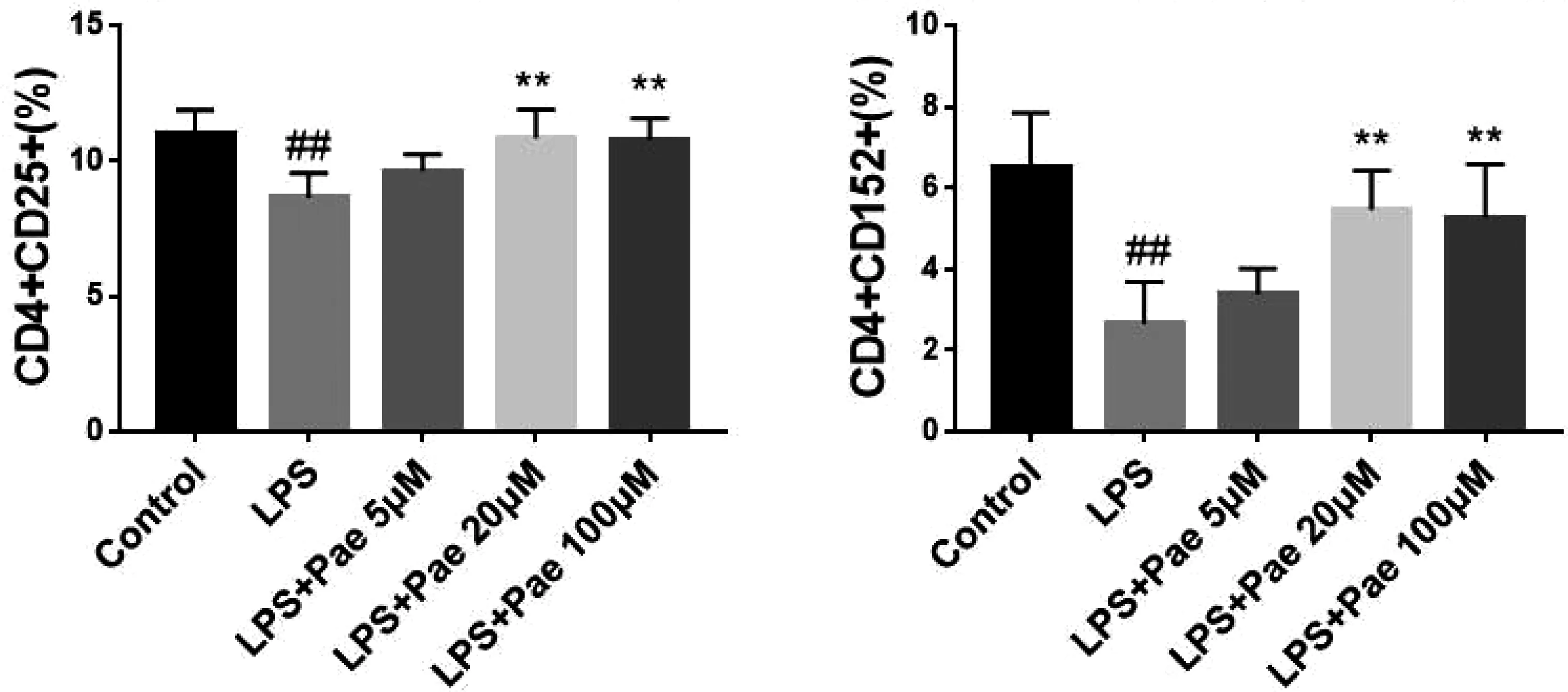
图3 芍药苷对 BMDCs控Th细胞分化的影响 注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001,vs IMQ,#P<0.05,##P<0.01,###P<0.001,####P<0.0001,vs Control.
3 讨论
张晗等[4]研究认为芍药苷可抑制不成熟DCs共刺激分子CD80、CD40和MHCⅡ的表达;史冬梅等[5]发现芍药苷抑制DCs表面分子MHCⅡ、CD40、CD80、CD86的表达,从而抑制DCs表型成熟。但在本研究中,芍药苷在体外未能抑制DCs表面共刺激分子CD83、CD86表达,并且芍药苷不能抑制IMQ刺激BMDCs中炎症因子IL-1β、IL-6、IL-12A、IL-23、IFN-γ及TNF mRNA表达的增高。说明芍药苷不能抑制DCs的成熟和 DCs产生炎症因子。
Treg细胞对维持机体免疫微环境稳态具有重要作用,对效应Th1及Th2细胞均具有抑制作用。据此推测,银屑病患者皮损和外周血中的Treg细胞受损,其对效应T细胞的抑制能力下降,造成免疫稳态失衡。CD152在Treg分化发挥积极作用,芍药苷可诱导Treg分化。郑凯等[6]发现芍药苷能诱导幼稚CD4+T细胞向CD4+CD25+FoxP3+Treg分化并促进IL-10mRNA的产生。本研究表明体外BMDCs与Naïve CD4+T细胞共培养实验中,LPS刺激组CD4+CD25+、CD4+CD152+细胞比例显著较空白对照显著减少,而20、100μM芍药苷可显著增加CD4+CD25+、CD4+CD152+细胞比例。据此推测,芍药苷可能是基于DCs促进Naïve CD4+T细胞向Treg细胞分化,从而发挥抗炎抗银屑病的作用。
4 结论
通过本研究表明芍药苷不能抑制IMQ诱导的BMDCs的成熟和BMDCs中炎症因子IL-1β、IL-6、IL-12A、IL-23、IFN-γ及TNF mRNA的增高;但芍药苷可以通过BMDCs促进Naïve CD4+T细胞向Treg细胞分化,从而发挥抗炎抗银屑病的作用,为芍药苷在银屑病等自身免疫病治疗中的应用提供了实验依据。

