Caspase-9 蛋白在亚慢性砷染毒大鼠睾丸间质细胞中的表达研究
秦海霞,韩 菲,戴研平,刘改萍
(1.乌兰察布医学高等专科学校组胚教研室,内蒙古 乌兰察布 012000;2.岳阳职业技术学院临床医学院,湖南 岳阳414000)
砷是一种生殖毒物,当达到一定浓度时,具有较强的雄性生殖毒性[1-2]。砷可损伤生精细胞,引起精子数量和质量的下降[3]。在精子发生过程中,各级生精细胞都会发生凋亡,它是机体清除过量或异常生精细胞的一种重要方式。越来越多的研究证实天冬酰胺特异酶切的半胱氨酸蛋白酶(Caspase)在细胞凋亡中起重要作用[4-6]。Caspase-9是线粒体介导的凋亡途径中的关键启动子,在大鼠的Leydig 细胞表达[7]。从线粒体释放的细胞色素C与Caspase-9、凋亡蛋白酶激活因子1 结合形成复合物后激活Caspase-9,活化的Caspase-9 剪切并激活Caspase-3,进而促进细胞凋亡[8-9]。该研究通过建立亚慢性砷中毒大鼠模型,利用透射电镜观察附睾精子的超微结构,检测睾丸组织中Caspase-9蛋白的表达,探讨砷致生殖系统损害的机制,以期为进一步研究砷的生殖毒理学特征提供参考。
1 材料与方法
1.1 试验材料
1.1.1 实验动物
健康清洁级10 周龄雄性SD 大鼠40 只,体重为160~220 g,由贵州医科大学动物实验中心提供,动物合格证号为SCK(黔)2002-0001。饲养环境温度为20~25 ℃,相对湿度为60%~65%,正常光照。试验期间,实验动物可自由采食和饮水。
1.1.2 主要药物与试剂
亚砷酸钠,分析纯,购自北京化工厂有限责任公司;Caspase-9 免疫组化链霉亲和素-生物素复合物(SABC)法检测试剂盒,武汉博士德生物有限公司产品;睾酮酶联免疫吸附实验(ELISA)试剂盒,美国CSB 公司产品;醋酸铀,上海瑞诚化工有限公司产品;Epon812 环氧树脂,沈阳市强华试剂厂产品。
1.1.3 主要仪器设备
9905014 型轮转式切片机,购自上海Leica 仪器有限公司;BSll0 型电子天平,德国Sartorius 公司产品;EG1150 型包埋机,德国Leica 公司产品;JEE-5B 型真空冷冻干燥机,北京永光明医疗仪器厂产品;HITCHE-1010 型离子溅射仪,日本日立公司产品;S-3400N 型扫描电镜,日本日立公司产品;CX21 型普通光学显微镜,日本Olympus 公司产品。
1.2 试验方法
1.2.1 亚慢性砷染毒大鼠模型的建立
根据笔者所在课题组的前期研究并结合相关文献[10-11],适应性饲养1 周后,将大鼠随机分为4组,分别为对照组以及低、中、高剂量染毒组,每组10 只。采用自由饮水方式进行染毒,低、中、高剂量染毒组染毒剂量分别为2.4、12、60 mg/L,连续染毒14 周。对照组给予蒸馏水。每天观察大鼠的健康情况,每周测定并记录大鼠体重。
1.2.2 检测指标及方法
1.2.2.1 大鼠白细胞计数及血清TNF-a、IL-1 浓度的检测
试验结束时,用血常规管收集大鼠外周血,利用全自动动物血液分析仪进行白细胞计数;用采血EP 管收集心脏血液,3 000 r/min 离心8 min,取上清液,放入-20 ℃冰箱待测,严格按ELISA 试剂盒说明书步骤进行操作,通过公式换算,得出TNF-α 及IL-1 的浓度值。
1.2.2.2 透射电镜观察附睾精子的超微结构
观察指标:①正常精子头部形态(顶体为双层膜性结构,双层顶体膜间为低电子密度,核染色质较均匀);②正常精子尾部形态(颈部和尾部结构完整,尾部自然弯曲,其中央纤维鞘呈平行排列,可见微管“9+2”结构);③精子顶体完整状况、颈部线粒体鞘肿胀情况。
每组随机取4 只大鼠,在附睾尾部用眼科剪剪出约5 mm 小口,交替挤压,将精子挤出,用PBS液洗涤3 次并离心(2 000 r/min),每次10 min;取1~2 滴精液标本,采用3%戊二醛固定3 h;PBS 洗3 次,每次15 min,1%锇酸固定2 h;PBS 洗3 次,每次15 min;30%、50%、70%、90%丙酮梯度脱水各1 次,每次10 min,100%丙酮脱水3 次,每次10 min;环氧树脂浸透、包埋、聚合;超薄切片机切片;醋酸铀染色30 min;柠檬酸铅染色10 min;透射电镜观察精子超微结构并摄片。
1.2.2.3 免疫组化法检测睾丸组织中间质细胞Caspase-9 蛋白表达情况
染毒结束后,大鼠乙醚麻醉,股动脉放血处死,取左侧睾丸分成4 份,迅速置于10%中性甲醛溶液(磷酸盐缓冲液调节pH 值至7.4)中固定,备用。常规方法脱水,用石蜡包埋。取方位相同的标本连续切片4 张(厚度4 μm),采用免疫组化法检测Caspase-9 蛋白的表达情况,严格按照试剂盒说明书操作。40 倍目镜下观察5 个视野,采用Biomias 图像分析软件测定阳性细胞的平均光密度值,数值越高表明Caspase-9 蛋白的表达量越高。
1.3 数据处理
采用SPSS 26 统计学软件进行数据分析。试验结果以“平均值±标准差”的形式表示,先进行正态分布及方差齐性检验,然后进行单因素方差分析(One-Way ANOVA)。若方差齐时,组间两两比较用LSD 检验,反之用Games-Howell 检验;检验水准α=0.05,以P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 大鼠白细胞计数及血清TNF-α、IL-1 浓度检测结果
由表1 可知,随着亚砷酸钠染毒浓度的升高,大鼠血清中TNF-α、IL-1 浓度及白细胞计数均呈上升趋势。与对照组相比,中、高剂量染毒组大鼠血清中TNF-α、IL-1 浓度及白细胞计数均显著升高(F=6.31,P=0;F=7.22,P=0;F=5.07,P=0)。
2.2 精子透射电镜检查结果
由图1 可知,对照组大鼠精子顶体结构完整,厚度及染色均匀,顶体为双层膜性结构,平行贴于核表面,双层顶体膜间为低电子密度,胞核染色质均匀;低剂量染毒组与对照组相比,精子结构无明显变化,顶体胞膜肿胀,核染色质较均匀;中剂量染毒组精子顶体与核分离,胞膜肿胀;高剂量染毒组精子尾部中断,轴丝排列紊乱。
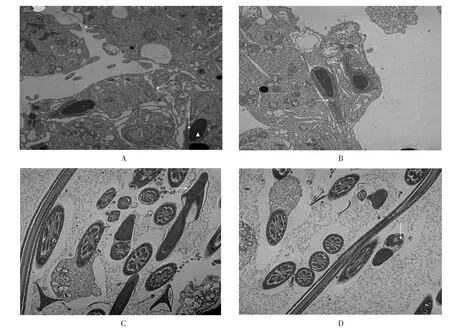
图1 亚慢性砷染毒大鼠精子形态的透射电镜图(15 000×)
2.3 大鼠睾丸间质细胞中Caspase-9 蛋白表达检测结果
光镜下,各组大鼠睾丸组织中均可见Caspase-9 蛋白表达阳性信号,定位于睾丸间质细胞的细胞质中,呈棕黄色或棕褐色。对照组,阳性细胞染色浅;低剂量染毒组,阳性细胞较对照组染色深;中剂量染毒组,阳性细胞较对照组、低剂量染毒组染色深;高剂量染毒组阳性细胞染色深(见图2)。由表2 可知,与对照组相比,各剂量染毒组阳性细胞平均光密度值均显著升高(F=8.50,P<0.05)。
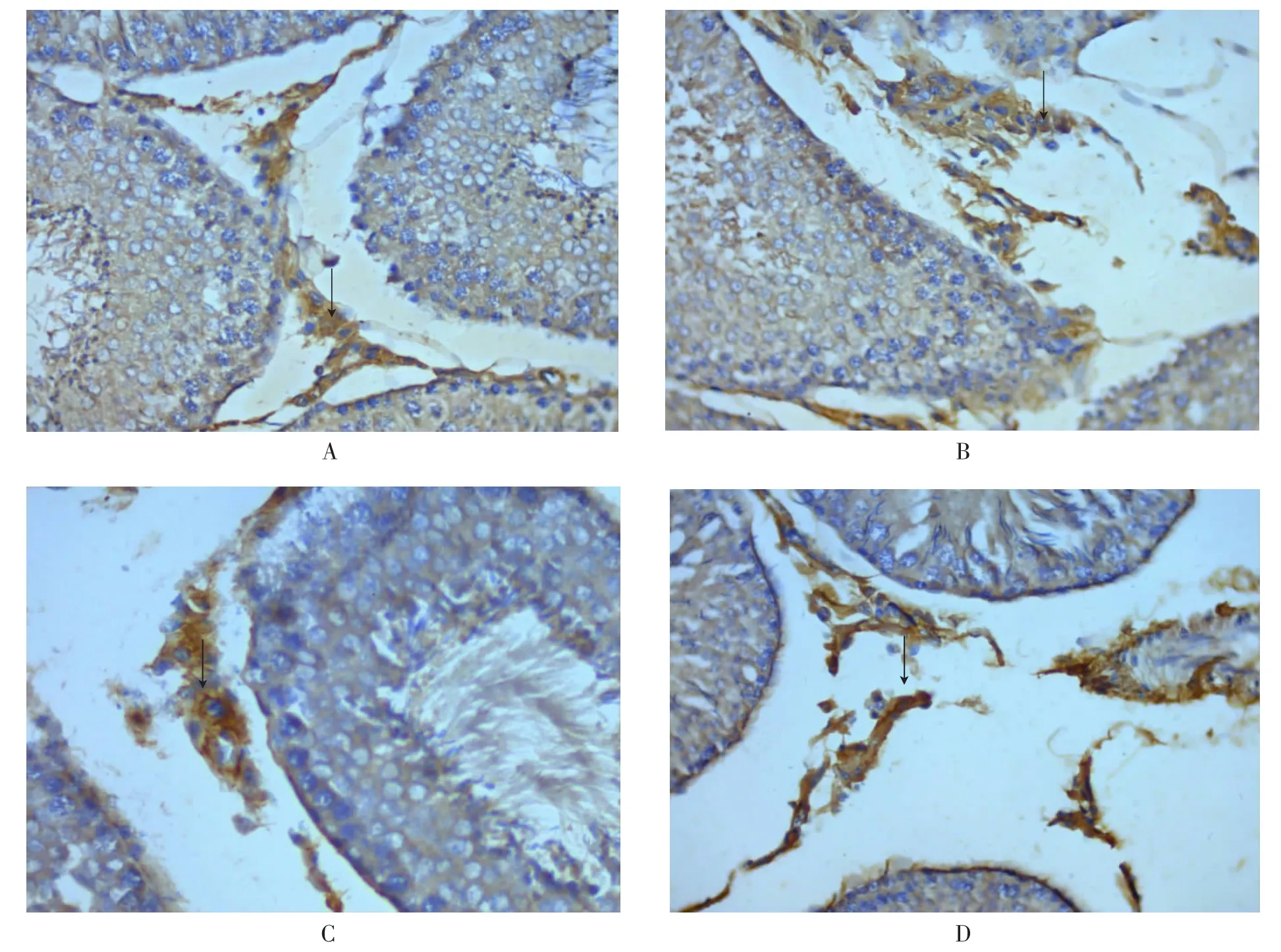
图2 免疫组化法检测大鼠睾丸间质细胞中Caspase-9 蛋白表达情况(400×)
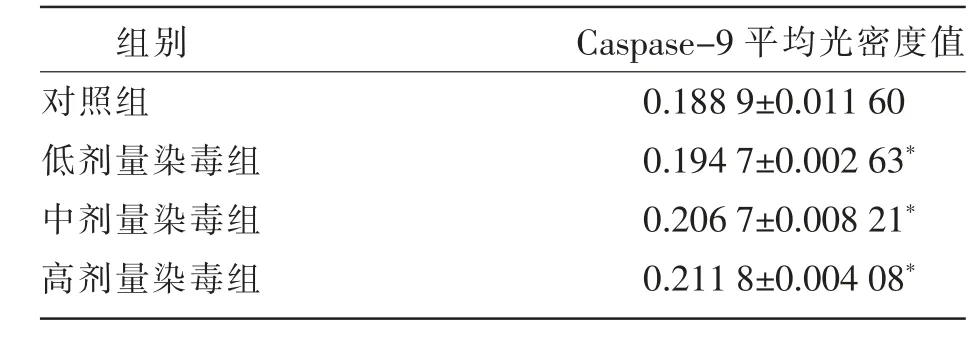
表2 大鼠睾丸间质细胞Caspase-9阳性细胞平均光密度检测结果
3 讨论
机体的生殖发育过程对外源化学物的作用比较敏感。外源化学物质可干扰机体生殖发育多个环节,并造成损伤作用,对生殖过程的影响范围广泛且深远[12-13]。
动物实验证实,睾丸巨噬细胞和生精细胞都能分泌大量的TNF,其中,TNF-α 参与影响FSH对支持细胞生精功能的调节[14]。TNF-α 可增加IL-1 对睾酮分泌的抑制作用,降低Leydig 细胞对促性腺激素的反应敏感性。IL-l 能改变血睾屏障的固有防御功能,增加细菌或氧自由基等有害物质进出睾丸的机会[15]。该研究结果表明,随着染砷浓度的增加,大鼠血清中TNF-a、IL-1 浓度以及外周血白细胞计数也增加,中、高剂量染毒组3 项指标与对照组相比差异显著,推测可能长期砷暴露导致了睾丸的炎症反应。
电子显微镜是目前观察精子形态的最有效工具,其分辨率超高[16]。精子分为头部和尾部,头部有一个高度浓缩的细胞核,核的前2/3 有顶体。顶体是一种特殊的溶酶体,内含多种水解酶,如顶体酶、透明质酸酶等,在受精过程中发挥重要作用。该研究中,透射电镜观察下可见中、高剂量染毒组大鼠精子胞膜受损,顶体与核分离,核内出现空泡,进一步证实亚砷酸钠可使精子顶体超微结构改变,胞膜受损,主要表现为顶体内外膜分离,顶体内容物丢失或顶体膜上结合的透明质酸酶等活性降低[17-18]。
生精细胞的凋亡可以有效清除不正常的生精细胞,并严格控制生精细胞和支持细胞的适当比例,以保证精子的数量和质量[19],维持精子发生与凋亡的动态平衡,保证遗传稳定性。但是,如果生精细胞的凋亡程序发生紊乱,则可能造成雄性不育。Caspase-9 是与线粒体凋亡途径直接相关的功能蛋白,目前认为Caspase-9 是启动酶[20],无机砷通过ROS 积累的间接作用或巯基氧化性的直接作用,诱导线粒体的基质浓缩和渗透通道开放,从而诱发线粒体损伤并引发凋亡,使生精细胞凋亡增加,影响精子的发育,产生生殖毒性。该研究结果显示,Caspase-9 阳性细胞表达在睾丸间质细胞的细胞质,随着染砷剂量的增加,Caspase-9 蛋白的表达量增加。砷对睾丸生殖毒性可能的机制是其直接通过对线粒体的损伤,激活Caspase-9 蛋白,引起Caspase 的级联反应,使间质细胞凋亡增加。
4 结论
睾丸间质细胞Caspase-9 蛋白表达水平升高可能是亚砷酸钠致雄性大鼠慢性生殖毒性的机制之一。

