白桦脂酸调节AMPK/mTOR/ULK1信号通路对冠心病大鼠血管平滑肌细胞自噬和凋亡的影响
毛治尉,王东伟,武永新,张 涛
0 引言
冠心病是目前世界范围内常见的心脏病之一,是我国心脏病病例中住院率和死亡率最高的疾病类型[1]。冠心病主要是由于冠状动脉粥样硬化导致冠脉痉挛和冠脉管腔狭窄改变,使冠状动脉供血相对不足,最终导致心肌细胞出现缺氧、缺血[2]。血管平滑肌细胞是构成血管壁的主要细胞,血管内皮炎症贯穿了冠状动脉粥样硬化的始终,能引起血管平滑肌细胞异常增殖、凋亡、血管内皮损伤等[3]。因此,研究如何调节血管平滑肌细胞的功能,对治疗冠心病具有重要意义。白桦脂酸是大量存在于桦木属植物,如白桦树皮中的一种五环三萜类化合物。药理学研究发现,白桦脂酸具有抗炎、抗肿瘤、抗HIV、抗溃疡等生物活性[4-5]。但关于白桦脂酸在冠心病等心血管疾病中的作用和影响还鲜有报道。自噬是一种进化保守的分解代谢途径,又被称为Ⅱ型程序性细胞死亡[6]。研究发现,激活腺苷酸活化蛋白激酶(Adenosine monophosphate-activated protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)/Unc-51样自噬激活激酶1(Unc-51-like kinase 1,ULK1)信号通路可以促进细胞自噬[7]。因此,白桦脂酸能否通过调控该信号通路影响冠心病患者血管平滑肌细胞的生物学过程是值得探究的。本研究将以大鼠血管平滑肌细胞为研究对象,探究白桦脂酸对冠心病大鼠血管平滑肌细胞自噬和凋亡的影响和具体分子机制。
1 材料与方法
1.1 实验动物 24只SPF级SD大鼠,雄性,7~10周龄,体重190~220 g,购自上海斯莱克实验动物有限公司,许可证号:SYXK(沪)2022-0012。所有大鼠实验前在温度22~24 ℃、相对湿度40%~55%、12 h光照环境下饲养7 d。本实验经郑州市中心医院动物伦理委员会批准(伦理号:20220018)。
1.2 主要试剂与仪器 白桦脂酸购自中国科学院成都生物研究所;垂体后叶素购自南京新贝药业有限公司;DMEM高糖培养基、胎牛血清购自美国Gibco公司;PBS、胰蛋白酶购自美国Cell Signaling Technology公司;CCK-8试剂盒购自日本同仁化学研究所;RIPA裂解液、BCA蛋白定量检测试剂盒购自上海碧云天生物技术有限公司;Trizol试剂、反转录试剂盒购自北京索莱宝科技有限公司;α-平滑肌肌动蛋白(α-SM-actin)单克隆抗体购自武汉博士德生物工程有限公司;FITC标记的IgG二抗购自北京中杉金桥公司;AMPK、mTOR、ULK1、LC3、Bax、Bcl-2、Beclin-1、GAPDH一抗和相应二抗购自Abcam公司。Western印迹电泳仪购自美国Bio-Rad公司。
1.3 实验方法
1.3.1 大鼠冠心病模型的建立 参考文献方法,构建大鼠冠心病模型[8]。将24只SD大鼠随机分为对照组和模型组,每组12只。对照组大鼠采用普通饲料正常饲养,模型组大鼠每日使用高脂饲料进行喂养(含10%猪油、87.3%基础饲料、2%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶)。连续喂养6周,间隔2周大鼠腹腔注射垂体后叶素(30 μg/kg),1次/d,连续注射3 d,对照组大鼠注射等量的生理盐水。末次注射后30 min进行心电图检查,出现T波高耸、ST段抬高超过0.1 mV、心律不齐,说明造模成功[9]。
1.3.2 血管平滑肌细胞的分离、培养与鉴定 造模成功后处死所有大鼠,解剖,分别取两组SD大鼠的胸主动脉血管平滑肌,按组织贴块法进行培养。于含10%胎牛血清的DMEM高糖培养基,37 ℃、5% CO2无菌培养箱中培养。使用0.1%胰蛋白酶和0.02% EDTA消化传代细胞。细胞传代3次后用于后续实验。在显微镜下观察细胞,细胞应呈梭形或长梭形,可以重叠生长,高低起伏,呈“峰与谷”样生长状态。用α-SM-actin单抗通过免疫荧光染色法鉴定血管平滑肌细胞的特异性肌动蛋白。具体操作:用4%多聚甲醛固定细胞后,加入山羊血清孵育,加入一抗α-SM-actin单抗(1∶100)、FITC标记的IgG二抗(1∶100)、加入DAPI工作液,最后加入抗荧光猝灭剂,在激光共聚焦显微镜下观察和拍照。
1.3.3 细胞分组与处理 细胞经鉴定为血管平滑肌细胞后,取对数生长期血管平滑肌细胞,以1×104个/孔的密度接种于96孔板中,待细胞贴壁后,将从对照组大鼠中分离培养的血管平滑肌细胞记为正常组(Control组),将从模型组大鼠中分离培养的血管平滑肌细胞随机分为模型组(Model组)、低浓度(20 μmol/L)白桦脂酸组(BA-L组)、高浓度(40 μmol/L)白桦脂酸组(BA-H组)[10]和高浓度(40 μmol/L)白桦脂酸+AMPK抑制剂(10 μmol/L)Compound C组(BA-H+CC组)[11]。继续培养24 h后加入相应药物进行处理。
1.3.4 CCK-8法检测细胞活力 取对数生长期血管平滑肌细胞,以1×104个/孔的密度,将细胞接种于96孔板中,继续培养24 h后,对各组细胞进行分组,并加入相应药物进行处理,每组设置6个复孔。实验共设置3个检测时间点:24 h、48 h和72 h。加入相应药物处理24、48、72 h后,每孔加入10 μl的CCK-8试剂,继续培养2 h。使用酶标仪检测450 nm波长下每孔的光密度(OD)值,OD值在一定程度上反映了细胞活力。
1.3.5 细胞流式术检测细胞凋亡 取处理过的各组细胞加入胰酶消化,离心弃去上清液收集细胞。调整细胞悬液的密度为1×106个/ml,加入PBS洗涤2次,加入400 μl Binding Buffer重悬,加入5 μl Annexin V-FITC和10 μl PI试剂,混匀后室温避光孵育15 min,用流式细胞仪检测细胞凋亡。
1.3.6 双荧光体系观察血管平滑肌细胞自噬小体 取对数生长期的血管平滑肌细胞,以1×105个/ml的密度接种在6孔板中,当细胞汇合至80%后,将mRFP-eGFP-LC3质粒转染至细胞中,继续培养6 h后,更换为完全培养基继续培养24 h[12]。将细胞按“1.3.3”中进行分组和处理后,继续培养6 h。弃去培养基,加入4%多聚甲醛固定细胞10 min,加入DAPI染色剂对细胞核进行染色。在荧光显微镜下观察细胞内绿色和红色LC3的亮点(自噬体)的数量。
1.3.7 RT-qPCR实验检测大鼠血管平滑肌细胞中AMPK、mTOR、ULK1 mRNA的表达 取对数生长期的血管平滑肌细胞进行相应分组与处理。加入Trizol试剂提取细胞RNA。将提取的RNA按逆转录试剂盒说明书操作,反转录为cDNA,并以此为模板,进行PCR扩增。反应体系为20 μl,反应条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火40 s,一共循环40次。使用2-ΔΔCt方法计算各组细胞AMPK、mTOR、ULK1 mRNA的表达量。引物序列设计如表1所示。

表1 RT-qPCR引物序列
1.3.8 Western blot检测大鼠血管平滑肌细胞中AMPK/mTOR/ULK1信号通路和自噬相关蛋白表达 取对数生长期的血管平滑肌细胞进行相应分组与处理。加入RIPA裂解液提取血管平滑肌细胞总蛋白,使用BCA试剂盒测定蛋白质浓度。蛋白质样品进行SDS-PAGE凝胶电泳,随后被转移到PVDF膜上。在室温下将膜在脱脂奶粉中封闭2 h,随后在4 ℃下与一抗AMPK(1∶1 000)、mTOR(1∶1 000)、ULK1(1∶1 000)、LC3(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、Beclin-1(1∶1 000)、GAPDH(1∶1 000)孵育过夜。次日,室温下将膜与相应二抗(1∶5 000)孵育2 h,再用TBST洗涤膜3次,加入ECL显色剂进行显色。以GAPDH为内参,使用凝胶图像处理系统分析目标蛋白的灰度值。
2 结果
2.1 血管平滑肌细胞的鉴定 当培养至第4~6天时,光镜下观察到细胞大部分呈长梭形,小部分呈多角形或不规则形;当培养至第10~14天时,细胞呈典型的“峰-谷”样结构(图1)。血管平滑肌细胞经免疫荧光染色后,激光共聚焦显微镜观察到标志性分子α-SM-actin在细胞质中沿纵轴呈丝状排列。α-SM-actin在细胞质发出绿色荧光,细胞核被染为蓝色,表明所培养的细胞为血管平滑肌细胞(图2)。
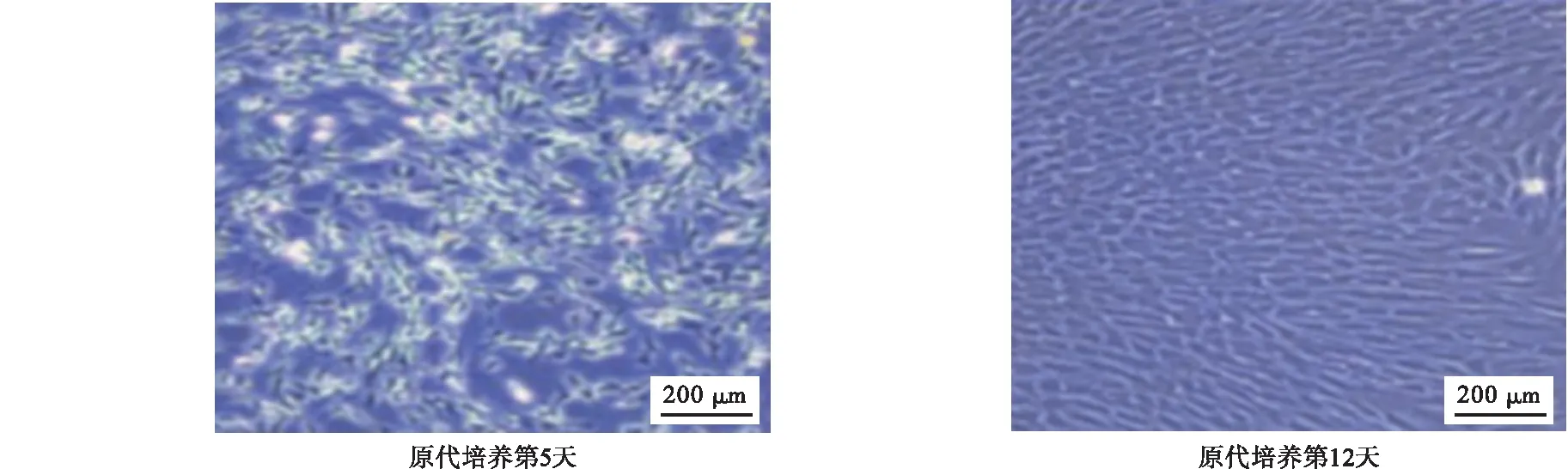
图1 原代培养血管平滑肌细胞形态(100×)

图2 免疫荧光检测α-SM-actin在血管平滑肌细胞中的表达(400×)
2.2 白桦脂酸对各组血管平滑肌细胞细胞活力的影响 与Control组相比,Model组细胞活力(48 h、72 h)显著升高(P<0.05);与Model组相比,BA-H组细胞活力(48 h、72 h)显著降低(P<0.05),BA-L组差异无统计学意义(P>0.05);与BA-L组相比,BA-H组细胞活力(48 h、72 h)显著降低(P<0.05);与BA-H组相比,BA-H+CC组细胞活力(48 h、72 h)显著升高(P<0.05)(图3)。
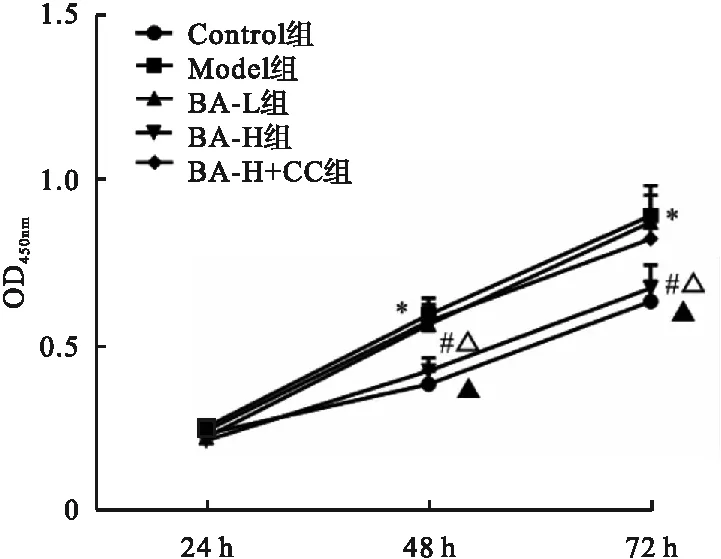
图3 各组血管平滑肌细胞细胞活力的比较
2.3 白桦脂酸对各组血管平滑肌细胞细胞凋亡率的影响 与Control组细胞凋亡率(12.58%±0.93%)相比,Model组细胞凋亡率(2.24%±0.16%)显著降低(P<0.05);与Model组相比,BA-H组细胞凋亡率(10.86%±0.89%)显著增加(P<0.05),BA-L组(2.36%±0.20%)差异无统计学意义(P>0.05);与BA-L组相比,BA-H组细胞凋亡率显著增加(P<0.05);与BA-H组相比,BA-H+CC组细胞凋亡率(2.87%±0.33%)显著降低(P<0.05)(图4)。

图4 流式术检测血管平滑肌细胞凋亡
2.4 白桦脂酸对各组血管平滑肌细胞自噬的影响 使用双荧光体系观察血管平滑肌细胞中绿色和红色LC-3Ⅱ颗粒(自噬体),结果显示,Control组、Model组血管平滑肌细胞中无明显的自噬小体出现。BA-H组血管平滑肌细胞中出现了明显的自噬小体。BA-L组血管平滑肌细胞中的自噬小体较少。与BA-H组相比,BA-H+CC组血管平滑肌细胞中的自噬小体减少(图5)。

图5 双荧光体系观察血管平滑肌细胞中的自噬小体
2.5 白桦脂酸对血管平滑肌细胞中AMPK、mTOR、ULK1 mRNA表达的影响 与Control组相比,Model组细胞中AMPK、ULK1 mRNA表达显著降低(P<0.05),mTOR mRNA表达显著升高(P<0.05);与Model组相比,BA-H组细胞中AMPK、ULK1 mRNA表达显著升高(P<0.05),mTOR mRNA表达显著降低(P<0.05),BA-L组差异无统计学意义(P>0.05);与BA-L组相比,BA-H组细胞中AMPK、ULK1 mRNA表达显著升高(P<0.05),mTOR mRNA表达显著降低(P<0.05);与BA-H组相比,BA-H+CC组细胞中AMPK、ULK1 mRNA表达显著降低(P<0.05),mTOR mRNA表达显著升高(P<0.05)(表2)。

表2 各组血管平滑肌细胞中AMPK、mTOR、ULK1 mRNA表达比较(n=6)
2.6 白桦脂酸对血管平滑肌细胞中AMPK/mTOR/ULK1信号通路和自噬相关蛋白表达的影响 与Control组相比,Model组血管平滑肌细胞中AMPK、ULK1、Bax、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达显著降低(P<0.05),mTOR、Bcl-2蛋白表达显著升高(P<0.05);与Model组相比,BA-H组血管平滑肌细胞中AMPK、ULK1、Bax、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达显著升高(P<0.05),mTOR、Bcl-2蛋白表达显著降低(P<0.05),BA-L组差异无统计学意义(P>0.05);与BA-L组相比,BA-H组血管平滑肌细胞中AMPK、ULK1、Bax、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达显著升高(P<0.05),mTOR、Bcl-2蛋白表达显著降低(P<0.05);与BA-H组相比,BA-H+CC组血管平滑肌细胞中AMPK、ULK1、Bax、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达显著降低(P<0.05),mTOR、Bcl-2蛋白表达显著升高(P<0.05),见表3及图6。

图6 Western blot检测血管平滑肌细胞中AMPK/mTOR/ULK1信号通路和自噬相关蛋白表达

表3 各组血管平滑肌细胞中AMPK/mTOR/ULK1信号通路和自噬相关蛋白表达的比较(n=6)
3 讨论
冠心病多发病于40岁以上的人群,是临床常见的心血管疾病之一,且致死率在心血管疾病中最高,严重威胁着人类的生命健康[13]。目前,临床治疗冠心病主要依靠腔内介入和旁路血管移植术,这两种治疗手段在提高患者近期疗效中效果较好,但长期预后较差,容易受到冠脉再狭窄的制约[14]。因此,寻找治疗冠心病安全有效的药物,在提高疗效的同时提高患者预后是亟待解决的重要课题之一。研究显示,血管平滑肌细胞是构成冠状动脉血管壁的肌层部分,在冠心病的病理状态下,平滑肌细胞异常增殖,合成并分泌胶原纤维蛋白,进一步促进管腔狭窄和管壁硬化[15]。血管平滑肌细胞主要有2种表型:收缩型和分泌型。正常生理状态下,血管平滑肌细胞为收缩型,能够维持血管的张力;在病理状态下血管平滑肌细胞转化为分泌型,具有强大的增殖能力和迁移活性[16]。因此,深入研究血管平滑肌细胞的生物学功能对治疗冠心病具有重要作用。细胞自噬是一种溶酶体的降解途径,对细胞生存、分化和机体发育、稳态具有重要作用[17]。研究发现,自噬在感染、神经退行性疾病、心血管疾病、癌症等疾病中起到保护作用,当自噬水平减弱,可能会导致阿尔茨海默病、心血管疾病的发生[18]。Beclin1、LC3是自噬发生过程中的重要蛋白,其蛋白表达量可以作为自噬发生的标志。本研究采用高脂饮食构建冠心病大鼠模型,从冠心病大鼠的胸主动脉血管平滑肌中分离培养原代血管平滑肌细胞,经鉴定所培养的细胞为血管平滑肌细胞。结果显示,与Control组相比,Model组血管平滑肌细胞的细胞活力(48 h、72 h)、Bcl-2蛋白表达显著上升,细胞凋亡率、Bax、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达显著下降,表明模型建立成功。
白桦脂酸是一种天然的五环羽扇烷结构的三萜化合物,主要从桦木科的树皮中提取而来[19]。相关研究表明,白桦脂酸能够增强细胞自噬而发挥治疗相关疾病的作用,如白桦脂酸能通过AMPK-mTOR-TFEB信号通路增强自噬,抑制脊髓细胞焦亡,促进脊髓损伤的恢复[20]。Zhang等[21]研究表明,白桦脂酸通过Bmi-1/ROS/AMPK-mTOR-ULK1信号通路诱导人膀胱癌细胞自噬依赖性凋亡。本研究结果显示,与Model组相比,BA-H组血管平滑肌细胞的细胞活力(48 h、72 h)、Bcl-2蛋白表达显著下降,细胞凋亡率、Bax、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白表达显著上升,表明白桦脂酸能促进冠心病大鼠血管平滑肌细胞的自噬和凋亡。
AMPK/mTOR/ULK1信号通路是调控细胞自噬的重要信号通路[22]。当细胞受到饥饿、缺氧、氧化应激等刺激后,AMPK通过磷酸化被激活,并降低mTOR的磷酸化水平,增加Ser317位点磷酸化ULK1的表达,最终激活自噬[23-24]。Lin等[25]研究发现,双酚A通过诱导AMPK/mTOR/ULK1信号通路,促进卵巢颗粒细胞的自噬,导致卵巢功能异常。Gui等[26]研究发现,红景天苷通过AMPK/mTOR/ULK1信号通路上调细胞自噬,减轻缺氧诱导的肺动脉平滑肌细胞的异常增殖。本研究结果显示,与Control组相比,Model组细胞AMPK、ULK1 mRNA和蛋白表达显著降低,mTOR mRNA和蛋白表达显著升高。与Model组相比,BA-H组细胞AMPK、ULK1 mRNA和蛋白表达显著升高,mTOR mRNA和蛋白表达显著降低。结果表明,白桦脂酸可能通过激活AMPK/mTOR/ULK1信号通路,促进冠心病大鼠血管平滑肌细胞的自噬和凋亡。为了验证此猜想,我们用AMPK抑制剂Compound C来干预高浓度的白桦脂酸组,结果表明,Compound C减弱了白桦脂酸对血管平滑肌细胞自噬和凋亡的促进作用。
综上所述,白桦脂酸可能通过激活AMPK/mTOR/ULK1信号通路,促进冠心病大鼠血管平滑肌细胞的自噬和凋亡。本研究的不足之处是仅在细胞水平进行了初步探究,后续还需深入到体内实验中进行验证。

