CYP1介导的雌二醇生物活化对女性乳腺癌发展影响的研究进展
毛煦
(牡丹江医学院药学院,黑龙江牡丹江 157011)
雌二醇(estradiol,E2)是一种类固醇激素,对女性生理活动具有重要作用[1],不仅具有多种药理活性,如预防骨质疏松[2]、保护神经[3]和舒张血管[4]等,还可作为激素替代疗法的常用药物用于缓解绝经后女性更年期症状[5],但长期或过度服用会增加患乳腺癌的风险[5]。
细胞色素P450(cytochrome P450,CYP)酶是人体内最重要的Ⅰ相代谢酶,参与多种内源性和外源性化合物的氧化代谢过程[6],包括CYP 酶超家族1(CYP enzyme superfamily 1,CYP1),CYP2 和CYP3 等[7]。CYP1 家族是催化E2代谢的主要CYP酶[8],在人体内由CYP1A和CYP1B亚家族组成,包括CYP1A1,CYP1A2 和CYP1B1 亚型[9]。研究发现,CYP1 具有不同组织分布特征和底物选择性。CYP1A2 主要在肝中表达[10],CYP1A1 和CYP1B1主要在参与类固醇激素合成的肝外组织中表达,如乳腺、子宫和卵巢等[11]。CYP1B1 则在与E2相关癌症(如乳腺癌)的肿瘤组织或细胞中过表达[12]。3个CYP1 亚型可催化E2C-2 和C-4 位点的氧化代谢,生成2 个不同的羟基化代谢物——2-羟基E2(2-hy⁃droxyestradiol,2-OHE2)和4-OHE2,分别对应于E2的解毒和致毒代谢路径[8],表明CYP1 介导的E2生物活化可能在女性乳腺癌发展过程中起关键作用。
截至2022 年,乳腺癌已成为全球女性最常见的恶性肿瘤,也是其癌症致死的主要原因[13]。目前,各国乳腺癌患者仍在持续增加,严重威胁女性健康。E2作为乳腺癌的潜在诱发剂,有必要全面了解其生物活化对癌症发展的影响。本综述系统介绍CYP1 介导的E2生物活化及其与女性乳腺癌发展的关系。
1 雌激素与女性乳腺癌的相关性
几十年来激素替代疗法一直是保证绝经后女性身体健康的标准治疗选择,但早在20 世纪70 年代就有大量流行病学数据显示,使用雌激素〔雌酮(estrone,E1)或E2〕会增加女性患乳腺癌风险,体循环中雌激素及其4-羟基化代谢物增多可能是乳腺癌发展的主要诱因,而2-羟基化代谢物增多则有助于缓解乳腺癌发展[5,14]。
2002 年,Key 等[15]收集来自1765 名健康女性和663 名女性乳腺癌患者的血清,分析其体内雌激素含量,发现内源性雌激素水平与绝经后女性罹患乳腺癌的风险密切相关。血清雌激素浓度相对较高的女性患乳腺癌的风险约比血清雌激素浓度相对较低的女性高1 倍。Bakken 等[16]对31 451 名来自挪威且正在接受激素替代疗法的绝经后女性进行统计学分析发现,雌激素治疗可导致乳腺癌发病率增加,且随使用时间的延长,致癌风险也随之升高。另一项针对52 705 名健康女性与108 411 名女性乳腺癌患者的研究显示,在雌激素治疗>5 年后,罹患乳腺癌的风险每年增加35%[17]。Moore 等[18]检测来自399 名绝经后健康女性和女性乳腺癌患者尿液中雌激素及其羟基化代谢物的浓度,发现健康女性尿液中E2水平较女性乳腺癌患者更低,同时2-羟基化代谢物水平更高。Zahid 等[19]研究发现,雌激素氧化后生成的亲电性代谢物会进一步与体内DNA发生共价结合,而女性乳腺癌患者由于雌激素代谢异常,产生的4-羟基化代谢物-DNA 加合物明显高于健康女性,这可能会导致DNA 损伤,是诱发乳腺癌主要原因之一。
综合以上研究结果,雌激素代谢失衡会严重影响女性乳腺癌的发展,致癌风险的增加与体内雌激素的暴露量与暴露时间、基因毒性代谢物的累积及其导致的DNA损伤程度具有直接关系。
2 CYP1介导的雌二醇生物活化
E2是女性体内最重要的天然雌激素,有多种代谢酶参与E2的生物活化过程。CYP1 主要催化E2的氧化代谢,不可逆的氧化羟基化是第一步生化反应,芳香环的C-2和C-4位是主要的羟基化位点[20]。在CYP1家族的3个酶亚型中,CYP1A1和CYP1A2主要催化雌二醇的2-羟基化反应,生成2-OHE2,而CYP1B1 则选择性催化E2的4-羟基化反应,生成4-OHE2[8]。
4-OHE2是一种活性雌激素,除少量经Ⅱ相代谢酶——邻苯二酚-O-甲基转移酶(catechol-O-meth⁃yltransferase,COMT)甲基化形成4-甲氧基E2之外,大部分4-OHE2更易被进一步氧化成亲电性代谢物——3,4-醌式E2(E2-3,4-quinone,E2-3,4-Q)。该亲电性代谢物不稳定,迅速与体内生物大分子DNA 的腺嘌呤或鸟嘌呤部分发生化学共价结合,生成DNA加合物,从而引发基因毒性并诱导女性乳腺癌发展[21]。E2-3,4-Q 还可经CYP 还原酶催化代谢为3,4-半醌式E2(E2-3,4-semiquinone,E2-3,4-SQ),形成一个完整的氧化还原闭环。在此过程中,还会有活性氧(reactive oxygen species,ROS)产生,过量ROS 可进一步氧化DNA,造成DNA 损伤[22]。ROS 作为癌症的促发剂,也能导致DNA 突变并加速肿瘤发展[23]。与4-OHE2不同,2-OHE2是一种活性相对较低的雌激素,更易通过COMT 催化生成无毒的2-甲氧基E2(2-methoxyestradiol,2-CH3O-E2),最终随尿液排出体外[21](图1)。
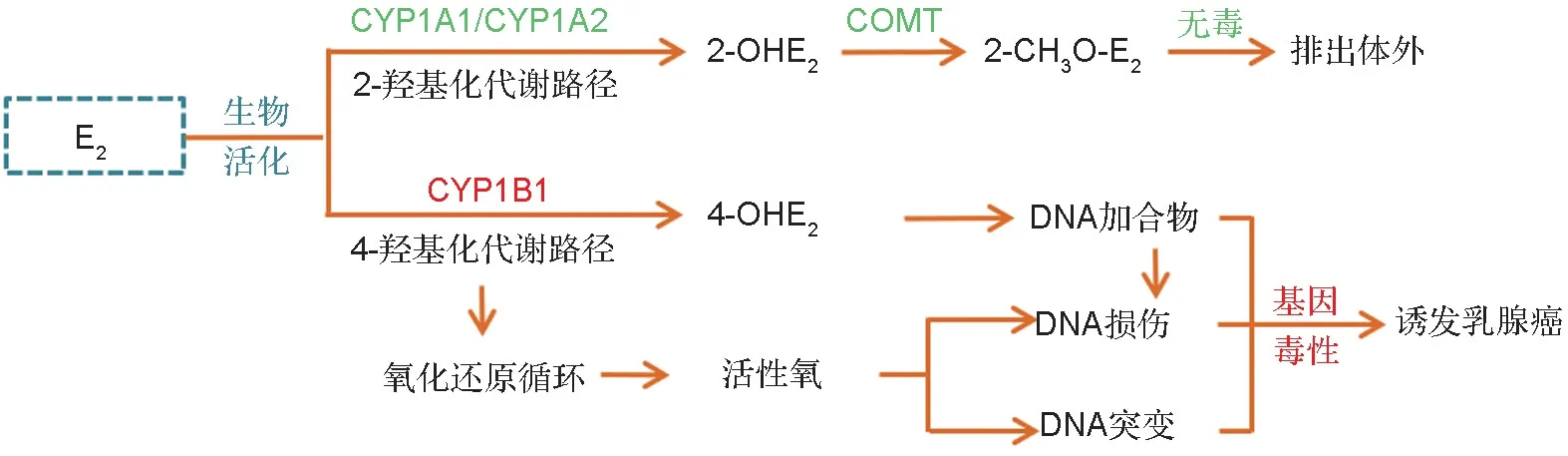
图1 细胞色素P450酶(CYP)1超家族(CYP1)介导的雌二醇(E2)生物活化.COMT:邻苯二酚-O-甲基转移酶.
在女性乳腺癌组织中已检测到高浓度的4-羟基化代谢物及其DNA 加合物,4-OHE2与2-OHE2的生成比率显著高于正常乳腺组织[24],二者可分别作为E2基因毒性和解毒的生物标志物。在正常生理条件下,4-OHE2引发的基因毒性可通过各种细胞防御机制加以预防,形成的醌式代谢物能被体内一些亲核性巯基化合物(如广泛存在的谷胱甘肽)灭活,胞内形成的羟基化代谢物也能被COMT 迅速甲基化[25]。然而,激素替代疗法可能会增加E2的体内暴露量、某些外源性化合物可能会改变E2的生物活化、基因多态性可能会影响E2代谢酶的活性与功能,这些因素都可能增加女性患乳腺癌的风险[25]。
3 外源性CYP1 抑制剂和诱导剂对雌二醇生物活化的影响
尽管CYP1 参与E2正常氧化代谢,但C-4 位酶促反应生成的亲电性代谢物仍会导致基因毒性与突变性的发生。相较于CYP1A2,CYP1A1 和CYP1B1 主要存在于乳腺组织,其介导的E2生物活化改变对女性乳腺癌发展的影响至关重要。
外源性化合物对CYP1的抑制作用可导致酶活性下降,如选择性抑制CYP1A1,即能减少无毒2-OHE2生成,相对增加4-OHE2的累积,如两面针碱[26];如选择性抑制CYP1B1,即能减少前致癌物E2向其基因毒性标志物4-OHE2的生物转化,如小檗碱[27-29]。与酶抑制相反,长期暴露于外源性化合物也可诱导CYP1表达,此时如增加了酶活性,同样可改变E2的生物活化。据诱导的CYP1 亚型不同,即能促进E2的不同代谢路径,如千层纸素A 可显著诱导CYP1A1 而升高2-OHE2水平[30]。研究发现,CYP1A1 和CYP1B1 的抑制剂和诱导剂多为平面疏水化合物,具有相似的母核结构和取代基[9],主要包括二苯乙烯类化合物、黄酮类化合物、蒽醌类化合物、生物碱类化合物、香豆素类化合物及其合成衍生物[31-32],均可能改变CYP1介导的E2生物活化,从而影响E2在体内的致癌风险。尤其CYP1B1 作为诱导乳腺癌的酶靶点受到广泛关注,寻找并开发强效CYP1B1 选择性抑制剂有望成为防治女性乳腺癌的潜在药物[32]。目前,以黄酮为母核进行结构修饰已设计出一系列合成衍生物,包括萘黄酮衍生物[33-35]、查尔酮衍生物[36-37]和喹唑酮衍生物[38-39]等,均为强效CYP1B1 选择性抑制剂,但其对E2生物活化和致癌性的影响有待进一步研究。同时,CYP1A1 和CYP1B1 还存在基因多态性,已发现二者具有多种变异体,如CYP1A1*2A 和CYP1A1*2C及CYP1B1*2 和CYP1B1*26 均可导致乳腺癌风险的增加[7]。可见,CYP1 复杂的基因多态性以及广谱的抑制剂和诱导剂均可能打破E2在“解毒”与“致毒”之间的代谢平衡。
4 结语
CYP1介导的E2生物活化与女性乳腺癌发展密切相关,抑制或诱导CYP1 活性均能影响其致癌风险。全面掌握多种因素对CYP1 介导E2生物活化的改变,并综合评价其与基因毒性相关性,将有助于预防或规避E2的致癌风险,有效促进新型抗乳腺癌药物的开发和临床研究,对女性健康具有重要理论和现实意义。

