苯并芘通过芳香烃受体促进肝糖异生相关分子表达
王朝杰,张梦迪,2,白图雅,2,胡玉霞,2,3,李君,2,3,王蕾,苏敏,杨帆,4,常福厚,2
(内蒙古医科大学1.药学院,3.新药安全评价研究中心,内蒙古呼和浩特 010110;2.内蒙古自治区新药筛选工程研究中心,内蒙古呼和浩特 010110;4.内蒙古科技大学包头医学院第一附属医院,内蒙古包头 014010)
糖异生是生物体将多种非糖物质转变成葡萄糖或糖原的过程,对维持空腹状态下血糖正常水平具有重要意义[1]。肝是人体糖脂代谢重要器官,是糖异生或糖原分解产生内源性葡萄糖主要场所,糖异生受一系列转录因子的调控,其中,果糖-1,6-二磷酸酶1(fructose-1,6-bisphosphatase 1,FBP1)、葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6Pase)和磷酸烯醇式丙酮酸羧化酶1(phospho⁃enolpyruvate carboxykinase,PCK1)是糖异生限速酶,是糖异生途径关键环节[2-5]。成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)是成纤维细胞生长因子家族一员,主要在肝中表达,对肝糖代谢具有重要作用。研究表明,FGF21 过表达可促进小鼠肝糖异生,增加肝葡萄糖含量[6]。
肝糖异生异常可导致多种代谢性疾病,与苯并芘(benzo[a]pyrene,BaP)和2,3,7,8-四氯二苯-p-二英(2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)等环境危险因子密切相关。BaP 是存在于香烟烟雾中的一种典型的环境污染物,是芳香烃受体(aryl hydrocarbon receptor,AhR)的配体,TCDD和BaP 均可诱导AhR 下游基因转录,导致毒性作用[7]。研究发现,TCDD 可以促进AhR 与FGF21 启动子直接结合并诱导其表达,说明FGF21 是AhR的直接靶标[8]。Hoyeck 等[9]发现,暴露于TCDD 的小鼠胰岛功能受损,加速了高血糖发生,诱发2型糖尿病(type 2 diabetes,T2D)。此外,实验室前期研究发现,BaP 与AhR 结合可降低小鼠葡萄糖耐量和胰岛素耐量[10]。但BaP 激活AhR 后对肝糖异生影响及其机制尚不明确。本研究主要观察BaP 通过激活AhR 后对小鼠肝和HepG2 细胞中FBP1,G6Pase,PCK1和FGF21表达的影响,探究BaP 对糖代谢的作用机制,为防治由环境污染物诱发的糖尿病及代谢性相关疾病提供新的思路。
1 材料与方法
1.1 主要试剂和仪器
BaP 粉末(Sigma 公司,美国);BCA 蛋白定量分析试剂盒(Thermo Scientific 公司,美国);总RNA 提取试剂盒(DP419)RNA simple Total RNA Kit〔天根生化科技(北京)有限公司,中国〕;反转录试剂盒Rever Tra Ace qPCR RT Kit 和荧光定量检测(SYBR Green)试剂盒QPK-201(Toyobo 公司,日本);AhR 抑制剂CH223191(MCE 公司,中国);一抗:兔抗小鼠FBP1 单克隆抗体、兔抗小鼠PCK1单克隆抗体、兔抗小鼠G6Pase单克隆抗体、兔抗小鼠FGF21 单克隆抗体和辣根过氧化物酶标记的山羊抗兔IgG 抗体(二抗)(Abcam 公司,英国)。DMEM 高糖培养基(Gibco,美国);PBS(碧云天,中国)。
多模式微孔板检测仪(Multiskan Mk3)(Perkin Elmer 公司,美国);冷冻切片机(CM1850)高内涵共聚焦微组织成像系统(PerkinElmer,美国);组织研磨仪(天根生化科技有限公司,中国);BIO-RAD基础电泳仪〔伯乐生命医学产品(上海)有限公司〕;荧光定量PCR 仪(PiKorea196)和台式高性能离心机(Thermo fisher公司,美国)。
1.2 实验动物和细胞
60 只4~6 周龄C57BL/6 雄性小鼠,体重17~23 g(北京维通利华实验动物技术有限公司),动物质量合格证编号:SCXK(京)2020-0006,饲养于内蒙古医科大学新药安全评价中心。饲养环境为SPF 级,温度为(24±1)°C,相对湿度(60±5)%,实验动物符合内蒙古医科大学医学伦理委员会标准,伦理批准号为(YKD202002049)。人肝癌细胞株(HepG2)(北京协和基础医学研究所)。
1.3 动物和细胞分组及处理
①C57BL/6 小鼠普通饲料喂养7 d 后,分为5 组,每组12只,分别为正常对照组、溶剂对照组(ig给予玉米油10 mL·kg-1)、BaP 0.90 和1.80 mg·kg-1组。给药12周后,75%乙醇全身消毒,开胸腔,剪开心包膜,从左心室缓慢匀速推注10 mL生理盐水,直到肝变白,停止推注,取肝。肝组织按照100 mg 组织加入4 ℃预冷组织细胞裂解液800 μL,使用电动匀浆器在4 ℃匀浆,随后4 ℃4000×g离心5 min,取上清。②HepG2 细胞分为细胞对照组、BaP 0.1,1.0 和10.0 μmol·L-1。③HepG2 细胞分为细胞对照组、BaP 1μmol·L-1、CH223191 1 μmol·L-1、BaP 1 μmol·L-1+CH223191 1 μmol·L-1组。取对数生长期的HepG2 细胞,均匀铺于6 孔板内,加含10% FBS 的高糖DMEM 培养基后,放入37 ℃、5% CO2培养箱中培养细胞密度至约60%后,按照分组加入相应浓度药物,以含10% FBS 的高糖DMEM继续培养24 h,进行后续实验,重复实验3次。
1.4 细胞免疫荧光检测HepG2 细胞中FGF21 蛋白水平
取生长状态良好的HepG2细胞,均匀铺于12孔板内,取1.3 ②和③分组的细胞,待细胞汇合度达到约70%开始进行染色步骤。用新鲜配制的30%丙酮+70%甲醇固定液固定细胞10 min。磷酸盐缓冲液(PBS)洗3 遍,每次5 min。2%二抗同源血清封闭60 min,染色前加入1抗(抗FGF21,稀释比为1∶250),4 ℃冰箱孵育,>18 h。PBS 洗3遍,每次5 min。避光加入PBS 配制的二抗(稀释比为1∶1000),室温(20~35 ℃)孵育45 min。避光PBS 洗4 遍,每次5 min。避光加入PBS 配制的0.5 mg·L-1DAPI 染色10 min 后避光用PBS 简单洗3 遍,去除多余的DAPI,洗完后加入少量PBS,用高内涵共聚焦微组织成像系统进行拍照,使用Image J 软件统计细胞荧光强度表示蛋白表达水平。
1.5 实时定量PCR 检测肝组织和HepG2 细胞中肝糖异生相关分子mRNA表达水平
取1.3 ①~③分组处理的组织和细胞,使用Trizol 试剂提取总RNA,检测RNA 纯度及含量,按照逆转录试剂盒说明将RNA 逆转录为cDNA,取适量cDNA 模板进行qPCR。设定qPCR 仪程序为:95 ℃,30 s,95 ℃,5 s,60 ℃,10 s,72 ℃,15 s,40个循环;计算各组基因mRNA 相对表达量(目的基因相对表达量分析方法基于2-△△Ct原理进行)。每个样本平行重复3 次,取平均值进行分析。以β 肌动蛋白作为内参对照,引物序列见表1。

Tab.1 Primer sequences for real-time quantitative PCR
1.6 Western 印迹法检测肝组织和HepG2 细胞中肝糖异生相关分子蛋白表达水平
取1.3 ①~③分组处理的组织和细胞,用PBS将样品洗涤3 次,加入含1 mmol PMSF 的RIPA 裂解液,提取全蛋白。采用BCA 蛋白定量试剂盒测得其蛋白浓度。采用10% SDS-PAGE(150 V,2 h)电泳分离蛋白,湿转法将蛋白条带转移至PVDF 膜上,用5%脱脂牛奶封闭2 h,加入一抗(抗FBP1、G6Pase,PCK1 和FGF21,稀释比均为1∶1000)孵育过夜,冲洗掉一抗,再用二抗(抗β 肌动蛋白,1∶1000)孵育1 h,采用增强化学发光法检测蛋白质,采用Image J 软件统计积分吸光度值。以目的蛋白条带与内参蛋白条带积分吸光度比值表示目的蛋白相对表达水平。
1.7 统计学分析
采用SPSS 20.0 软件进行分析。对于符合正态分布的数据采用±s表示,组间差异采用单因素方差分析法或非参数秩和检验法进行检验,组间比较采用Dunnettt检验,P<0.05为差异具有统计学意义。
2 结果
2.1 BaP对HepG2细胞中FGF21蛋白表达的影响
免疫荧光法检测结果如图1 和图2 所示,与细胞对照组进行比较,BaP 0.1,1.0 和10.0 μmol·L-1处理HepG2 细胞后,FGF21 蛋白荧光强度显著升高(P<0.01)。

Fig.1 Effect of benzo(a)pyrene(BaP)on FGF21 protein expression in HepG2 cells by immunofluorescence assay(×200). HepG2 cells were treated with BaP for 24 h. B was the semi-quantitative result of A. Green fluorescence represents the protein expression of FGF21 and blue fluorescence indicates a DAPI-stained nucleus. FI:fluorense intensity. x±s,n=3. **P<0.01,compared with cell control group.
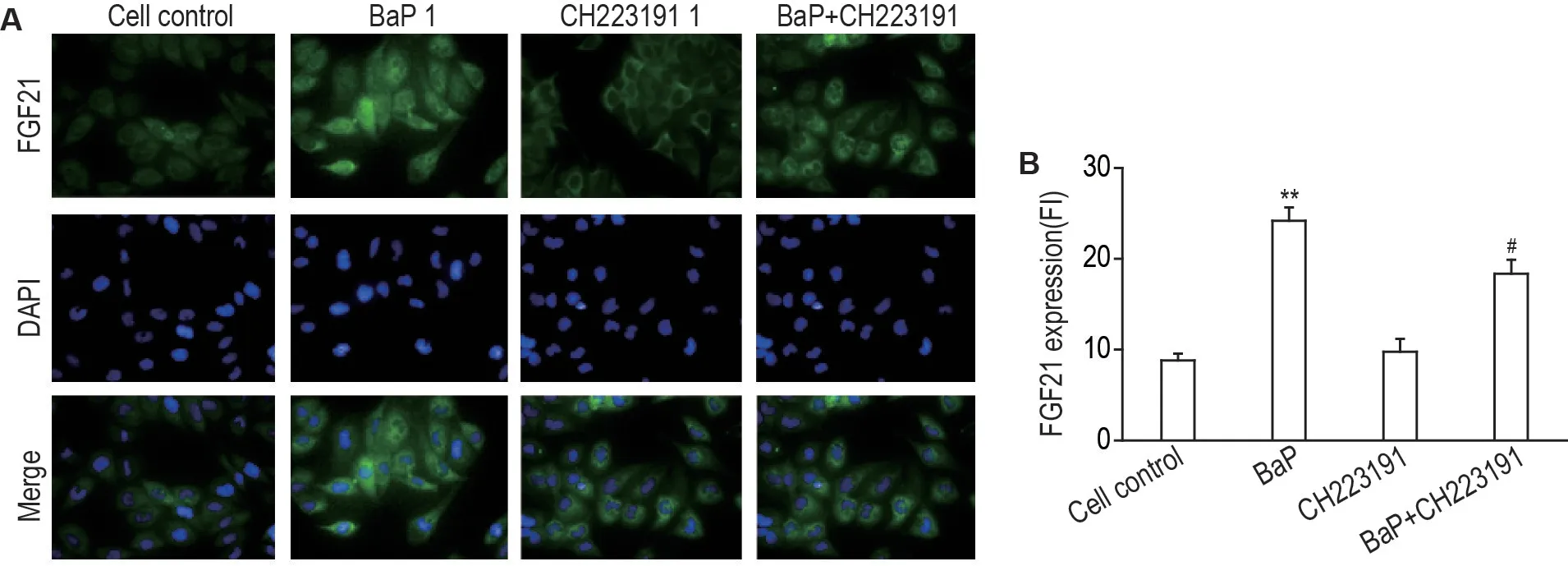
Fig.2 Effect of BaP and CH223191 on FGF21 protein expression in HepG2 cells by immunofluorescence assay(×200). The cells were treated with BaP 1 μmol·L-1 or CH223191 1 μmol·L-1 for 24 h. B was the semi-quantitative result of A. ±s,n=3.**P<0.01,compared with cell control group;#P<0.05,compared with BaP group.
与细胞对照组相比,BaP 组HepG2 细胞中FGF21蛋白荧光强度显著升高(P<0.01);与BaP 1 μmol·L-1组相比,BaP 1 μmol·L-1+CH223191 1 μmol·L-1组HepG2 细胞中FGF21 蛋白荧光强度显著降低(P<0.05)(图2)。表明BaP 通过AhR 促进FGF21蛋白表达。
2.2 BaP 对小鼠肝组织和HepG2 细胞中糖异生相关分子G6Pase,PCK1,FBP1 和FGF21 mRNA 表达的影响
2.2.1 小鼠肝组织
结果如表2 所示,与溶剂对照组相比,BaP 0.9和1.80 mg·kg-1组小鼠肝组织中的G6Pase,PCK1,FBP1和FGF21mRNA表达显著升高(P<0.01),而BaP 0.45 mg·kg-1组小鼠肝组织中的G6Pase,PCK1,FBP1和FGF21mRNA表达无显著变化。

Tab.2 Effect of BaP on mRNA expressions of FBP1,G6Pase,PCK1 and FGF21 in mouse liver tissue by real time quantitative PCR
2.2.2 HepG2细胞
表3结果显示,与细胞对照组相比,BaP 1.0和10.0 μmol·L-1组G6Pase,PCK1,FBP1和FGF21mRNA表达显著上调(P<0.05,P<0.01)。表4结果显示,与细胞对照组相比,BaP 组FBP1,G6Pase,PCK1 和FGF21 mRNA 表达显著升高(P<0.01),CH223191 组无显著变化。与BaP 1.0 μmol ·L-1组相比,BaP 1 μmol·L-1+CH223191 1 μmol·L-1组FBP1,G6Pase,PCK1和FGF21mRNA 表达均显著降低(P<0.05)。

Tab.3 Effect of BaP on mRNA expressions of FBP1,G6Pase,PCK1 and FGF21 in HepG2 cells by real time quantita⁃tive PCR
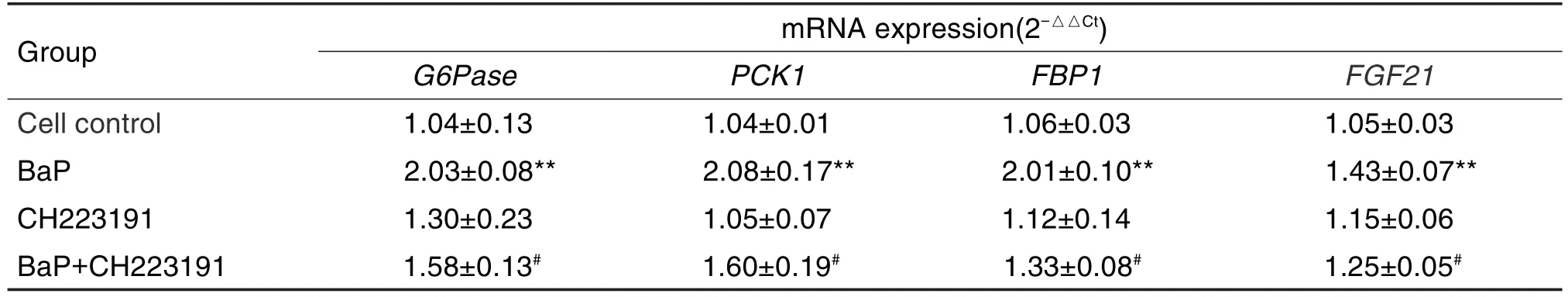
Tab.4 Effect of BaP and CH223191 on mRNA expressions of FBP1,G6Pase,PCK1 and FGF21 in HepG2 cells by real time quantitative PCR
2.3 BaP对小鼠肝组织和HepG2细胞中糖异生相关分子G6Pase,PCK1,FBP1和FGF21蛋白表达的影响
2.3.1 小鼠肝组织
Western 印迹结果如图3 所示,与正常对照组相比,BaP 0.45,0.90 和1.80 mg·kg-1组小鼠肝组织中的G6Pase,PCK1,FBP1 和FGF21 表达水平显著升高(P<0.05,P<0.01)。

Fig.3 Effect of BaP on protein expressions of FBP1,G6Pase,PCK1 and FGF21 in mouse liver tissue by Western blotting.See Tab.2 for the mouse treatment. A2 and B2 were the semi-quantitative result of A1 and B1,respectively. IA:integrated absor⁃bance.±s,n=3.*P<0.05,**P<0.01,compared with vehicle control group.
2.3.2 HepG2细胞
与细胞对照组相比,BaP 1.0 和10.0 μmol·L-1组G6Pase,PCK1,FBP1 和FGF21 蛋白表达水平显著上调(P<0.05,P<0.01)(图4)。

Fig.4 Effect of BaP on protein expressions of FBP1,G6Pase,PCK1 and FGF21 in HepG2 cells by Western blotting.See Fig.2 for the cell treatment. A2 and B2 were the semi-quantitative results of A1,B1,respectively. ±s,n=3. *P<0.05,**P<0.01,com⁃pared with cell control group.
图5 结果显示,与细胞对照组相比,BaP 组HepG2细胞中FBP1,G6Pase,PCK1和FGF21蛋白表达水平显著升高(P<0.01);与BaP 1 μmol·L-1组相比,BaP 1 μmol·L-1+CH223191 1 μmol·L-1组HepG2细胞中FBP1,G6Pase,PCK1和FGF21的蛋白表达均显著降低,差异具有统计学意义(P<0.05)(图5)。

Fig.5 Effect of BaP and CH223191 on protein expressions of FBP1,G6Pase,PCK1 and FGF21 in HepG2 cells by Western blotting. The cells were treated with BaP or CH223191 for 24 h. A2 and B2 was semi-quantitative result of A1,B1,respec⁃tively.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,compared with BaP group.
3 讨论
本研究结果表明,经BaP 处理后不仅能提高肝糖异生相关分子FBP1,G6Pase 和PCK1 表达,而且能显著增加糖脂代谢关键因子FGF21表达,这一过程需要借助AhR来实现。说明,BaP通过AhR促进了肝糖异生关键酶的活性,干扰了肝正常糖异生的稳态,表现为异常上升糖异生水平。FBP1,G6Pase 和PCK1 为糖异生限速酶,蛋白和mRNA的表达量可以评估糖异生水平,其对机体血糖稳态十分重要,常作为T2D 治疗靶点[11-12]。研究发现,抑制高表达FBP1糖异生限速酶的活性,可以降低肝葡萄糖水平,达到治疗T2D 的效果[13-14]。此外,G6Pase和PCK1均与糖尿病密切相关,G6Pase和PCK1 的上调,会导致高血糖和T2D,PCK1 的持续升高则会造成高胰岛素血症[15-18]。表明,糖异生限速酶FBP1,G6Pase 和PCK1 的高表达会诱发糖代谢相关疾病。
BaP 是AhR 经典外源性配体,在无配体存在情况下,AhR 和热休克蛋白90、p23、乙型肝炎病毒X相关蛋白2在胞浆中形成无活性复合物[19]。当BaP和AhR 结合后,AhR 脱离复合物与ARNT 形成二聚体,转移到细胞核内,激活下游相关因子如细胞色素P450 酶家族[20]。研究发现,AhR 在肝中糖原分解、糖异生和脂肪酸氧化中具有重要作用,可通过诱导TiPARP 表达影响肝糖异生[21]。FGF21 是一种新型糖脂代谢调节靶点,对糖代谢相关疾病和肥胖有着积极的作用,但相对与正常人群而言,肥胖及糖尿病患者血液中FGF21水平却显著上升,这一现象得到了广泛的关注。Fisher 等[22]首次发现了FGF21 抵抗现象,证实了肥胖小鼠血液中FGF21含量升高,但降低循环中甘油三酯和改善糖耐量生物效应显著减弱。此外,Jeon 等[23]发现T2D 患者发生FGF21 抵抗现象。本研究结果显示,经BaP处理后FGF21 表达升高,在给与AhR 抑制剂后,FGF21 的表达上升趋势被抑制。Girer等[24]研究发现,AhR可与FGF21启动子中的异源物反应元件结合进而影响FGF21 表达,说明AhR 可直接影响FGF21 表达,本研究结果相似,表明BaP 能通过AhR/FGF21信号通路,提高肝FGF21含量,并可能引发FGF21抵抗,造成糖脂代谢紊乱。
综上所述,BaP 可提高肝糖异生限速酶FBP1,G6Pase,PCK1 和FGF21 表达,进而提高肝糖异生水平,其机制可能与激活AhR/FGF21 信号通路有关,有可能引起FGF21抵抗和相关糖代谢疾病。

