维生素B12 在畜禽生产中应用研究进展
■ 刘雅婷 殷运菊 郑梦莉 陈清华
(湖南农业大学动物科学技术学院,湖南长沙 410128)
维生素B12(也称为钴胺素)由特定的细菌和古细菌在自然界中合成[1],由作为中心原子的钴和包围金属原子的吡咯环组成(见图1)[2]。维生素B12外观呈红色结晶粉末状,具有无味、微溶于乙醇和水、不耐酸碱、不耐高温等特性。维生素B12最常见的活性形式是腺苷钴胺(也称为辅酶B12)和甲钴胺[3],羟钴胺和工业生产的氰钴胺是维生素B12的非活性形式,必须转化为活性形式才能被人体利用[4]。虽然人类肠道菌群中的微生物能够合成维生素B12,但不能被人体吸收,因为合成位置(结肠)离吸收位置(回肠)较远,因此,维生素B12被归类为必需维生素,必须通过膳食获取[5-6]。
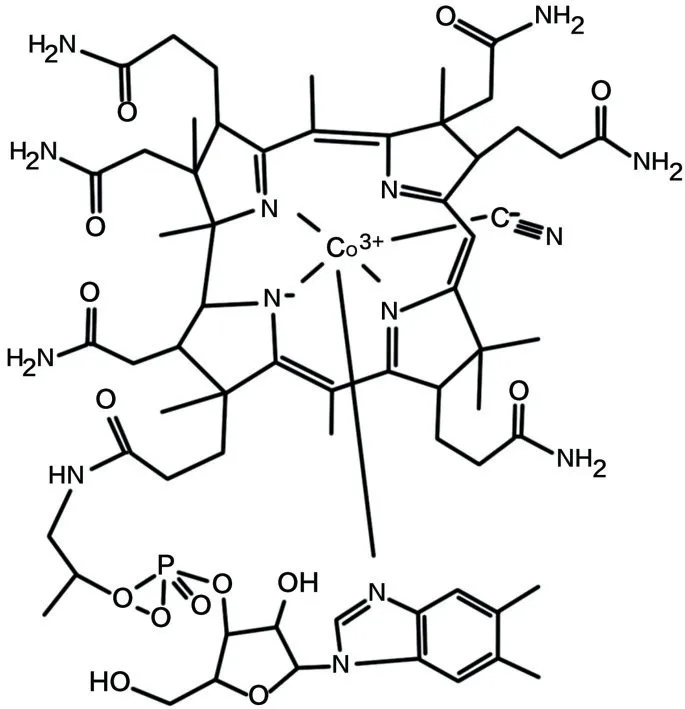
图1 维生素B12化学结构[2]
1 维生素B12的吸收与代谢机制
维生素B12具有独特的吸收和运输途径[7]。维生素B12在胃中盐酸的作用下从蛋白质中解离出来,并与唾液中分泌的触角蛋白(haptocorrin,HC)结合形成复合物,通过胰腺和肠道消化进一步解离,释放的维生素B12与胃壁细胞分泌的内因子(intrinsic factor,IF)结合形成IF-维生素B12复合物,又通过小肠到达回肠末端,回肠末端具有内因子受体并内化于肠上皮细胞中。IF-维生素B12复合物通过复杂的机制转运穿过肠壁,并传递到循环中的转运蛋白(HC 和钴胺传递蛋白(trancobalamin,TC)。维生素B12和转钴胺素Ⅱ(transcobalamin Ⅱ,TCII)的复合物称为全转钴胺素,是循环维生素B12的活性形式,与体内有核细胞上的受体结合,并被输送到肝脏储存(见图2)[8]。

图2 维生素B12的吸收过程
维生素B12与膳食蛋白质有关,在胃腔内暴露于低pH 时释放,释放的维生素B12立即与半抗原结合形成复合物,并保持附着,直到十二指肠中复合物水解裂解。IF 是回肠末端摄取维生素B12在此外所必需的,维生素B12与内因子IF 结合。在穿过刷状缘时,维生素B12从胰岛素样生长因子中分离出来,并进入循环,在循环中与TCII 或HC 结合[9]。TCII 和半抗原分别负责将维生素B12输送到外周组织和肝脏,大量维生素B12被吸收后储存在肝脏中[10],转运到外周组织后产生游离的维生素B12。在胞质溶胶中,维生素B12作为蛋氨酸合酶(methionine synthase,MS)的辅助因子,参与同型半胱氨酸与N5-甲基四氢叶酸(N5-methyltetrahydrofolate,N5-MeTHF)反应产生甲硫氨酸和四氢叶酸(tetrahydrofolate,THF)。产生的THF 返回叶酸池,用于生成亚甲基四氢叶酸,从头合成胸苷,这对于DNA 复制和修复至关重要。因此,叶酸或维生素B12缺乏会导致胸苷合成和DNA 复制中相同的生化扰动。维生素B12还可以腺苷-B12的形式作为甲基丙二酰-CoA 变位酶的辅助因子,将甲基丙二酰-CoA 转化为琥珀酰-CoA,琥珀酰-CoA 是三羧酸循环(tricarboxylic acid cycle,TCA cycle)的主要中间体[7]。
2 维生素B12的生物学功能
2.1 促进甲基转移
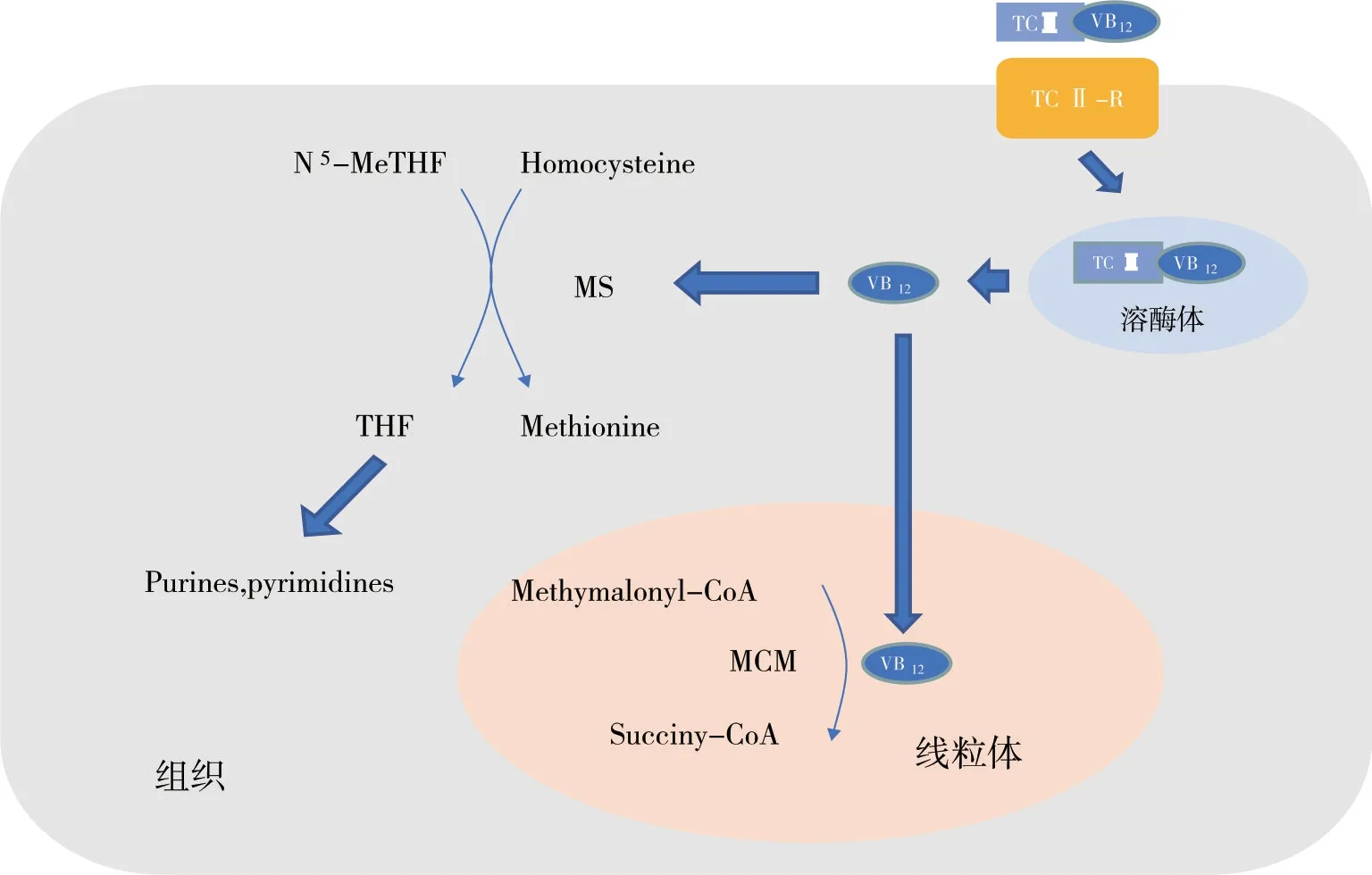
图3 维生素B12的代谢过程
维生素B12是胞浆蛋氨酸合酶(MS)和线粒体甲基丙二酰辅酶A 变位酶(MCM)发挥功能所必需的[11]。甲基转移酶是利用钴胺辅因子或其类似物钴胺作为催化甲基转移的中间体,在厌氧单细胞生物中起着重要的能量生成作用[12]。在生物中,甲基转移酶参与同型半胱氨酸向蛋氨酸的转化[13]。大多数使用钴胺辅因子的酶实际上催化甲基转移反应,并使用甲基钴胺或其结构同系物甲基钴胺作为甲基转移的中间体。生物体第三结构域古菌的发现和许多单细胞生物体的基因组测序结果显示,甲基钴胺在许多厌氧生物体的能量产生中起着重要作用[14]。相比之下,在人类和其他哺乳动物中,只有一种依赖钴胺的甲基转移酶,即MS。在真菌或高等植物中没有发现钴胺,但许多藻类通过与细菌的共生关系获得钴胺,并将其作为蛋氨酸合成酶的辅助因子[15]。维生素B12也是生产S-腺苷甲硫氨酸(SAM)的组成部分,SAM 是一种对表观遗传调控至关重要的甲基供体。研究表明,与摄入较少富含维生素B12食物的个体相比,富含维生素B12饮食的个体存在几个分类差异甲基化区域[16]。
2.2 预防恶性贫血,促进核酸的生物合成和营养物质代谢
维生素B12由原核生物合成,可抑制动物恶性贫血[5]。恶性贫血是一种基因驱动的自身免疫性疾病[8]。缺乏内在因素会妨碍肠道对维生素B12的吸收,并导致严重的维生素B12缺乏。维生素B12缺乏主要表现为巨幼红细胞性贫血、亚急性脊髓和周围神经联合变性、痴呆等,还可能表现为其他器官的自身免疫性损害,包括甲状腺功能减退、1 型糖尿病、白癜风等[17]。
维生素B12在人类机体生命活动中起着至关重要的作用,在细胞成熟和保存所必需的反应途径中起着辅助因子的作用[18]。在胞液中,维生素B12是MS 的辅助因子,通过同型半胱氨酸的再甲基化和生成SAM积极参与蛋氨酸的生物合成,后者是甲基化几个生化过程的甲基供体。目前,调节脂质代谢和胰岛素抵抗的表观遗传机制的已知标记是DNA 甲基化、微RNA、染色质重塑以及组蛋白修饰[19-20]。维生素B12作为SAM 的辅酶调节这些表观遗传机制以及参与脂肪从头生成过程的转录和翻译后因子。在线粒体的丙酸代谢途径中,维生素B12作为辅助因子催化甲基丙二酰辅酶A 转化为琥珀酰辅酶A[21]。琥珀酰辅酶A 在TCA cycle 中被用作ATP 合成的底物,而ATP 是维持细胞代谢所必需的[22],并在红细胞产生过程中被用于血红蛋白的合成。因此,低维生素B12水平导致甲基丙二酰辅酶A 可逆增加,造成甲基丙二酸(methylmalonic acid,MMA)积累。MMA 是速率限制酶肉碱棕榈酰转移酶1(CPT1)的有效抑制剂,该酶对β氧化途径中长链脂肪酸的分解至关重要。CPT1 的这种抑制可能会增加脂肪酸和硫酸三甘氨酸(triglycine sulfate,TGS)[23],进而导致血脂异常[24]。此外,维生素B12在脂肪酸和能量代谢方面也发挥其独特的作用,维生素B12是甲基丙二酰变位酶的辅助因子,甲基丙二酰变位酶能为线粒体代谢提供琥珀酸和脂肪酸[17],是脂肪酸生物合成中甲基化的关键辅助因子。维生素B12缺乏会造成MMA 升高,MMA 会抑制脂肪酸合成,干扰正常的脂质合成[25]。
2.3 维护神经系统健康,增强记忆力
叶酸和维生素B12参与蛋氨酸代谢,蛋氨酸代谢失调会提高血清同型半胱氨酸[26]。同型半胱氨酸是蛋氨酸分解代谢的中间体,血清同型半胱氨酸水平升高是与胰岛素抵抗相关的代谢性疾病和轻度认知障碍危险因素。研究表明[27],补充叶酸、维生素B6和维生素B12等B 族维生素可降低老年认知障碍患者的血清同型半胱氨酸水平。因此,叶酸和维生素B12均可能与糖代谢和轻度认知障碍有关[22]。然而,叶酸和维生素B12状态的平衡可能更为重要。大多数素食者易出现胰岛素抵抗并患有维生素B12缺乏症,但叶酸充足,这可能会增加2 型糖尿病和轻度认知障碍的患病率[28]。髓鞘是保护神经纤维的鞘的一个组成部分,维生素B12的独特功能是参与髓鞘的合成,严重的维生素B12缺乏会导致脊髓病(亚急性联合变性)、共济失调、视神经病、周围神经病和精神病性痴呆[25]。虽然维生素B12缺乏症导致疾病的确切机制仍不清楚,但其与维生素B12的几个重要功能可能是相关的。维生素B12通过直接清除自由基增强谷胱甘肽活性、减少内质网应激和抵抗几种神经系统疾病模型中的神经元凋亡来防止氧化损伤和炎症应激[29]。
3 维生素B12在畜禽生产上的应用
3.1 维生素B12在单胃动物上的应用
维生素B12能促进谷氨酸和蛋氨酸的生物合成,参与碳水化合物、蛋白质和脂肪代谢。单胃动物维生素B12需要量见表1。研究发现,生猪缺乏维生素B12会导致食欲下降、生长缓慢。母猪维生素B12缺乏,母猪配种受胎率下降[30],易造成流产或产出弱仔、死胎[31]。维生素B12对繁殖性能的影响主要表现为:增加精子数量和增强精子活力,减少精子DNA 损伤,提高生殖器官的功效,减少一氧化氮的产生量、精子的氧化损伤、精子产生的能量和炎症引起的精液损伤[32]。王中明等[33]试验结果显示,在断奶仔猪的基础日粮中额外添加1.0%、1.5%维生素B12,与对照组相比,试验组可提高仔猪平均日增重和采食量,显著降低料重比,其中以1.0%添加效果较好。维生素B12能促进营养物质吸收、提高饲料利用率、降低料重比,进而提高仔猪的生长性能。王宝维等[34]试验结果表明,ELOVL7基因表达对血清脂质代谢具有调控作用,饲粮中添加0.25 mg/kg 叶酸和0.009 mg/kg 维生素B12可提高五龙鹅肝脏中ELOVL7基因表达量来改善机体脂肪代谢。龙建华等[35]研究表明,5~15周龄五龙鹅饲粮中维生素B12添加水平为0.012 6~0.013 4 mg/kg 综合效益最高。

表1 单胃动物维生素B12需要量
3.2 维生素B12在反刍动物上的应用
Wang 等[40]研究发现,与未注射维生素B12的奶牛相比,注射维生素B12的奶牛采食量更大,泌乳性能更好,产后体重下降更少,血浆非酯化脂肪酸和β-羟基丁酸浓度较低,但血浆超氧化物歧化酶活性较高。Khalid等[41]研究表明,断奶山羊的血清维生素B12过低(<200 pg/mL)会导致中性粒细胞功能受损,降低机体对病原体的免疫力。Ahmed 等[42]研究发现,在精液冷冻保存培养基中添加5 mg/ml 维生素B12具有增加水牛精子的活力和运动性,DNA完整性和抗氧化活性等作用。Xu 等[43]研究表明,给早期泌乳奶牛肌内注射维生素B12(10 mg/头/周)可提高产奶量,且不影响牛奶的乳蛋白和脂肪含量。Girard 等[44]研究发现,限饲(自由采食摄入量的75%)的经产荷斯坦奶牛每周肌肉注射320 mg 叶酸+10 mg 维生素B12可增加血浆中同型半胱氨酸、异亮氨酸、亮氨酸、缬氨酸和支链氨基酸的浓度。Duplessis 等[45-46]研究发现,补充叶酸(2.6 g/d)和维生素B12(2 mL/周)可提高泌乳早期奶牛的能量代谢效率和产后血浆同型半胱氨酸浓度。Zacchini 等[47]研究发现,在卵母细胞体外成熟期间补充200 mg/kg 维生素B12可改善绵羊胚胎的胎盘血管生成、增加受精率,增加卵母细胞中DNMT 和DNMT3B 的表达量和甲基供体的摄取量,纠正胚胎甲基化缺陷,有助于胚胎发育期间的表观遗传修饰和胎盘发育。反刍动物可以通过补充无机钴利用瘤胃微生物合成维生素B12,研究表明,氯化钴可以通过提高HIF-1αmRNA(缺氧诱导因子,HIF)和蛋白水平,使VEGF mRNA(血管内皮生长因子信使RNA,VEGF)上调,血管生成对哺乳动物(牛、羊等)卵细胞的形成及其功能的维护至关重要[48-49]。
4 小结
维生素B12在动物体内发挥的重要作用越来越明显,可影响中枢神经系统、繁殖能力、营养物质代谢、生长速度、贫血等。补充维生素B12可以提高畜禽生长发育、提高饲料利用率、提高繁殖性能、提高泌乳性能、减轻炎症反应等。目前关于维生素B12的研究多集中在生产应用的探究,但对其在不同物种及不同阶段需要量、最适添加量及作用机制的相关研究较少,因此,今后应加强对于需要量、最适添加量及作用机制的研究,旨在为维生素B12在畜禽生产应用提供更科学、更全面的指导作用。

