一次急性运动对骨骼肌AMPK不同亚型的影响:Meta分析
吴卫东 徐嘉宝 王 宇 魏建翔
(1. 郑州大学体育学院 运动训练系,河南 郑州 450040;2. 安阳师范学院 教育学院,河南 安阳 455000)
腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)在机体能量代谢和调节中发挥关键作用,与慢性炎症、糖尿病、肥胖及心血管疾病等疾病密切相关。AMPK包含一个催化亚基α和两个调节亚基β和γ,其中α亚基有α1和α2两个亚型,主要分布在肝脏、心肌和骨骼肌中。AMPK活性主要受Thr172位点调控,缺氧、缺血和运动等均可激活AMPK。研究表明,运动激活AMPK后可促进葡萄糖转运,增加骨骼肌对葡萄糖的吸收和利用;还可促进脂肪氧化代谢和抑制脂肪合成;此外,AMPK可增加糖酵解、抑制糖原合成和糖异生[1],因此,运动与AMPK的关系受到广泛关注。
AMPK是骨骼肌重要的能量感受器,在调节骨骼肌细胞能量稳态中发挥重要作用。但关于运动后人体骨骼肌AMPK活性变化趋势的研究较少,尤其是运动后人体骨骼肌AMPKα、AMPKα1及AMPKα2的活性变化有何异同?尚未见报道。目前,关于运动对AMPK影响的研究多为动物实验,动物研究显示AMPK在运动过程中的变化趋势受运动强度和持续时间的影响[2]。有研究总结了不同运动类型运动后动物骨骼肌AMPK的变化趋势,以强度为30%~40%VO2max运动至疲劳时AMPK可被激活,运动强度为60%VO2max时AMPK较易被激活[3]。那么,一次急性运动后人体骨骼肌中AMPKα、AMPKα1及AMPKα2的活化趋势有何异同?其变化趋势与运动强度、时间关系如何?基于此,本文将通过系统分析评价一次急性运动中和运动后人体骨骼肌AMPKα、AMPKα1及AMPKα2的变化趋势,为选择科学的运动方案改善人体骨骼肌机能提供理论支持。
1 资料与方法
1.1 文献检索
本研究根据PRISMA声明进行。检索的电子文献数据资源库分别来自知网、万方、Web of Science、PubMed、Embase。本文采用中文检索关键词为:“运动”“训练”和“AMPK”,英文检索关键词为“exercise”“training”和“AMPK”:最后检索时间为2023年3月1日。
1.2 纳入与排除标准
纳入标准:①急性运动干预;②结局指标包括AMPK;③以平均数±标准差或标准误表示。
排除标准:①长期运动干预;②非人体实验;③非中英文文献。
1.3 数据提取
由两名人员根据文献纳入和排除标准,采用独立平行方式进行筛选与提取,内容包括文章的基本信息(标题、作者、发表时间);研究对象的样本量、年龄、BMI、性别、患病情况、运动方案和结局指标AMPK。
1.4 质量评估
文献质量采用Cochrane Handbook标准对纳入研究的质量进行评估。该标准包括7个问题,每个问题三种选项:“low risk”、“unclear risk”、“high risk”,对文献质量做出总体评估。文献质量分为低度、中度和高度偏倚。
1.5 统计学分析
采用Revman 5.4软件对指标进行分析。本研究中数据为连续型变量,均以平均数±标准差进行统计,并计算95%置信区间。使用I2评价研究间异质性,I2<25%为无异质性,25%≤I2<50%为轻度异质性,50%≤I2<75%为中度异质性,I2≥75%为重度异质性。I2≤50%采用固定效应模型;I2>50%采用随机效应模型。采用漏斗图进行发表偏倚检验,逐一排除法进行敏感性分析。
2 结果
2.1 文献检索
初步检索共筛出1485篇文献,剔除重复文献后剩余1378篇,阅读题目和摘要进行初筛后获得文献34篇,阅读全文最终确定纳入文献19篇进行Meta分析。流程见图1。

图1 文献筛选流程图
2.2 文献基本特征
纳入19篇研究进行Meta分析,纳入总人数285例。需要注意的是,纳入研究包含2种及以上运动方案且研究对象为同批研究对象,相应间隔1~3周。纳入文献的基本特征见表1。

表1 纳入文献的基本特征
2.3 Meta分析结果
2.3.1 运动后人体骨骼肌AMPKα变化趋势
运动后人体骨骼肌AMPKα变化趋势见图2、3。由于各研究对AMPKα的测量单位不同,采用标准化均数差(SMD)表示。结果显示,运动后0min合并效应量高于运动前,且具有显著性SMD=[0.91,95%CI为(0.69,1.12),Z检验P<0.05],各研究间无异质性I2=10%。运动后30min合并效应量高于运动前,且具有显著性SMD=[1.17,95%CI为(0.75,1.60),Z检验P<0.05],各研究间无异质性I2=84%。运动后120min合并效应量高于运动前,且具有显著性SMD=[0.52,95%CI为(0.02,1.01),Z检验P<0.05]。各研究间无异质性I2=90%。运动后180min合并效应量高于运动前,且具有显著性SMD=[0.71,95%CI为(0.25,1.16),Z检验P<0.05],各研究间无异质性I2=21%。其他各组间无显著性差异(P>0.05)。
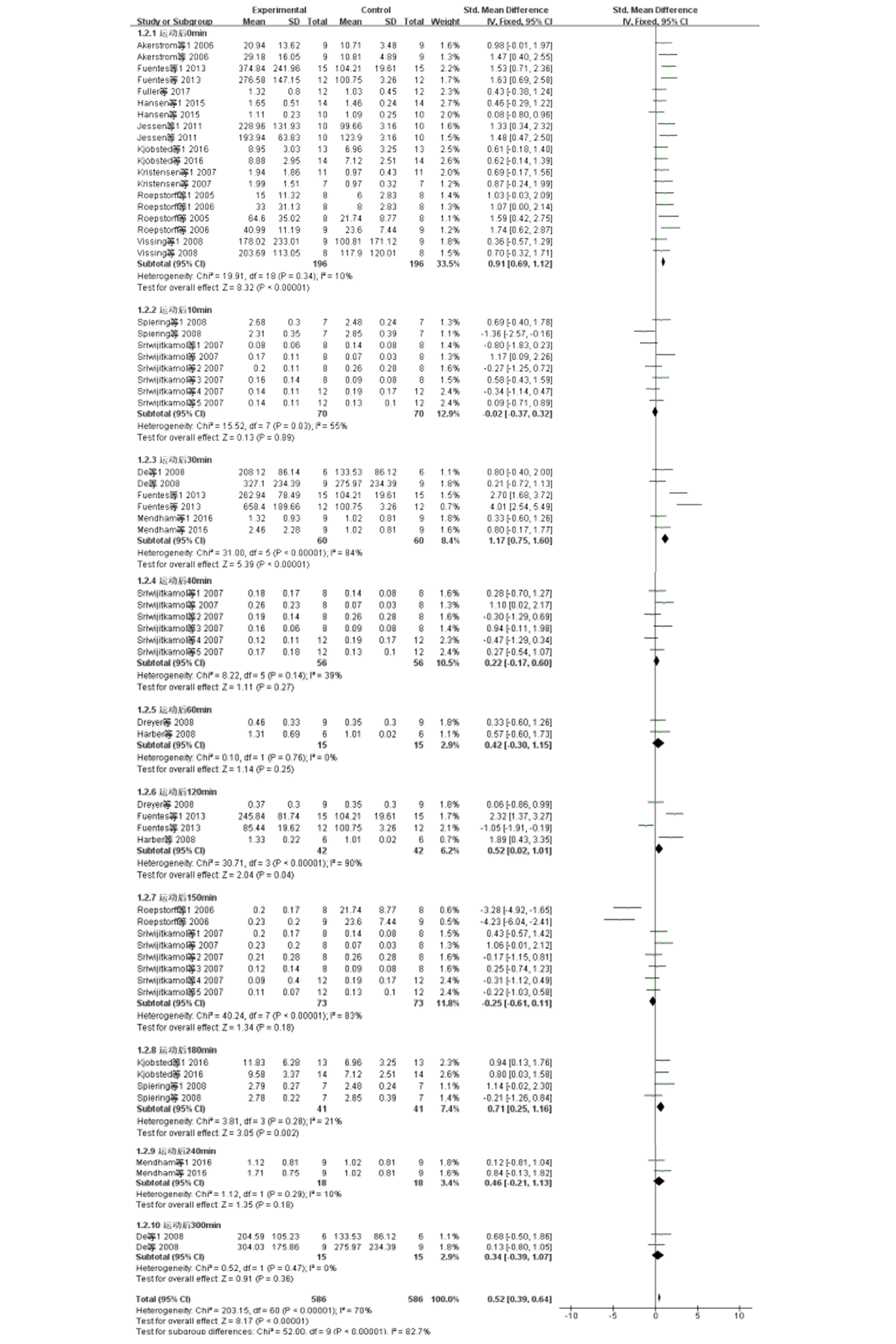
图2 运动后人体骨骼肌AMPKα的Meta分析

图3 运动后人体骨骼肌AMPKα效应量的变化趋势
2.3.2 运动后人体骨骼肌AMPKα1变化趋势
运动中和运动后人体骨骼肌AMPKα1变化趋势见图4、5。由于各研究对AMPKα1的测量单位不同,采用标准化均数差(SMD)表示。结果显示,运动中和运动后的合并效应量均与运动前合并效应量无显著性差异,而运动后0min时P=0.05。

图4 运动后人体骨骼肌AMPKα1的Meta分析
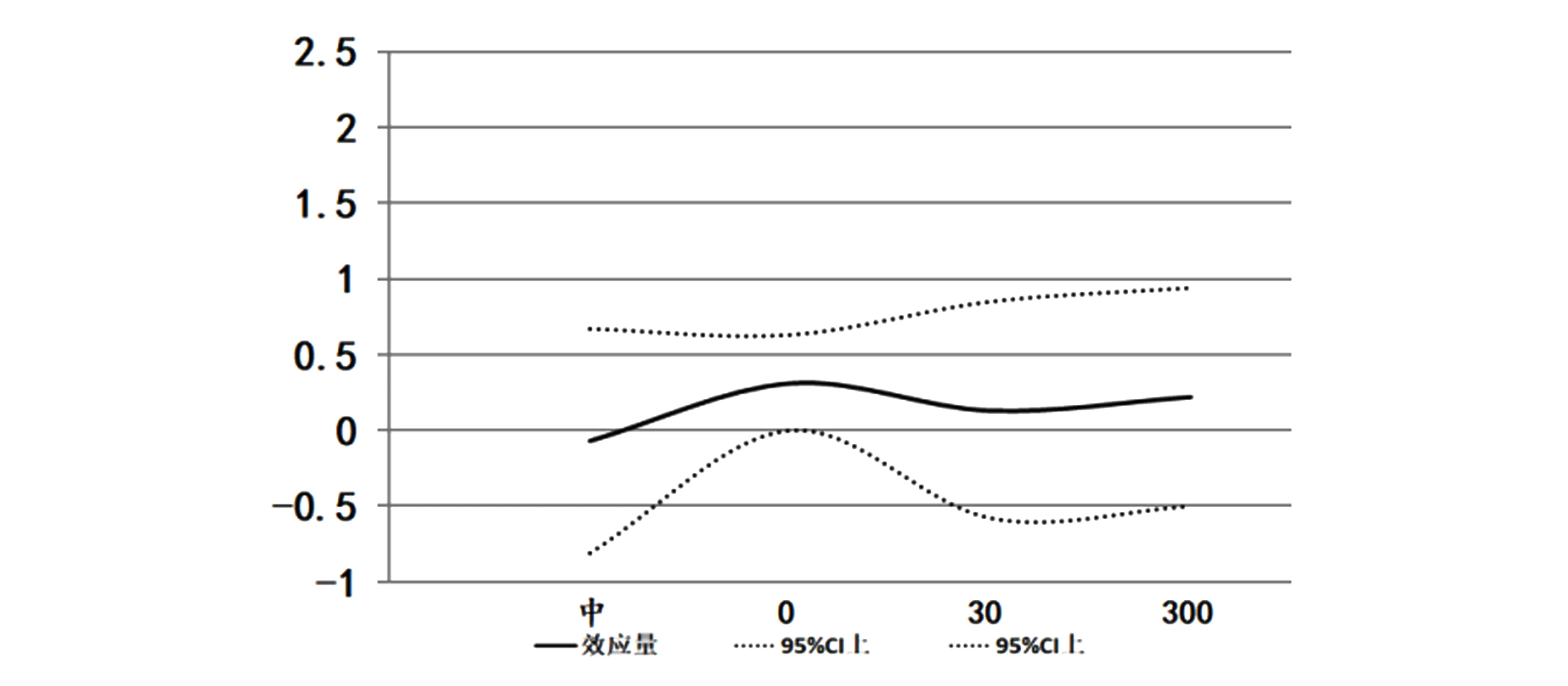
图5 运动后人体骨骼肌AMPKα1效应量的变化趋势
2.3.3 运动后人体骨骼肌AMPKα2变化趋势
运动中和运动后人体骨骼肌AMPKα2变化趋势见图6、7。由于各研究对AMPKα2的测量单位不同, 采用标准化均数差(SMD)表示。 结果显示, 运动中合并效应量高于运动前,且具有显著性SMD=[0.73,95%CI为(0.12,1.33),Z检验P<0.05],各研究间无异质性I2=0%。运动后0min合并效应量高于运动前,且具有显著性SMD=[0.82,95%CI为(0.52,1.11),Z检验P<0.05],各研究间无异质性I2=39%。运动后60min合并效应量高于运动前,且具有显著性SMD=[1.19,95%CI为(0.16,2.21),Z检验P<0.05]。其他各组间无显著性差异(P>0.05)。
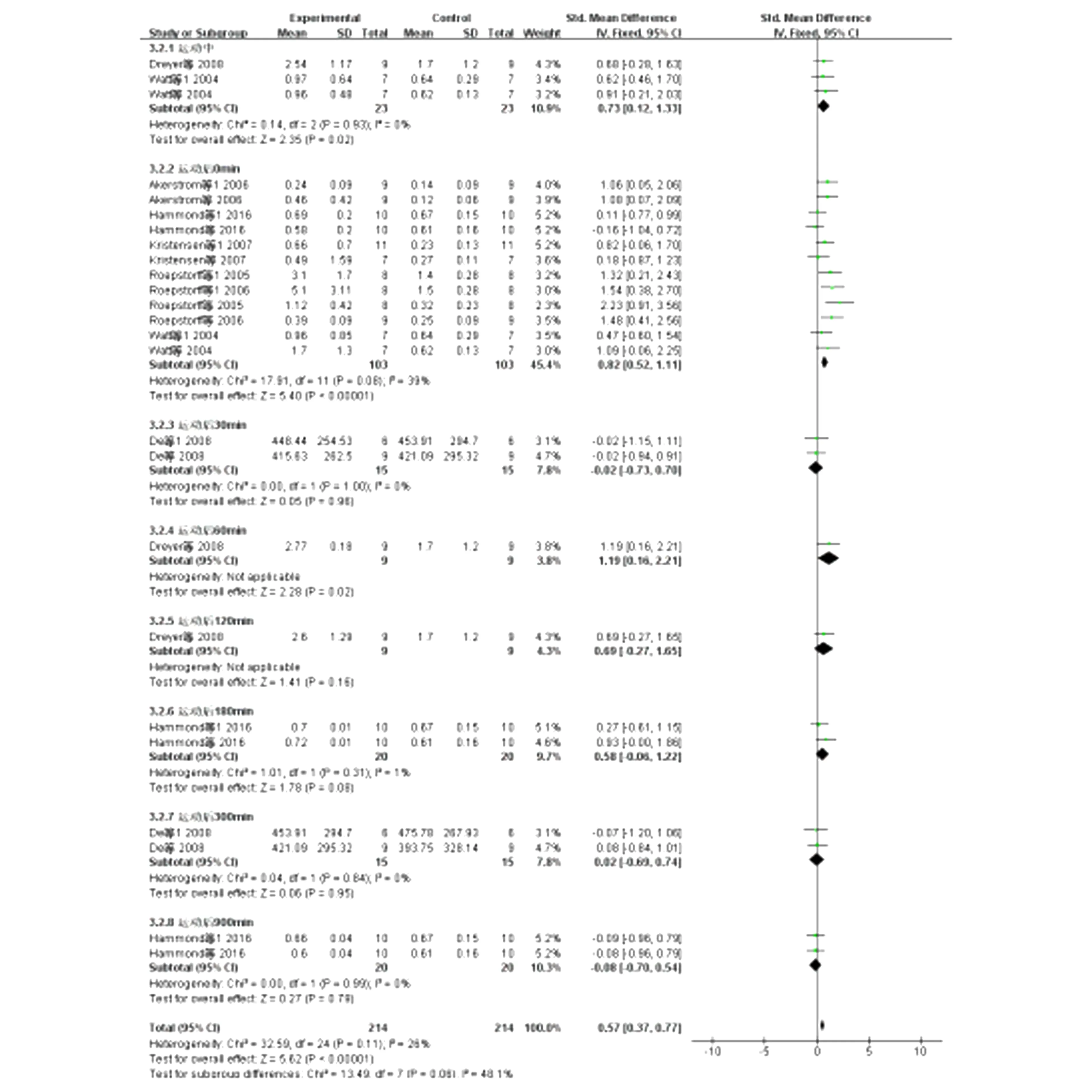
图6 运动后人体骨骼肌AMPKα2的Meta分析
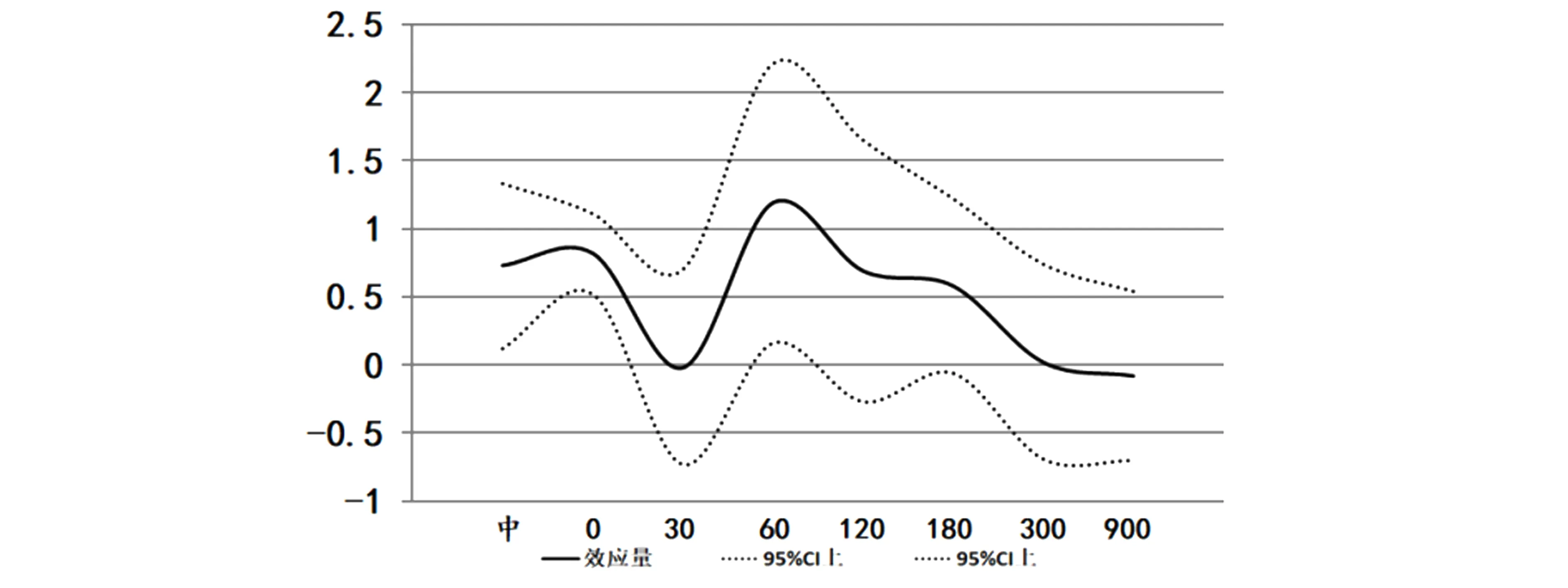
图7 运动后人体骨骼肌AMPKα2效应量的变化趋势
3 讨论
AMPK是一种重要的细胞能量感受器。运动可通过增加骨骼肌能量消耗激活AMPK,活化的AMPK可增强分解代谢相关细胞因子的活性或表达促进能量的生成。单磷酸腺苷(AMP)与二磷酸腺苷(ADP)比例和ADP与三磷酸腺苷(ATP)的比例变化会激活AMPK[23]。在运动过程中,ATP被大量消耗,AMP/ADP和ADP/ATP比例升高,随后AMPKγ亚基与AMP相互作用,促使AMPKα亚基中Thr172磷酸化,AMPK被激活[24]。此外,ATP与AMPKγ亚基作用后促使AMPK构象变化,构象变化后AMPK同样被激活[25]。有研究显示,两种激活方式可促使AMPK活性增加近1000倍[26]。在骨骼肌中,肝激酶B1(LKB1)可激活AMPKα2,高强度和中等强度持续运动均可通过此通路激活AMPKα2[27]。此外,长时间低强度运动可通过钙调素依赖性蛋白激酶β(CaMKKβ)激活AMPKα1[28]。
人体骨骼肌AMPK活性和表达量受运动影响较大,且运动强度变化对其影响显著。研究发现,以30%~40%VO2max的小强度运动至疲劳状态时AMPK可能被激活,且随运动时间的延长而活性增强。随运动强度增加,AMPKα2活性增加较为显著,有研究发现以逐渐递增强度运动1h后AMPKα2活性增加5倍。以68%VO2max强度运动30min后,AMPKα2活性显著增加[29]。在高强度或中等强度运动中,骨骼肌中AMPKα2被激活,并与运动强度和运动时间呈正相关,但AMPKα1并无出现此现象,甚至会随着运动强度和运动时间的增加而降低[30]。此外,有研究显示,在长期运动训练后进行一次急性运动干预后骨骼肌AMPK的活性出现降低,这可能是在运动训练后骨骼肌中糖原升高,阻止了AMPK在运动中被充分激活[31]。由此可见,正常情况下,AMPK活性随运动强度的增大和时间的增加,其活性逐渐增强,但AMPK不同亚基表现出不同变化趋势,骨骼肌中AMPKα2更易被激活。
本研究结果显示,一次急性运动中、0min和60min,骨骼肌中AMPKα2合并效应量高于运动前(P<0.05),说明一次急性运动可激活骨骼肌中AMPKα2,这与先前的研究结果一致。不同运动强度和运动时间可影响AMPK活性,一次较高强度的急性运动后,AMPK的活性将在短时间内升至高点,在运动后20min恢复到基础状态。一次中等强度的急性运动后,AMPK的活性会随着运动时间的延长而增加,一段时间后将保持稳定,运动结束后活性可维持数小时。此外,在一次急性运动后10min和40min时,并未发现AMPKα2被激活,这可能与研究者的运动方案有关。该研究者采用50%VO2max运动强度进行干预,此强度可能并未改变AMPKα2的活性。一次急性运动后,骨骼肌中AMPKα1合并效应量均未高于运动前(P>0.05),说明一次急性运动不能激活AMPKα1。但值得注意的是,在运动后0min(P=0.05),说明一次急性运动有激活AMPKα1的可能性,且可能存在其它激活路径。一次急性运动后0min、30min、120min和180min,骨骼肌中AMPKα合并效应量高于运动前(P<0.05),说明在一次急性运动后0min、30min、120min和180min,可激活AMPKα,且AMPK活性可维持数小时,该结果与AMPKα2类似。
4 结论
一次急性运动后0min、30min、120min和180min,骨骼肌AMPKα活性升高;一次急性运动中、0min和60min,骨骼肌AMPKα2活性升高。

