桶混助剂对25%吡唑醚菌酯悬浮剂防治黄瓜靶斑病的调控作用
曹雄飞,刘变娥,孟令涛,王佳辉
(1.江苏擎宇化工科技有限公司,扬州 211400;2.山东滨农科技有限公司,滨州 256600)
黄瓜靶斑病是由多主棒孢菌侵染引起的,又被称为褐斑病、小黄点病等,是影响黄瓜生产的一种重要病害[1]。近年来,随着设施栽培模式发展,黄瓜温室大棚种植面积增加。高温高湿环境下黄瓜靶斑病发生严重,且发病率逐年增加。目前该病害的防治主要以化学防治为主,但长期高频不合理的用药易产生抗药性,导致黄瓜品质降低及环境污染等问题。
吡唑醚菌酯属甲氧基丙烯酸酯类杀菌剂,作为线粒体呼吸抑制剂,其作用机理是阻止细胞色素b合成过程中的电子传递系统来抑制线粒体的呼吸作用,使无法产生供细胞代谢的ATP,促使细胞死亡,对卵菌、子囊菌、担子菌、半知菌等引发的多种植物病害有较强的防治效果。吡唑醚菌酯具有杀菌谱广、活性高、环境相容性好等特点,还具有渗透性和内吸传导性,其广泛应用于多种粮食作物、蔬菜等的病害防控[2]。截至2022年12月,吡唑醚菌酯已有721个制剂产品有效登记,主要包括悬浮剂、可湿性粉剂等。吡唑醚菌酯也是首个以“植物健康作用”登记的产品,通过诱导作物的生理变化,刺激植物产生抗逆性,对作物起到保护和治疗的作用。
农药在植物体内的内吸和传导行为影响其效果发挥,研究农药在作物各部位的内吸传导行为,有助于明确农药的作用方式[3]。助剂本身没有生物活性,但与农药制剂混用时,可以提高农药有效成分在作物靶标上的黏附性、渗透性等,从而提高药剂的吸收传导性能,进而提高农药利用率[4]。
为筛选能够与吡唑醚菌酯桶混并提高其防控黄瓜靶斑病田间防效的农药助剂,本研究探究了4种不同结构类型的助剂对吡唑醚菌酯悬浮剂对靶沉积界面性能及在黄瓜植株体内吸收传导的影响,并考察其与吡唑醚菌酯悬浮剂桶混对黄瓜靶斑病田间防效的提升效果,为农药桶混助剂应用及有效防治黄瓜靶斑病提供理论依据。
1 材料与方法
1.1 药剂和仪器
250 g/L吡唑醚菌酯EC,巴斯夫植物保护(江苏)有限公司;25%吡唑醚菌酯SC、SP-4806(双亲性阳离子)、SY-A(有机硅)、SY-B(多元醇聚氧乙烯醚)、SY-C(脂肪醇聚氧乙烯醚),江苏擎宇化工科技有限公司。
A101 全自动表面张力仪、JC2000C 接触角测试仪,美国科诺工业有限公司;KRUSS-BP100动态表面张力仪,德国克吕士;无菌操作台,无锡迈峻实验设备有限公司;三角瓶,沧州津玻实验仪器有限公司;1 000~5 000 μL移液枪,德国Eppendorf公司;打孔器,科瑞达科技有限公司;接种针,上海安亭微量进样器厂;电子天平(感量0.001 g),梅特勒-托利多仪器上海有限公司;WS-18D型背负式电动喷雾器,山东卫士植保机械有限公司;LC-30AD高效液相色谱,日本岛津公司;TRIPLE QUAD 5500质谱仪,美国AB SCIEX公司。
1.2 桶混稳定性及界面性能测定
桶混稳定性及界面性能测试按照表1稀释倍数配制,分别考察基础药液及与助剂桶混后的稳定性和各界面性能指标。

表1 吡唑醚菌酯及其与助剂配比
(1)桶混稳定性。30℃水浴中考察各试样在自来水、1倍硬水、3倍硬水不同水质条件下的稀释稳定性,观察2 h内是否絮凝、沉淀。
(2)界面性能。静态表面张力的测试采用铂金板法[5-6],每次测试前先用试样将铂金板预润湿约5 mm高后,使铂金板与液面脱离。调节样品台使样品缓缓上升,直至铂金板底边刚好与样品表面接触,记录表面张力仪测量100 s的稳定读数。动态表面张力的测定采用最大气泡压力法[7]测定,毛细管半径为0.345 mm,温度为25℃,记录80~1 000 ms处的表面张力。接触角的测定采用视频光学接触角测量仪,通过座滴法分别测定30 s内2 μL各试样药液在石蜡板上的动态接触角。润湿渗透性能采用帆布片法测定[8],将圆帆布片平放到溶液中,用秒表记录圆帆布片接触液面到沉入烧杯底部的时间;在相同时间条件下考察20 μL药液有机玻璃板上的铺展面积;在相同环境条件下,考察20 μL药液在载玻片上的保湿时间;采用长势一致的黄瓜幼苗的第3片叶的正面和背面通过粘着展布对比卡测定润湿铺展级别。各试样重复测定3次,取平均值。
1.3 吸收传导试验
1.3.1 试验前处理
黄瓜种子催芽,播种于合适的花盆内,幼苗长出3片叶后摘除顶端,取长势健壮且相似的黄瓜盆栽植株,待上部叶片直径超过4 cm,将准备好的黄瓜植株中间的叶片(包括叶柄)用供试药剂(表1)浸湿,每个处理重复3次,做好标记。药后1、3、7、17 d取上、中(用药叶片)、下3个叶片,洗净待用。
1.3.2 检测条件
色谱分析条件:色谱柱:Hypersil GOLD TM VANQUISH C18色谱柱(2.1 mm×100 mm,1.9 μm);流动相:A∶B=20∶80,其中,A:0.1%甲酸水溶液,B:乙腈;流速:0.3 mL/min;柱温:30℃;进样量:0.5 μL。
质谱分析条件:电喷雾离子源,正离子电离(ESI+),毛细管电压3.20 kV,离子源温度300℃,去溶剂温度400℃;采用多反应离子监测模式(MRM),用基质匹配标准溶液外标法定量。母离子m/z为388.2,子离子m/z分别为194和163,其中m/z为334.9的子离子作为定量离子;碰撞能量分别为9 eV和25 eV,锥孔电压均为80 V。
1.3.3 样品提取、净化与检测
准确称取2.0 g(精确至0.1 g)样品于10 mL带盖离心管中,加入5 mL乙腈,涡旋3 min,室温静置2 h,加入0.5 g NaCl,1 g无水MgSO4,回旋振荡器上振荡1 min,4 000 r/min离心5 min,取1.5 mL上清液于含吸附剂(30 mg PSA+150 mg无水MgSO4+20 mg C18)的2 mL离心管中,涡旋1 min,4 000 r/min离心5 min,取上清液,过0.22 μm有机滤膜,在1.3.2检测条件下对样品残留量进行检测。通过测定药液在靶标体内的残留量,来反映药剂的持效性和速效性[9]。同时统计上部和下部叶片上药液的残留量,按式(1)和(2)计算各处理向上、向下的传导率。
1.4 田间防效试验
1.4.1 试验设计
田间小区试验于2021年12月在山东省滨州市滨农科技黄瓜试验基地进行。田间防效试验设计如表2。试验共7个处理,每处理3次重复,共计21个小区。施药当天晴,最高气温27℃,最低气温15℃,平均气温21℃,药后24 h内无降雨。
1.4.2 调查方法
药后5、7 d分别进行调查,每小区随机调查5株,整株调查,统计总叶数和各级病叶数,每片叶按病斑占叶面积的百分率分级。分级标准如下:0级:无病斑;1级:病斑面积占整个叶片面积的6%以下;3级:病斑面积占整个叶片面积的6%~10%;5级:病斑面积占整个叶片面积的11%~20%;7级:病斑面积占整个叶片面积的21%~40%;9级:病斑面积占整个叶片面积的40%以上。
按式(3)和(4)计算病情指数和防效。
1.5 数据处理
采用Excel 2017进行数据录入与计算,采用SPSS 19.0进行单因素方差分析,采用GraphPad Prism 8作图。
2 结果与分析
2.1 助剂对桶混稳定性及界面性能的影响
4种助剂与25%吡唑醚菌酯SC桶混处理,在不同水质条件下,于30℃水浴静置2 h均无絮凝和沉淀现象,表明4种助剂对25%吡唑醚菌酯SC稀释稳定性没有影响,可以作为桶混助剂使用。
从表3可知,25%吡唑醚菌酯SC药液表面张力大于60 mN/m,接触角大于100°,远高于250 g/L吡唑醚菌酯EC药液的表面张力,略高于黄瓜叶片的临界表面张力(58.70~63.30 mN/m),影响药效的发挥,且润湿渗透性能较差,表明在该制剂推荐用量下,其药液尚不能形成有效润湿和铺展。加入助剂SP-4806、SY-A、SY-C 3个助剂调控后,药液表面张力小于30 mN/m,SY-B调控后药液表面张力小于40 mN/m,均远低于黄瓜叶片的表面张力。同时4种助剂均能降低1 000 ms时动态表面张力,均能不同程度地增强润湿渗透性能,润湿时间较25%吡唑醚菌酯SC分别降低了94.81%、99.19%、33.33%和82.19%,且分别提高3、5、1个和3个叶片润湿等级,同时有效增加铺展面积。表明4种助剂均对25%吡唑醚菌酯SC桶混稳定性及界面性能有较好的调控作用。
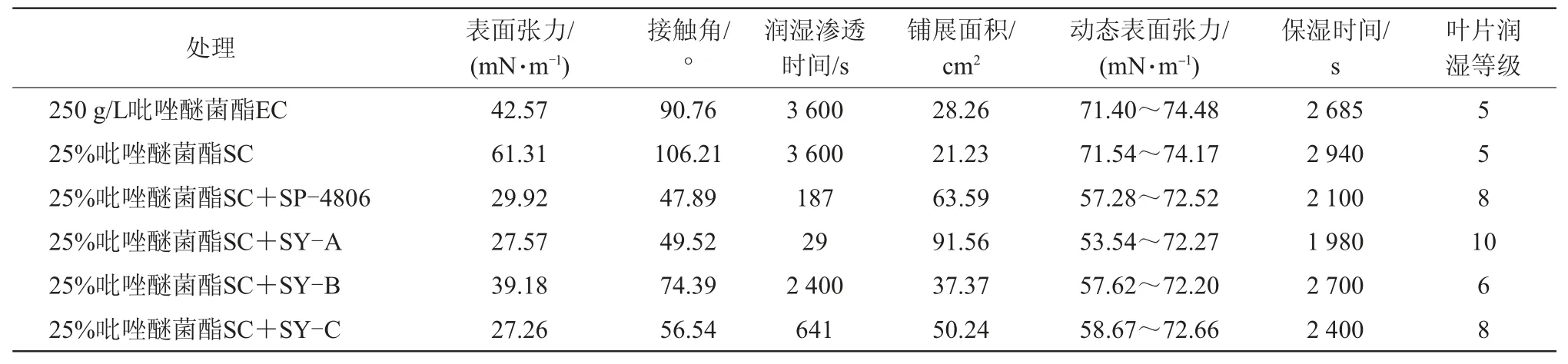
表3 助剂对吡唑醚菌酯界面性能的影响
2.2 助剂对25%吡唑醚菌酯悬浮剂速效性和持效性的影响
表4显示,药后1 d除25%吡唑醚菌酯SC+SY-C外的其他处理施药叶片残留量无显著差异。随着药剂被靶标吸收,药后3 d,250 g/L吡唑醚菌酯EC和25%吡唑醚菌酯+SY-A的残留量呈现下降趋势,与250 g/L吡唑醚菌酯EC比较,药后第3 d和第7 d,25%吡唑醚菌酯SC处理残留量较高;SP-4806、SY-A、SY-B和SY-C助剂桶混处理低于25%吡唑醚菌酯SC处理。药后17 d,25%吡唑醚菌酯SC及助剂SY-A、SY-B、SY-C处理残留均显著下降,而250 g/L吡唑醚菌酯SC+SP-4806处理显著高于其他处理。

表4 助剂对25%吡唑醚菌酯SC 在靶标体内残留量的影响
2.3 助剂对25%吡唑醚菌酯悬浮剂内吸传导性能的影响
表5显示,药后1 d,助剂SP-4806、SY-B和SY-C均能显著增强25%吡唑醚菌酯SC向上传导率。药后17 d,4种助剂均能一定程度地增强25%吡唑醚菌酯SC向上传导率。SP-4806处理促进传导的效果最好,药后17 d向上传导率为1.26%;且药后1~3 d,向上传导率显著高于25%吡唑醚菌酯SC及其他助剂桶混处理。SY-B助剂处理也有较好的促传导效果,药后1 d和17 d的向上传导率与SP-4806处理相近。

表5 助剂对吡唑醚菌酯在黄瓜体内向上传导性能的影响
从表6可知,4种助剂调控对向下传导速率的影响差异较大。25%吡唑醚菌酯SC+SP-4806处理药后1、3 d向下传导率均显著高于25%吡唑醚菌酯SC和其他助剂处理,药后7 d的向下传导率也显著高于25%吡唑醚菌酯SC以及除SY-A外的其他助剂处理,表明助剂SP-4806对25%吡唑醚菌酯SC的向下传导促进效果最好。25%吡唑醚菌酯SC+SY-B、25%吡唑醚菌酯SC+SY-C处理的药后1 d和7 d的向下传导率显著高于25%吡唑醚菌酯SC。而助剂SY-A对25%吡唑醚菌酯SC的向下传导促进效果最差,25%吡唑醚菌酯SC+SY-A药后1、3 d和17 d向下传导率低于25%吡唑醚菌酯SC。
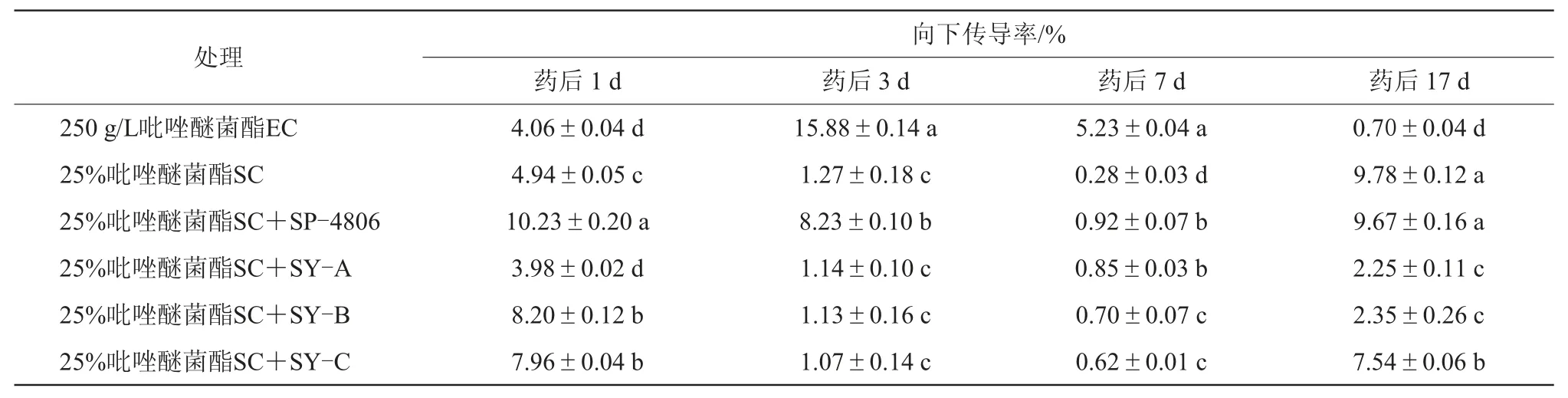
表6 助剂对吡唑醚菌酯在黄瓜体内向下传导性能的影响
2.4 助剂对25%吡唑醚菌酯SC防治黄瓜靶斑病的影响
由表7可知,药后5 d和9 d,25%吡唑醚菌酯SC,对黄瓜靶斑病的防效均低于250 g/L吡唑醚菌酯EC,分别为29.71%和50.82%。药后5 d,25%吡唑醚菌酯桶混助剂SP-4806、SY-A、SY-B和SY-C的药效分别较25%吡唑醚菌酯SC提高了24.95、10.58、0.5百分点和0.02百分点,药后9 d分别提高25.94、-2.81、6.49百分点和1.22百分点。其中助剂SP-4806对25%吡唑醚菌酯SC的增效最为显著,药后5 d和9 d对黄瓜靶斑病的防效较高。
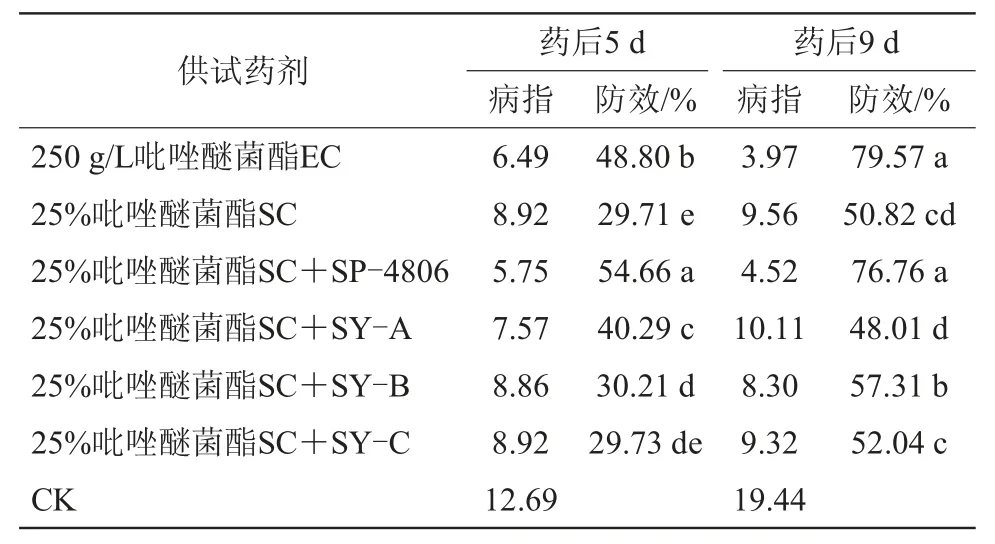
表7 助剂调控吡唑醚菌酯对黄瓜靶斑病的防治效果
整个试验期间,除了助剂SY-A与25%吡唑醚菌酯SC组合桶混防治黄瓜靶斑病在药后5 d对黄瓜叶片产生了药害,助剂SP-4806、SY-B、SY-C均对黄瓜生长安全。
3 结论与讨论
农药的内吸传导性能对药效的影响至关重要。有研究发现,桶混助剂能够提升杀菌剂的药效,其主要原因是其降低药液液滴在植物表面的接触角和表面张力,改善了药液的润湿展布能力,从而提高了植物对杀菌剂的吸收和传导量[10]。本研究发现,SP-4806、SY-A、SY-B、SY-C 4种助剂桶混均能降低药液表面张力、接触角,使得表面张力远小于黄瓜叶片的临界表面张力,同时均能不同程度地增强润湿渗透性能,增加铺展面积,均可以作为药效调控助剂使用。同时研究发现不同类型的助剂调控后吸收传导规律差异较大,其中有机硅助剂SY-A调控后药液润湿渗透性能最强,帆布片仅需29 s,测试在黄瓜体内的吸收传导性能,发现SY-A对向下传导有一定的副作用,田间防效也证实虽然前期对防效有一定的提升作用,但后期出现了药害,这可能是因为生育期短的蔬菜作物蜡质层薄,不适合用渗透性太强的助剂调控[11]。而SY-B调控后,表面张力下降较少。SP-4806和SY-C降低表面张力、增强润湿渗透性能的能力差异不大,但SP-4806促进向上、向下部叶片传导的性能更突出,同时延长持效期。田间防效显示,SP-4806作为桶混助剂与25%吡唑醚菌酯SC混用,对防治黄瓜靶斑病的增效效果较其他助剂突出,效果达到与250 g/L吡唑醚菌酯EC相当甚至更高的水平。
于倩倩等[12]研究发现,通过磷酸三丁酯(TBP)、癸二酸二乙酯(DES)和辛二酸二乙酯(DESU)等助剂组合可以提升赤霉素在小麦叶片上的渗透吸收,从而提高药效。也有研究发现,亲水性农药和亲水性非离子脂肪醇聚氧乙烯醚助剂联合施用可能会提高叶片对农药的吸收能力[13]。本研究结果表明,阳离子助剂SP-4806调控和其他3个类型的助剂比较,能够显著提高吡唑醚菌酯在黄瓜体内的传导性能,其机理可能与特殊的阳离子结构能够更好地亲和靶标表面电负性结构,促进药剂被吸收相关。
本研究结果显示,除有机硅助剂SY-A调控出现药害以外,助剂SP-4806、SY-B和SY-C调控对黄瓜安全,其中阳离子助剂SP-4806调控25%吡唑醚菌酯SC对黄瓜靶斑病的防效较其他助剂增效效果显著。因此,在田间应用时,根据化学农药的特性,合理正确地选择助剂种类,对病虫害化学防控至关重要。

