感潮河流氮行为对溶解氧亏损的限定影响
温 婧,黄邦杰,黄志伟,房怀阳,王龙乐,张英民,曾凡棠,杜宏伟
感潮河流氮行为对溶解氧亏损的限定影响
温 婧,黄邦杰,黄志伟,房怀阳,王龙乐,张英民,曾凡棠,杜宏伟*
(生态环境部华南环境科学研究所,广东省水与大气污染防治重点实验室,国家水环境模拟与污染控制重点实验室,广东 广州 510535)
选择东江流域为研究区,监测流域溶解氧、氮浓度和氮氧多同位素时空变化,定量探究氮周转过程对河流溶解氧消耗的贡献.结果发现,河流溶解氧浓度在2.96~11.47mg/L之间变动,春夏季下游感潮河网区成为氧消耗利用和氧亏缺的热点区,其中表观耗氧量最高达4.8mg/L,并与水温和Cl-浓度呈现高度相关性.然而,冬春季下游感潮河网区是不同形态氮浓度的累积区以及氮同位素发生硝化作用分馏的主要时区.基于端元混合模型和同位素瑞利分馏模型模拟可知,夏季氮主要体现为保守混合,而冬、春季氮则呈现非保守状态,并在下游河网区易发生硝化作用,其作用程度分别为14.4%和32.3%,这也分别对应着冬、春季最大约7.5%和5.9%的溶解氧消耗利用来自氨氧化耗氧.氮的环境行为对河流溶解氧的影响相对局限,特别是夏季氧亏缺问题更多地受其他因素的主导.这为当前环境管理多通过氨氮标准评价和研判溶解氧能否达标的局限认识带来新的见解,也为探索研究建立分区域、分流域的溶解氧评价和考核体系提供技术支撑.
感潮河流;溶解氧亏损;氮周转耗氧贡献;氮氧同位素
溶解氧(DO)是表征水环境健康的关键指标之一,其在维持水生生物群落上扮演重要作用[1-2].自20世纪80年代以来,墨西哥湾、切萨皮克湾、长江和珠江河口的低氧面积和厚度明显呈逐年增加的趋势,这引起了人们的广泛关注并成为全球性的热点问题[3-7].随着水污染防治攻坚战的深入开展,河流水环境质量明显提升,但河流低氧问题仍然是阻碍水质达标的关键因素,尤其是近岸感潮河流低氧的强度、持续时间和频率都在增加,成为诱发河口、海湾低氧问题的先导条件[8-11].我国滨海河流DO浓度水平多年来不满足III类(5.0mg/L)及以上质量标准,长此以往其潜在影响将给河流水生态环境带来严重挑战,也将对陆-海统筹水环境管理制度的合理制定带来考验,这将成为未来新的焦点.
DO变化与生物地球化学过程密切相关,主要热点地区低氧的发生几乎都与人为引起的富营养化有着密切联系[7,12-16].特别是氮(N)的周转过程与氧气的消耗高度耦合,成为DO亏损的重要限定因素[17].通常,硝化作用是氮周转的重要过程之一,也是众多氮转化过程中最主要且最重要的耗氧途径.硝化过程,分别为氨氧化过程和亚硝酸盐氧化过程,从化学计量关系上,1mol的氨氮和亚硝氮氧化将分别消耗1.5mol和0.5mol的氧气[18].因而,硝化作用将加剧氧的消耗,并最终可能成为有利于形成低氧现象的条件或是限定因素.故此,探究耗氧物质氮输入的“活性”在DO亏损上的角色定位,成为厘清精准调控技术瓶颈背后的关键科学问题.特别是在野外多因素干扰或相互掩蔽下,识别流域尺度氮-氧耦合过程,并从定性跨越定量,揭示其对河流表观DO亏损的定量影响.相较于氮循环对水生态环境的影响及研究关注度,氮-氧耦合过程示踪的缺失与忽视,成为更直接认识氮对水生态效应影响的关键与不足,也是当前科研与管理的挑战.
同位素作为示踪剂在涉及流域氮环境行为的研究中备受青睐,因为氮转化的每个过程伴随着对应的同位素分馏[19].例如,当NH4+氧化为NO3-时,15N发生一定程度分馏,分馏系数为-5‰~ -40‰[20-21].监测流域中氮浓度与15N值的时空变化,可以更好地了解与DO消耗息息相关,而自然系统难以辨别的氮周转过程.与此同时,实现过程上的同步量化,为揭示复杂河流氮在低氧水生态环境问题上发挥的定量作用提供了巧妙思路.
东江毗邻南海,是珠江水系的重要一级支流.作为肩负粤港澳大湾区核心城市的供水重任,东江水质优良,但在下游感潮河网区低氧现象却频发.根据水环境质量公报显示,DO已成为部分断面水质不达标的限定因子.因此,东江流域为探究低氧问题与氮行为关系提供了良好场所.本研究重点通过监测DO、氮浓度与氮同位素时空变化,解读流域可能存在的氮耗氧行为,并量化氮转化与DO消耗利用之间的定量关系.
1 材料与方法
1.1 研究区概况
图1 研究区域及采样点位
Fig.1 Map of study area and the sampling sites
东江作为珠江的一级支流,从东北向西南流经江西省和广东省,最终汇入南海.该流域面积35340km2,属于亚热带季风气候区,年平均气温19.3~20.6℃,年降水量1350~1750mm,夏季(6~9月)高温、多雨,为丰水期.在水文水动力方面,研究区冬季流量小、潮汐作用导致咸潮上溯与淡水形成不同程度的混合,反之在夏季潮汐效应不明显.在土地利用类型方面,研究区从上游的草地和林地逐渐向下游的城镇用地转变.特别是在下游的城镇用地,已成为当前经济发展和人口最密集的地区.在水质方面,东江作为重要的饮用水源地,其水质良好,常年达到地表水III类质量标准,但下游河网区低DO现象却成为近年来的突出问题.因此,东江流域作为一个自然形成的河流-河口系统,成为地球上最具生产力和活力的水生生态系统之一,其低氧现象频发也为解读其背后的科学问题提供了良好的条件.
1.2 现场采样
为探究东江流域氮的环境行为对河流DO亏损的影响,研究在流域内布设了21个采样点位,均匀分布于中上游的草地、林地和下游城镇用地,并分别于2021年4月、9月和2022年1月开展三期大规模野外现场观测.其中9月夏季和1月冬季分别代表丰水期和枯水期在全流域进行采样观测,而4月春季作为平水期仅在东江下游东莞河网区开展局部采样观测.
水温()、pH值、电导率(EC)、DO等理化参数使用原位便携式水质分析仪(YSI DSS)现场测定.其他指标参数使用标准采水器现场收集水样在实验室分析测定.每个采样点水样分装2组:第1组水样装满于预先洗净的100mL聚乙烯瓶中,用于NH4+、NO2-、NO3-、Cl-浓度的测定;第2组水样装满于50mL聚乙烯瓶中,用于氢氧同位素(D-H2O和18O-H2O)和氨氮同位素以及硝态氮氮氧同位素(15N-NH4+、15N-NO3-、18O-NO3-)的测定.以上所有样品采集后在4℃条件下保存并运回实验室进行后续处理和分析.
1.3 实验分析
1.3.1 水中主要离子浓度的测定 采集的水样经0.22μm醋酸纤维膜过滤后,采用离子色谱仪(ICS-900, Thermo Fisher)进行水样中的主要离子(NH4+、NO2-、NO3-、Cl-)浓度的测定,仪器检出限在1~10μg/L.以上分析在东江水质风险控制联合实验室完成.
1.3.2 水中氢氧同位素的测定 采集的水样经0.22μm醋酸纤维膜过滤后,采用高精度激光同位素分析仪(Picarro L2130-i, Thermo Fisher)进行稳定氢氧同位素值(D-H2O和18O-H2O)测定,测定结果以维也纳标准平均海水(V-SMOW)为基准表示(值,‰).仪器分析精度分别为±0.1‰和±0.02‰.以上分析在中山大学广东省环境污染控制与修复重点实验室完成.
1.3.3 水中氨氮同位素和硝态氮氮氧同位素的测定 水样中氨氮同位素(15N-NH4+)采用化学转化法进行测定[22].该方法的原理是将NH4+首先通过碱性次溴酸盐氧化为NO2-,然后在强酸性条件下通过羟胺将NO2-转化为氧化亚氮(N2O),提取并纯化产生的N2O,用同位素比质谱仪(DELTA V ADVANTAGE, Thermo Fisher)测定15N值.测定结果以标准大气AIR为基准表示(值,‰),并且测量精度为±0.4‰.水样中硝态氮的氮氧同位素(15N-NO3-和18O- NO3-)采用细菌反硝化法联合同位素比质谱仪分析测定[23].该方法的原理是利用缺少N2O还原酶的细菌将水样中的NO3-通过反硝化作用生成N2O,然后提取并纯化N2O,测定其N2O中的氮、氧同位素值.测定结果分别以标准大气AIR和维也纳标准平均海水(V-SMOW)为基准表示(值,‰),分析测量精度分别为±0.4‰和±0.5‰.以上分析在中山大学广东省环境污染控制与修复重点实验室完成.
1.4 质量控制
为了保证分析结果的可靠性,随机抽取样品进行重复检测,平行样本之间的相对偏差小于5%.与此同时,每30个样品进行标准物质校准.其中氢氧同位素测定过程中,利用标准物质GBW04458~ GBW04461进行质量控制;硝态氮氮氧同位素测定采用国际标准物质USGS32、USGS34、USGS35进行测定校准;氨氮同位素采用国际标准物质IAEA-N1、USGS25、USG26进行样品校准.
1.5 数据处理
1.5.1 饱和溶解氧计算[24]
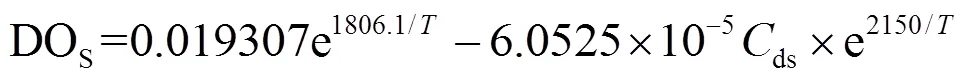
(0~25℃)(1)
(25~50℃)(2)
式中:DOs为水样饱和溶解氧值,mg/L;为水样绝对温度,K;ds为氯化物浓度,g/L.
1.5.2 稳定同位素计算
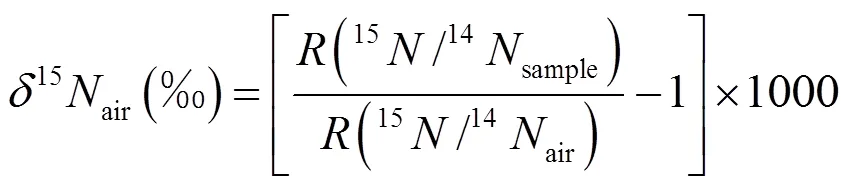
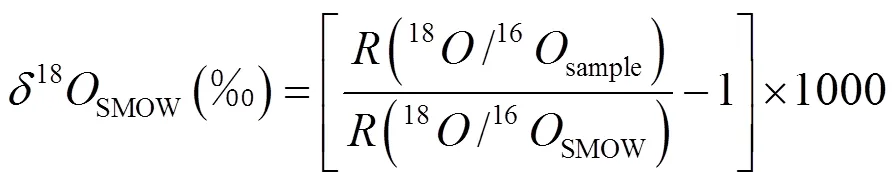
式中:15air为样品的氮稳定同位素比值相对参考物质空气的稳定氮同位素比值的千分差;(15/14sample)为样品中氮同位素丰度比值;(15/14air)为空气中氮气的氮同位素丰度比值.18SMOW为样品的氧稳定同位素比值相对参考物质标准平均海洋水的稳定氧同位素比值的千分差;(18/16sample)为样品中氧同位素丰度比值;(18/16SMOW)为标准平均海水中的氧同位素丰度比值.
1.5.3 数据统计分析与绘图 实验数据使用Excel 2019进行整理,并使用Origin 2021、ArcGIS 10.2绘图,SPSS进行T检验等显著性差异分析.
2 结果与讨论
2.1 河流DO变化和氧消耗的特征
研究区主要水环境变量包括水温、DO、Cl-变化,如图2所示.采样期间,河流DO浓度在2.96~ 11.47mg/L之间变动,并且遵循着冬季高、夏季低的季节变化特征.空间上,DO浓度从上游到下游逐渐降低,并在春夏季下游河网区形成明显的低氧热点.与此同时,影响水中氧气溶解度的关键因素—水温和Cl-浓度分别在13.5~32.3℃和4~5550mg/L之间变动.在季节上,Cl-浓度变化与水温变化相反,表现出冬季(均值558mg/L)高于夏季(均值251mg/L)的特点.在空间上,Cl-浓度和水温空间格局一致,均表现出在下游升高的特点,并与DO浓度空间特征相反.考虑水温、盐度作为影响氧气在水中溶解度的重要参数,河流DO背景值即DOs经公式(1~2)估算发现,春夏季均值(7.6~8.1mg/L)明显低于冬季(9.6mg/L),并且在空间上也呈现出从上游到下游、从10.5mg/L向7.4mg/L逐渐递减的格局.冬季河流较高的DO背景值为缓冲氧亏缺提供了有力条件,夏季较低的DO背景值为潜在低氧的形成提供了不利条件.
DO作为反映物理化学生物过程的综合指标,其与DOs的差值被定义为表观耗氧量(AOU)[7,17,25].因为它综合考虑了温度和盐度等自然因素造成的DO背景差异,是最直接表征氧消耗的定量指标.因此,基于饱和与实测DO计算AOU发现,冬、夏季AOU分别处在0~2.1和0~4.6mg/L之间变动.这表明相比冬季,春夏季相对活跃的河流生命力增大了DO的消耗利用.更重要地是,尽管下游水温、Cl-浓度高,造成DOs即DO背景值偏低,但从上游到下游AOU值仍然逐渐增大,并且最大值达到4.8mg/L,表明研究区下游是氧消耗的核心区,并在流域尺度形成氧亏缺热点.以往研究表明,AOU与营养盐浓度有明显的相关性.因此,研究区在经历从草地、林地向城镇用地转变的过程中,氮的浓度和环境行为能够有助于我们更好地理解河流中耗氧热点的形成机制,以及水柱中氮的生化过程和程度在低氧热点形成、发展、维持和消亡过程中所起的作用.
2.2 河流氮环境行为
在感潮河段,淡水下泄和咸潮入侵造成的复杂水动力条件,为物质的环境行为带来更多变异性和复杂性.特别是氮作为河流水生态系统的基础生源要素,硝化过程在流域氮循环过程中是关联DO消耗和氧亏缺形成的重要机制,而复杂水动力条件为其定性定量解读带来难度.
2.2.1 氮的混合行为 研究区不同形态氮浓度时空特点如图2所示.硝态氮与亚硝态氮浓度变化呈现一致性,即丰水期硝态氮与亚硝态氮浓度均值(2.08mg/L和0.11mg/L)均高于枯水期浓度均值(1.71mg/L和0.08mg/L),同时从上游到下游硝态氮与亚硝态氮浓度分别从0.53mg/L和0.01mg/L逐渐升高到4.13mg/L和0.37mg/L.然而,氨氮相对特殊,丰水期浓度均值(0.20mg/L)低于枯水期浓度均值(0.30mg/L),且均满足地表水环境质量标准III类及以上.流域DO水平从上游到下游逐渐降低,研究区下游氮浓度的升高可能为耗氧相关的氮周转提供有利条件,使其成为氮周转与氧亏缺关系建立的氮活跃区.由于本研究区毗邻河口,潮汐影响造成下游感潮河段和非感潮河段在水动力上呈现显著的差异.相比非感潮河段,感潮河段受淡水和咸水双向流的影响,并在此发生一定的混合作用.Cl-浓度在下游东莞河网地区形成明显的梯度变化,咸淡水混合流成为该区典型的水动力特征,这意味着在下游氮活跃区必须考虑咸-淡水混合带来的氮环境效应.因此,本研究从物质质量守恒角度,以Cl-为示踪剂,借助水源驱动的端元混合模型[式(5)]估算下游低氧热点区氮素保守混合的浓度大小,以探究氮可能的环境行 为.
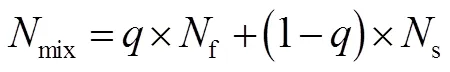
式中:mix为估算的氮保守混合浓度,mg/L;f为淡水端元氮浓度,mg/L;s为咸水端元氮浓度,mg/L;为淡水贡献比.模型估算结果表明,不同时期氮的环境行为存在一定差异(图3).在冬春季,大部分氨氮、硝态氮的实测浓度明显高于水源驱动下的保守混合估算浓度,特别是在春季,氨氮的减量伴随着明显的亚硝态氮和硝态氮增量,表明外源输入和内源转化在野外实际情况中发挥着重要作用(图3),例如硝化作用等内源转化的非保守行为.相比之下,夏季实测不同形态氮浓度与混合估算浓度基本一致,表明氮较少地参与生物地球化学反应而更多地被以混合过程驱动,即夏季氮以“保守”状态存在于河流水环境中.因此,从物质质量守恒角度,氮的生化活性差异将对研究区下游河流DO变化产生响应.
采样点位
图3 下游感潮河网区不同季节不同形态氮浓度实测值与基于端元混合模型的保守混合值之间的关系
Fig.3 Comparison between the measured nitrogen concentrations and conservative-calculated nitrogen concentrations based on the end-member mixing model in the downstream tidal river network during the different seasons
2.2.2 氮的耗氧转化行为 生物地球化学循环中微生物等优先利用轻的同位素参与生物代谢过程,导致生化反应过程中产生同位素效应,该效应可以有效指示生化反应的发生.硝化作用是氮转化中氧消耗的重要过程之一.先前的研究发现,硝化作用中15N-NO3-和18O-NO3-值理论上应当分别在+2‰~+10‰和-10‰~+10‰之间变动, 或者分别低于+13‰和靠近+0‰,并且NO3-浓度与氮氧同位素值呈现负相关性[26–28].在本研究区,冬春季下游河网地区均观测到相对较高的NO3-浓度同时伴随着相对较低的特征15N-NO3-(+5.44‰~+11.77‰)和18O-NO3-(+1.08‰~+7.16‰)信号值,而这一现象和特征信号值在夏季以及上游地区并未发现[图4(a)].这表明冬春季流域下游东莞地区成为发生氨氧化作用生成硝酸盐的主要时区,其他时区则较难观测到.Xuan等[29]的研究也发现在珠江三角洲NH4+硝化生成NO3-的过程中,硝态氮氮、氧同位素信号值分布于+7.8‰~+10.75‰和-2.24‰~+3.92‰,并且该过程主要观测在枯水期.
进一步,有研究还表明硝化作用产NO3-的过程中,1/3个氧原子来自氧气,另外2/3个氧原子来自水,当发生氧交换时甚至仅有1/6个氧原子来自氧气,而5/6个氧原子来自水[30–33].因此,研究基于河流实测18O-H2O和大气18O-O2(-23.5‰[31])值来估算在以上理论情况下硝化作用生成NO3-的18O值,以此来推断研究区是否发生了硝化作用.估算结果表明,冬季从上游到下游,实测18O-NO3-值逐渐向硝化作用特征信号值靠近,同时春季下游18O也分布于硝化作用信号范围内,表明硝化作用在下游河网区逐渐增强.然而,夏季实测18O-NO3-值绝大部分偏离硝化作用信号值,表明硝化作用较难被观察到[图4(b)].与之相对应地,夏季相对低的氨氮浓度和未检出的15N-NH4+信号也共同表明了丰水期由于氨氧化底物匮乏造成硝化作用在流域尺度较难发生.明显的强降雨也为夏季氨氮因降雨稀释,而非硝化作用导致浓度降低提供了有力的证据.此外,夏季15N- NO3-、18O-NO3-与NO3--N浓度之间未建立起相互关系也间接佐证了丰水期硝化作用不活跃.综上所述,从质量守恒和同位素示踪角度可知,冬春季氨氮更明显地参与生物地球化学循环,且下游河网区是发生耗氧硝化作用的核心区,而夏季氨氮则主要体现为水源驱动下的保守混合行为.
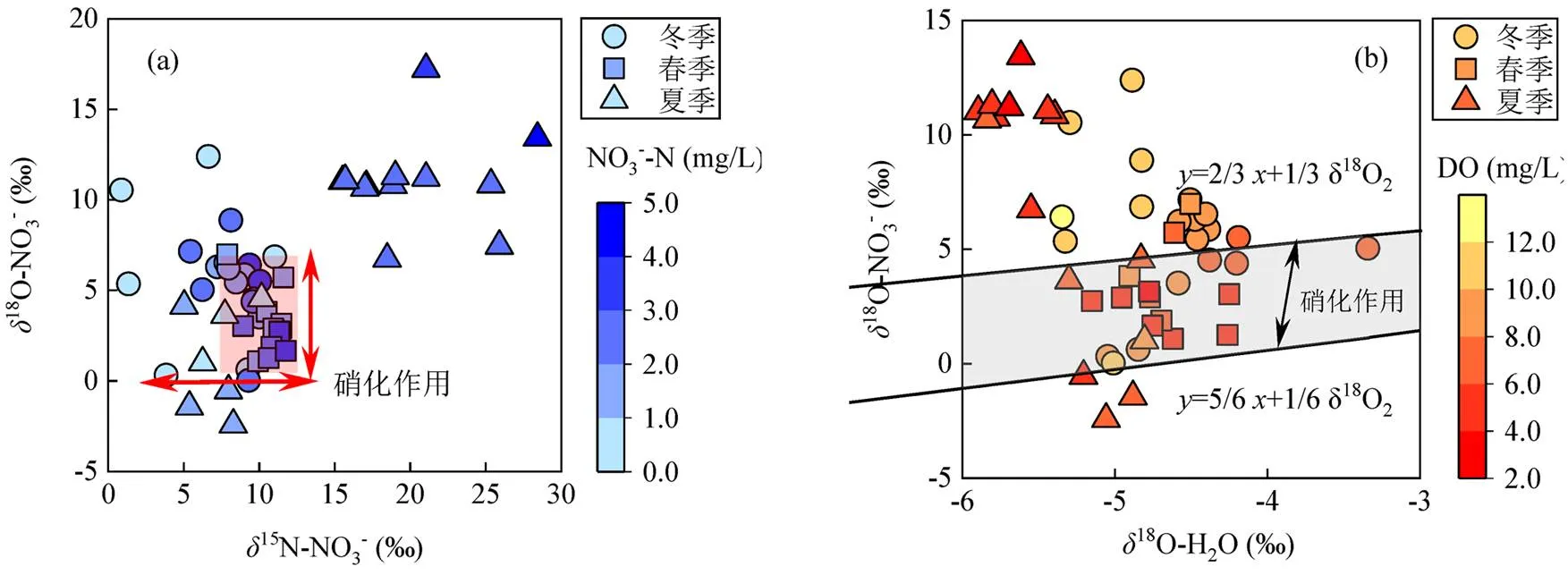
图4 流域地表水δ18O-NO3- vs δ15N-NO3-和δ18O-NO3-vs δ18O-H2O之间的关系
2.3 河流硝化作用耗氧程度的同位素证据
硝化作用是氮生物地球化学循环中最主要的耗氧途径,在流域DO消耗利用中扮演重要角色.因此,量化评估硝化作用发生的程度对于揭示河流氮行为对氧亏缺的限定影响有重要意义.根据之前流域AOU计算结果,在不同季节,下游东莞河网地区都呈现明显的氧消耗利用,最高耗氧量达到4.8mg/L.由于下游也是硝化作用的主要发生区,因此重点圈定下游河网区以量化评估氮行为对表观耗氧量的定量贡献.
通常,在硝化作用中以第一步氨氧化作用为主要限速和耗氧步骤,同时氮同位素会发生特定的分馏效应,为该过程的量化提供可行手段.根据先前在珠江三角洲进行的野外实地研究结果,春夏季和冬季氨氧化作用的15N分馏系数分别为-15.3‰和-23.7‰[21].假设氨氧化是氨氮的主要“汇”,通过瑞利分馏模型(公式6)可量化估算水柱中该过程发生的程度或比例.
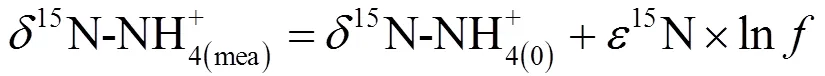
式中:15N-NH4+(mea)和15N-NH4+(0)分别为实测和初始15N-NH4+值,‰;15N为氨氧化过程15N富集因子;为反应剩余比.由于下游河网区受潮汐影响明显,因此上游淡水和滨海咸水混合成为该区域的主要水动力特点,并且也成为氮开始参与生物地球化学循环的重要初始条件.基于该情景,以惠州地区D10和D11断面为淡水输入端元,以内河口虎门大桥断面为咸水输入端元,淡咸水端元同位素保守混合值也成为反应重点区开始发生硝化反应的初始15N-NH4+值.因此,本研究基于浓度加权的同位素端元混合模型(公式7)来估算生化反应的初始条件.
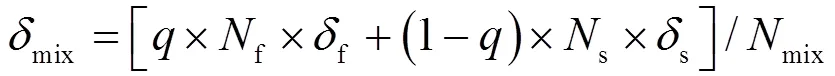
式中:mix为同位素保守混合估算值, ‰;f、f为淡水端元氨氮浓度和同位素特征值,mg/L和‰;s、s为咸水端元氨氮浓度和同位素特征值,mg/L和‰,其中咸水端元15N-NH4+值参考文献调研结果分别为+21‰(冬季)和+6‰(春季)[17,21];为淡水的贡献比.
基于以上情景及模型模拟,结果表明在冬季和春季保守混合15N-NH4+值即初始15N-NH4+值分别为(+19.82±0.59)‰和(-1.72±1.68)‰.因此,根据氨氮富集因子和初始15N-NH4+值,通过瑞利函数计算15N分馏的程度也即硝化反应程度.结果显示冬季和春季氨氧化程度分别为0%~28%和1.6%~ 77.3%,均值分别为14.4%和32.3%,表明在易发生硝化作用的时区,氨氮并非完全参与硝化反应,也仅部分氨氮发生向硝氮的迁移转化.尽管如此,部分程度的硝化作用也造成一定程度的河流DO被消耗利用.根据硝化反应化学计量方程式,1mol NH4+-N的氧化过程中,需要消耗1.5mol的O2.因此,在东江下游低氧河网区,氨氮氧化将消耗大约0~0.39mg/L的DO,最大约占表观耗氧量的0%~18.8%.在冬季和春季AOU中,平均7.5%和5.9%的氧消耗利用上限来自氨氧化耗氧(图5).这表明氮的环境行为在感潮河流出现的低DO现象中发挥了一定的作用,但该作用影响具有一定的局限性,可能还存在其他导致DO消耗的主导因素,例如有机碳的生物降解耗氧,以及天然因素造成的低氧现象.这也为当前环境管理多通过氨氮浓度的达标情况来研判DO能否达标的局限认识带来新的见解,也为探索研究建立分区域、分流域的DO评价和考核体系提供技术支撑.
3 结论
3.1 河流DO浓度在2.96~11.47mg/L之间变动,遵循着冬季高、夏季低的动力学特征,并在夏季下游河网区形成明显的低氧热点.水温和Cl-浓度的时空变化一方面提高了冬季DO背景值,为缓冲氧亏缺提供了有力条件,另一方面降低了春夏季DO背景值,为潜在低氧的形成增加了概率.
3.2 在时间尺度上,冬春季氨氮浓度高于夏季,冬春季硝态氮和亚硝态氮浓度低于夏季.在空间尺度上,下游河网区成为氮浓度累积与转化的关键区.基于端元混合模型的模拟结果表明,冬春季氮更多地体现出非保守行为,而夏季氮主要以水文过程驱动的“保守”混合状态存在于河流水环境中.
3.3 冬春季下游感潮河网区是氮同位素发生硝化作用分馏的主要时区.基于同位素瑞利分馏模型,冬、春季硝化反应程度分别为14.4%和32.3%,这也分别对应着冬、春季最大约7.5%和5.9%的DO消耗利用来自氨氧化耗氧.氮的环境行为对河流DO的影响相对局限,特别是夏季氧亏缺问题更多地受其他因素的主导.
[1] Keister J E, Tuttle L B. Effects of bottom-layer hypoxia on spatial distributions and community structure of mesozooplankton in a sub-estuary of Puget Sound, Washington, U.S.A [J]. Limnology & Oceanography, 2013,58(2):667–680.
[2] Froehlich H, Hennessey S, Essington T, et al. Spatial and temporal variation in nearshore macrofaunal community structure in a seasonally hypoxic estuary [J]. Marine Ecology Progress Series, 2015, 520:67–83.
[3] Yin K, Lin Z, Ke Z. Temporal and spatial distribution of dissolved oxygen in the Pearl River Estuary and adjacent coastal waters [J]. Continental Shelf Research, 2004,24(16):1935–1948.
[4] Turner R E, Rabalais N N, Swenson E M, et al. Summer hypoxia in the Northern Gulf of Mexico and its prediction from 1978 to 1995 [J]. Marine Environmental Research, 2005,59(1):65–77.
[5] Obenour D R, Scavia D, Rabalais N N, et al. Retrospective analysis of midsummer hypoxic area and volume in the Northern Gulf of Mexico, 1985~2011 [J]. Environmental Science & Technology, 2013,47(17): 9808–9815.
[6] Murphy R R, Kemp W M, Ball W P. Long-term trends in Chesapeake Bay seasonal hypoxia, stratification, and nutrient loading [J]. Estuaries and Coasts, 2011,34(6):1293–1309.
[7] Chi L, Song X, Yuan Y, et al. Distribution and key influential factors of dissolved oxygen off the Changjiang River Estuary (CRE) and its adjacent waters in China [J]. Marine Pollution Bulletin, 2017,125(1): 440–450.
[8] 史海鑫.闽江下游低溶解氧成因研究[D]. 福州:福州大学, 2013. Shi H X. Research on the causes of low dissolved oxygen in the downstream of Minjiang River [D]. Fuzhou: Fuzhou University, 2013.
[9] 张 洪,林 超,雷 沛,等.海河流域河流耗氧污染变化趋势及氧亏分布研究[J]. 环境科学学报, 2015,35(8):2324–2335. Zhang H, Lin C, Lei P, et al. Trends of pollution by the oxygen- consuming substances and the distribution of oxygen deficiency in the Haihe River Basin [J].Acta Scientiae Circumstantiae, 2015,35(8): 2324–2335.
[10] 黄炜惠,马春子,李文攀,等.我国地表水溶解氧时空变化及其对全球变暖的响应[J]. 环境科学学报, 2021,41(5):1970–1980. Hang W H, Ma C Z, Li W P, et al. Spatial-temporal variations of dissolved oxygen and their response to global warming in China [J]. Acta Scientiae Circumstantiae, 2021,41(5):1970–1980.
[11] Li W, Fang H, Qin G, et al. Concentration estimation of dissolved oxygen in Pearl River Basin using input variable selection and machine learning techniques [J]. Science of the Total Environment, 2020,731:139099.
[12] Dai M, Guo X, Zhai W, et al. Oxygen depletion in the upper reach of the Pearl River estuary during a winter drought [J]. Marine Chemistry, 2006,102(1):159–169.
[13] Bianchi T S, DiMarco S F, Cowan J H, et al. The science of hypoxia in the Northern Gulf of Mexico: A review [J]. Science of the Total Environment, 2010,408(7):1471–1484.
[14] He B, Dai M, Zhai W, et al. Hypoxia in the upper reaches of the Pearl River Estuary and its maintenance mechanisms: A synthesis based on multiple year observations during 2000~2008 [J]. Marine Chemistry, 2014,167:13–24.
[15] Su J, Dai M, He B, et al. Tracing the origin of the oxygen-consuming organic matter in the hypoxic zone in a large eutrophic estuary: the lower reach of the Pearl River Estuary, China [J]. Biogeosciences, Copernicus GmbH, 2017,14(18):4085–4099.
[16] Li X, Lu C, Zhang Y, et al. Low dissolved oxygen in the Pearl River estuary in summer: Long-term spatio-temporal patterns, trends, and regulating factors [J]. Marine Pollution Bulletin, 2020,151:110814.
[17] Ye F, Jia G, Wei G, et al. A multi-stable isotopic constraint on water column oxygen sinks in the Pearl River Estuary, South China [J]. Marine Environmental Research, 2022,178:105643.
[18] EPA. Process design manual for nitrogen removal, EPA/625/R-93/010. [M]. Washington, DC, U.S.: Environmental Protection Agency, 1993:88.
[19] Xuan Y, Mai Y, Xu Y, et al. Enhanced microbial nitrification- denitrification processes in a subtropical metropolitan river network [J]. Water Research, 2022,222:118857.
[20] Casciotti K L, Sigman D M, Ward B B. Linking diversity and stable isotope fractionation in ammonia-oxidizing bacteria [J]. Geomicrobiology Journal, 2003,20(4):335–353.
[21] Ye F, Jia G, Xie L, et al. Isotope constraints on seasonal dynamics of dissolved and particulate N in the Pearl River Estuary, South China [J]. Journal of Geophysical Research, 2016,121:8689–8705.
[22] Liu D, Fang Y, Tu Y, et al. Chemical method for nitrogen isotopic analysis of ammonium at natural abundance [J]. Analytical Chemistry, 2014,86(8):3787–3792.
[23] Sigman D M, Casciotti K L, Andreani M, et al. A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater [J]. Analytical Chemistry, 2001,73(17):4145–4153.
[24] 华鹤松.水中饱和溶解氧的理论关系式[J]. 环境科学, 1984,(6): 62–65. Hua H S. Theoretical formula of saturated dissolved oxygen in water [J]. Environmental Science, 1984,(6):62–65.
[25] 刘鹏霞,刘子洲,翟方国,等.山东半岛东部近海海水溶解氧时空变化[J]. 海洋科学, 2021,45(7):66–80. Liu P X, Liu Z Z, Zhai F G, et al. Temporal-spatial variations in dissolved oxygen in the eastern coastal area of the Shandong Peninsula [J]. Marine Sciences, 2021,45(7):66–80.
[26] Lohse K A, Sanderman J, Amundson R. Identifying sources and processes influencing nitrogen export to a small stream using dual isotopes of nitrate [J]. Water Resources Research, 2013,49(9):5715– 5731.
[27] Kelley C J, Keller C K, Evans R D, et al. Nitrate–nitrogen and oxygen isotope ratios for identification of nitrate sources and dominant nitrogen cycle processes in a tile-drained dryland agricultural field [J]. Soil Biology and Biochemistry, 2013,57:731–738.
[28] Yue F J, Liu C Q, Li S L, et al. Analysis of δ15N and δ18O to identify nitrate sources and transformations in Songhua River, Northeast China [J]. Journal of Hydrology, 2014,519:329–339.
[29] Xuan Y, Tang C, Cao Y. Mechanisms of nitrate accumulation in highly urbanized rivers: Evidence from multi-isotopes in the Pearl River Delta, China [J]. Journal of Hydrology, 2020,587:124924.
[30] Kendall C, Elliott E M, Wankel S D. Tracing anthropogenic inputs of nitrogen to ecosystems [M]. Blackwell, 2007.
[31] Xue D, Botte J, De Baets B, et al. Present limitations and future prospects of stable isotope methods for nitrate source identification in surface- and groundwater [J]. Water Research, 2009,43(5):1159–1170.
[32] Kool D M, Wrage N, Oenema O, et al. Oxygen exchange with water alters the oxygen isotopic signature of nitrate in soil ecosystems [J]. Soil Biology and Biochemistry, 2011,43(6):1180–1185.
[33] Sigman D M, DiFiore P J, Hain M P, et al. The dual isotopes of deep nitrate as a constraint on the cycle and budget of oceanic fixed nitrogen [J]. Deep Sea Research Part I: Oceanographic Research Papers, 2009,56(9):1419–1439.
Constraint of nitrogen behavior on dissolved oxygen deficit in the tidal river.
WEN jing, HUANG Bang-jie, HUANG Zhi-wei, FANG Huai-yang, WANG Long-le, ZHANG Ying-min, ZENG Fan-tang, DU Hong-wei*
(Guangdong Key Laboratory of Water and Air Pollution Control, National Key Laboratory of Water Environment Simulation and Pollution Control, South China Institute of Environmental Science, Ministry of Ecology and Environment, Guangzhou 510535, China)., 2023,43(8):4003~4012
The Dongjiang River basin was selected as the study area to monitor the spatio-temporal variations in dissolved oxygen (DO), nitrogen concentration and multi-isotope in the basin, so as to provide a better understanding for the quantitative contribution of nitrogen turnover processes to DO depletion. The DO concentrations ranged from 2.96mg/L to 11.47mg/L in the Dongjiang River. In the spring and summer, the downstream of the river became the low DO hot spot, where the highest value in the apparent oxygen utilization (AOU) was up to 4.8mg/L, and a high correlation between water temperature and Cl-concentration and AOU was observed. However, the accumulation of different nitrogen species and15N fractionation of nitrification mainly occurred in the downstream river network area in the winter and spring. Based on the end-members mixing model and isotope Rayleigh fractionation model, it was found that nitrogen mainly reflected the conservative mixing driven by hydrological process in the summer whereas nitrogen prone to occur nitrification in the downstream in the winter and spring. The degree of nitrification reached 14.4% and 32.3% in the winter and spring, respectively, which also corresponded to about 7.5% and 5.9% of AOU in maximum, respectively. Therefore, there were certain limitations in the contribution of nitrogen behavior to the low DO in tidal river. Especially, the oxygen deficit in the summer might be dominated by other factors. Our results will provide a new insight into the limitations of current environmental management pattern in judging whether DO will satisfy the water quality standard through the concentration of ammonia nitrogen, and will also provide a support for exploring and establishing the DO assessment systems focused on distinguishing different regions and watersheds.
the tidal river;dissolved oxygen deficit;contribution of nitrogen turnover to oxygen deficit;nitrogen and oxygen multi-isotope
X523
A
1000-6923(2023)08-4003-10
温 婧(1988-),女,甘肃天水人,助理研究员,博士,主要从事流域水文地球化学和同位素示踪技术研究.发表论文8篇. hengwj0326@126.com.
温 婧,黄邦杰,黄志伟,等.感潮河流氮行为对溶解氧亏损的限定影响 [J]. 中国环境科学, 2023,43(8):4003-4012.
Wen J, Huang B J, Huang Z W, et al. Constraint of nitrogen behavior on dissolved oxygen deficit in the tidal river [J]. China Environmental Science, 2023,43(8):4003-4012.
2023-01-05
广东省重点领域研发计划项目(2020B1111350001);中央级公益性科研院所基本科研业务专项(PM-zx703-202104-082);广州市基础研究计划基础与应用基础研究项目(2023A04J0950)
* 责任作者, 正高级工程师, duhongwei@scies.org
——以莲花县为例

