TGFβR1介导TGF-β/Smad信号通路对绵羊颗粒细胞功能的影响
李悦欣,刘爱菊,马晓菲,郑 忠,胡伯欣,智云霞,田树军*
(1.河北农业大学动物科技学院,保定 071000;2.沧州职业技术学院农牧工程系,沧州 061000)
绵羊的排卵数/胎产羔数与卵泡的生长发育和闭锁密切相关[1],颗粒细胞作为卵泡内数量最多、比例最大以及功能最全的细胞群,其增殖、凋亡、分化和激素生成等对卵泡生长发育及卵泡闭锁至关重要[2-3]。本课题组最新研究发现,TGF-β信号通路在具有高繁殖力的绵羊卵泡内发挥正调控作用[4]。TGFβR1作为TGF-β信号通路的核心信号分子,是否通过介导TGF-β/Smad分支信号通路调控绵羊卵泡内颗粒细胞的功能,目前尚不清楚。
TGF-β/Smad是TGF-β信号通路的一个重要分支,其中磷酸化的TGFβ受体活性因子(TGFβR1)作为核心信号分子,会依次与SMAD2/3结合并将其活化,共同与SMAD4结合后调控下游基因的表达。在小鼠和猪等哺乳动物的卵巢颗粒细胞中,TGF-β信号通路的激活可促进颗粒细胞增殖[5-7],而失活则会导致颗粒细胞凋亡和卵泡闭锁[8-10]。Zhang等[11]研究表明,TGFβR1和SMAD3的表达受到阻碍时,导致猪颗粒细胞的生长和分化减少,并致使细胞凋亡。现有研究发现,SMAD3基因敲除会导致大鼠雌激素产生减少和颗粒细胞凋亡增加[12]。Yu和Liu[13]的研究发现,SMAD2是miR-30d-5p的靶基因,SMAD2过表达增强了大鼠卵巢颗粒细胞增殖并抑制了细胞凋亡。SMAD4是细胞核中TGF-β信号通路的介体和效应器,调节众多细胞过程,包括细胞增殖、分化、自身免疫、多能性和可塑性以及细胞生长、凋亡、自噬、侵袭和转移[14-17]。SMAD4失调与胚胎、骨骼肌分化缺陷、干细胞丢失、神经系统发育障碍和延迟、女性不育和其他疾病有关[18-22]。
为此,本试验拟构建pcDNA3.1(+)-TGFβR1和pcDNA3.1(+)-SMAD4过表达质粒载体及shRNA-TGFβR1和shRNA-SMAD4干扰表达质粒载体,对绵羊颗粒细胞中TGFβR1和SMAD4基因分别进行过表达和干扰,利用CCK-8细胞增殖检测、流式细胞术、Annexin-V FITC/PI双染技术检测绵羊颗粒细胞增殖、周期及凋亡功能,并结合Real-Time PCR及Western blot检测TGFβR1、SMAD4的mRNA水平和TGF-β/Smad信号通路中TGFβR1、SMAD2/3等的磷酸化水平,探究TGFβR1、SMAD4对颗粒细胞增殖、凋亡、周期及TGF-β信号通路的影响,进而揭示TGFβR1介导TGF-β/Smad信号通路调控绵羊卵泡内颗粒细胞功能的机制。
1 材料与方法
1.1 试验材料
1.1.1 绵羊卵巢 从河北省保定市唐县屠宰场采集绵羊卵巢,将其放入加有1%双抗的37 ℃生理盐水中,于3 h内运回实验室。
1.1.2 主要试剂 胎牛血清、胰酶、双抗、0.25% Tripsin-EDTA均购自Gibco公司;DME/F-12、PBS购自Hyclone公司;TRIzol®Plus RNA Purification Kit购自Invitrogen公司;RNase-Free DNase Set购自Qiagen公司;SuperScriptTMIII First-Strand Synthesis SuperMix for qRT-PCR、Power SYBR®Green PCR Master Mix购自Roche公司;30%丙烯酰胺溶液购自Bio-Rad公司;PVDF转印膜购自Millipore公司;ECL DualVue WB Marker购自GE公司;SuperSignal West Dura Extended Duration Substrate购自Thermo Pierce公司;X-ray film购自华东医药;细胞周期检测试剂盒购自碧云天生物技术公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自江苏凯基生物。
1.1.3 主要仪器设备 二氧化碳培养箱购自Thermo Fisher公司;Quantstudio多重实时荧光定量PCR仪购自美国life technologies公司;Mini-PROTEAN电泳系统、Mini Trans-Blot转印系统购自美国Bio-Rad公司;流式细胞仪购自美国 Becton-Dickinson FACS Calibur公司。
1.2 试验方法
1.2.1 颗粒细胞采集及培养 剪下屠宰绵羊的卵巢,用75%酒精喷洗,放于37 ℃灭菌生理盐水(含双抗)的保温瓶中,于4 h内回到实验室,进行颗粒细胞采集。采用预热37 ℃的生理盐水冲洗卵巢,使用灭菌剪刀剪掉卵巢周围系膜,生理盐水反复冲洗至干净,在DME/F-12培养基(含10%胎牛血清)中用无菌刀片划破3~7 mm的卵泡,将卵泡液和培养基混合液转移至离心管(10 mL)中,1 500 r·min-1离心8 min,弃上清,PBS清洗两次,加入DME/F-12培养基(含10%胎牛血清)吹打混匀后接种于培养皿中,置于37 ℃,50 mL·L-1CO2培养箱中培养。参照韩红叶[23]的方法对颗粒细胞进行免疫荧光鉴定。
1.2.2 pcDNA3.1(+)-TGFβR1和pcDNA3.1(+)-SMAD4真核表达载体的构建 使用NheI和Hind III两个限制性内切酶对pcDNA3.1质粒载体进行双酶切线性化处理,并通过琼脂糖凝胶电泳检测酶切产物,切胶回收线性化的pcDNA3.1载体。通过PCR扩增获取TGFβR1和SMAD4基因的目的片段,引物由上海桑尼生物合成,TGFβR1与SMAD4引物序列见表1。PCR扩增程序:95 ℃ 3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,29个循环;72 ℃ 10 min。胶回收目的片段后进行重组反应,重组反应体系:目的片段1 μL,线性化载体1 μL,2×Super Fusion Mix 5 μL,H2O 3 μL,50 ℃水浴1 h完成重组反应。将重组产物转化至感受态细胞DH5α中,将菌液涂板37 ℃恒温箱培养12 h,挑取单克隆菌落37 ℃摇菌16 h,酶切验证后将阳性菌液送公司测序鉴定。对符合条件的质粒命名为pcDNA3.1(+)-TGFβR1和pcDNA3.1(+)-SMAD4质粒载体(文中简称为pc3.1-TGFβR1和pc3.1-SMAD4),对照组为pcDNA3.1空白载体(文中简称为PC组)。
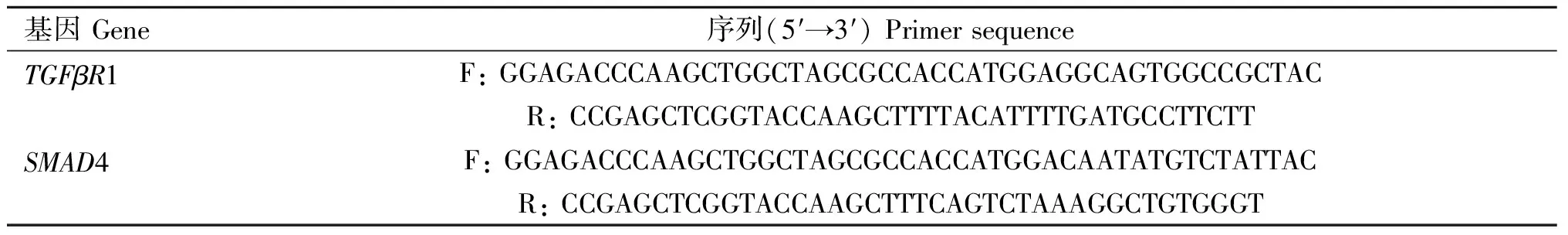
表1 PCR引物序列
1.2.3 shRNA-TGFβR1和shRNA-SMAD4质粒的构建 使用AgeI和EcoR I两个限制性内切酶对pLKO.1质粒进行双酶切线性化处理,并通过琼脂糖凝胶电泳检测酶切产物,切胶回收线性化的pLKO.1载体。TGFβR1和SMAD4的shRNA oligo序列信息见表2。shRNA oligo退火后得到双链shRNA,使用T4连接酶将双链shRNA和线性化的pLKO.1载体进行连接反应,连接反应体系:退火得到的双链DNA片段2 μL,线性化载体1 μL,T4连接酶1 μL,T4 buffer 2 μL,H2O 14 μL,16 ℃反应过夜。将重组产物转化至感受态细胞DH5α中,将菌液涂板37 ℃恒温箱培养12 h,挑取单克隆菌落37 ℃摇菌16 h,酶切验证后将阳性菌液送公司测序鉴定。对符合条件的质粒命名为shRNA-TGFβR1和shRNA-SMAD4质粒载体,对照组为shRNA-NC空白载体。
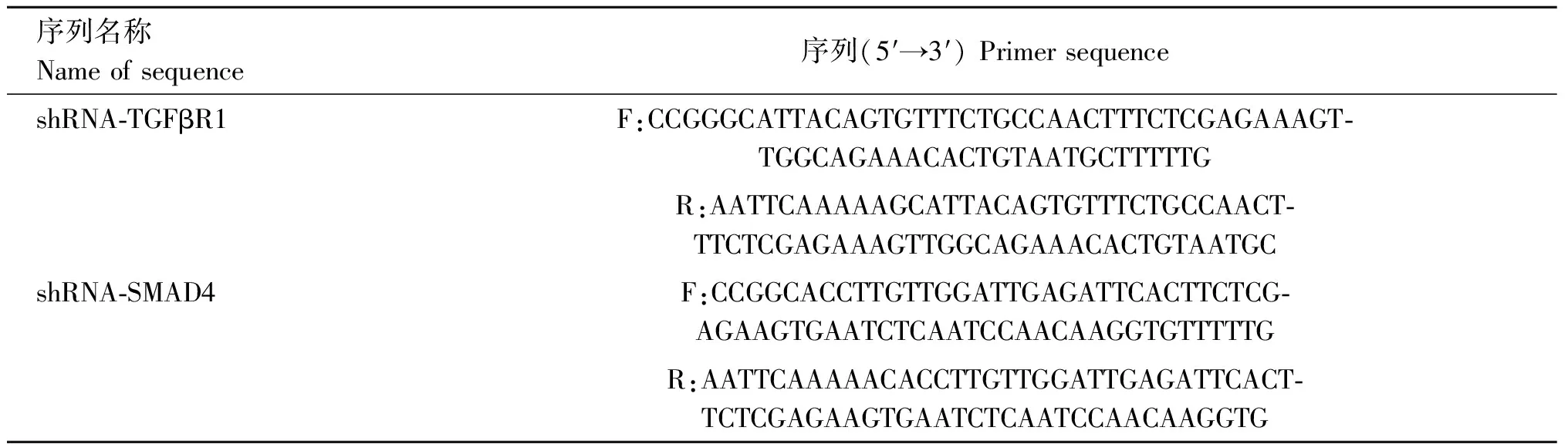
表2 shRNA oligo序列信息
1.2.4 过表达与干扰质粒载体转染 颗粒细胞正常培养达到70%~80%融合度后,胰蛋白酶消化、PBS清洗,完全培养基重悬,以5×105个细胞铺于6孔板中,每个组别3个重复。利用Lipofectamine 3000转染试剂分别将pcDNA3.1(+)-TGFβR1、pcDNA3.1(+)-SMAD4、shRNA-TGFβR1和shRNA-SMAD4质粒转染至绵羊颗粒细胞,参照lipo3000转染说明书进行转染,取两个1.5 mL离心管,分别加入125 μL opti-MEM、5 μL lipo3000试剂和125 μL opti-MEM、2.5 μL质粒、5 μL lipo3000试剂,轻轻混匀,按1∶1轻轻混合两管溶液于室温下孵育10~15 min,将转染溶液添加至6孔板中,在37 ℃培养48 h后收取细胞进行后续试验。
1.2.5 细胞增殖、凋亡及周期的检测 采用CCK-8细胞增殖检测技术对颗粒细胞进行测定,将细胞接种于96孔板中培养24 h,在每孔中加入10 μL CCK-8溶液,置于培养箱中孵育2 h,用酶标仪测定450 nm处的OD值。采用细胞周期检测试剂盒检测颗粒细胞的细胞周期情况,收集处理好的细胞,加入500 μL PI/RNase A染色工作液,室温混匀避光30 min,使用流式细胞仪检测周期情况。采用Annexin-V FITC/PI试剂盒检测颗粒细胞的凋亡情况,在悬浮细胞中加入10 μL Annexin-V FITC和5 μL PI溶液,混匀避光20 min,用流式细胞仪检测细胞凋亡情况。
1.2.6TGFβR1和SMAD4基因表达水平的检测 采用TRIzol法提取颗粒细胞的总RNA,并用cDNA链合成试剂盒得到cDNA,通过Real-Time PCR检测转染后颗粒细胞中TGFβR1和SMAD4的mRNA表达水平,采用Primer Premier 6.0 进行引物设计(表3)。配制20 μL反应体系:Master Mix 10.0 μL,上、下游引物各0.5 μL,cDNA 1.0 μL,ddH2O 8.0 μL。反应条件为:95 ℃ 1 min;95 ℃ 15 s,63 ℃ 25 s,40个循环。每个样品重复3次,各个基因的相对表达水平用2-ΔΔct表示。
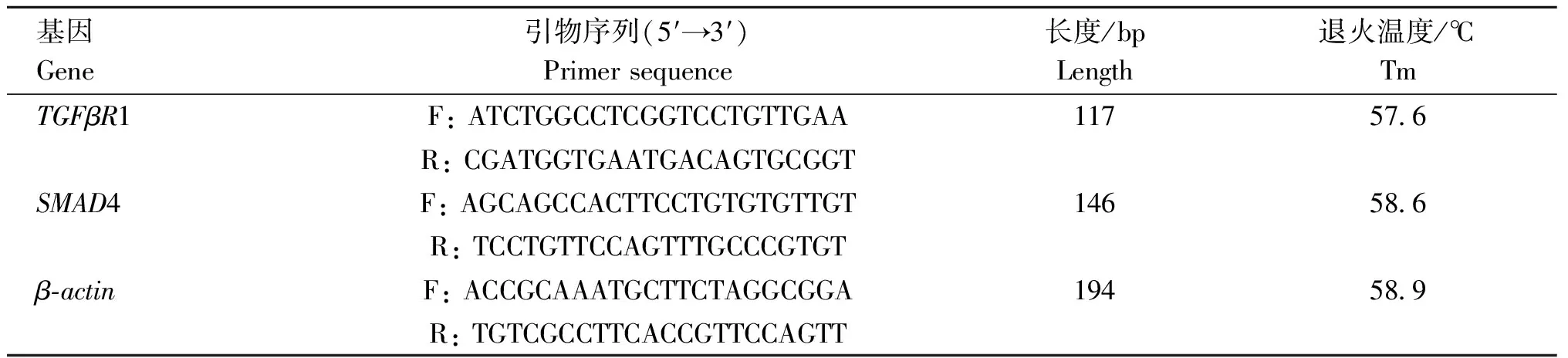
表3 Real-Time PCR的引物序列
1.2.7 蛋白水平的检测 提取颗粒细胞的总蛋白,通过Western blot方法检测TGFβR1、BAX、BCL2、Caspase3、SMAD4、p-TGFβR1、p-TGFβR2、p-SMAD2/3的蛋白水平。做SDS-PAGE电泳分析,电泳结束后进行蛋白质转膜和转印膜封闭后进行一抗杂交,4 ℃孵育过夜,T-TBS漂洗4次,每次5 min;二抗室温孵育1 h,T-TBS漂洗5次,每次5 min;ECL工作液处理后放于成像仪中显色留图,采用Image J软件对蛋白条带进行分析。
1.2.8 统计分析 本试验均重复3次,使用SPSS 26.0软件进行统计学分析,结果均以“平均值±标准差”表示,采用单因素方差分析检验数据的差异显著性,P<0.05表示具有显著性差异,P<0.01表示具有极显著性差异,采用Origin 2021软件进行绘图。
2 结 果
2.1 绵羊卵巢颗粒细胞的鉴定
绵羊卵巢颗粒细胞可特异性表达FSHR蛋白,检测FSHR的存在状况可鉴定颗粒细胞,如图1所示,FSHR在细胞质中表达,经FSHR染色后,细胞的胞浆部分呈绿色荧光,而DAPI染色后细胞核清晰呈现蓝色荧光,通过重叠可直观表现出细胞的细胞核及细胞质的分布区域,显微镜下可见的FSHR表达率>90%,表明分离培养的绵羊颗粒细胞纯度较高,符合后续试验对颗粒细胞的条件要求。

图1 绵羊颗粒细胞FSHR免疫荧光染色情况
2.2 TGFβR1过表达和干扰的转染效率
通过Real-Time PCR及Western blot对转染过表达和干扰TGFβR1载体的颗粒细胞中TGFβR1的表达量进行检测,结果显示(图2A),pc3.1-TGFβR1过表达载体转染颗粒细胞后,TGFβR1的表达量较对照组(PC组)极显著升高(P<0.01),而shRNA-TGFβR1组转染颗粒细胞后,TGFβR1的表达量较shRNA-NC组极显著降低(P<0.01)。通过Western blot方法对转染过表达或干扰TGFβR1载体的颗粒细胞中TGFβR1蛋白表达变化进行检测,结果表明(图2B),过表达TGFβR1会极显著增加其蛋白的表达量(P<0.01),干扰TGFβR1会极显著降低蛋白的表达量(P<0.01)。以上结果表明,TGFβR1过表达载体和干扰载体能够显著改变TGFβR1的表达水平,可用于后续试验。
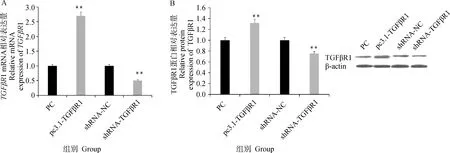
A.TGFβR1 mRNA相对表达量;B.TGFβR1蛋白相对表达量。*.P<0.05;**.P<0.01,下同。过表达组基因相对表达量均按PC=1的标准进行均一化处理;干扰组基因相对表达量均按shRNA-NC=1的标准进行均一化处理。下同
2.3 TGFβR1过表达和干扰对颗粒细胞增殖/周期/凋亡的影响
用CCK-8方法检测转染过表达和干扰TGFβR1载体的颗粒细胞增殖的情况,结果表明(图3A),TGFβR1过表达促进颗粒细胞增殖,TGFβR1干扰较shRNA-NC对照组会抑制颗粒细胞的增殖。细胞周期检测结果显示(图3B),TGFβR1过表达,G0/G1期细胞数量极显著降低,对应S期细胞数量极显著增加(P<0.01),G2/M期细胞数量无显著变化(P>0.05);TGFβR1干扰可极显著降低G0/G1和S期的细胞数量,而G2/M期细胞数量则极显著增加(P<0.01)。通过Annexin-V FITC/PI检测细胞凋亡结果显示(图3C),与PC组对比,TGFβR1过表达可以显著降低颗粒细胞的凋亡数量(P<0.05);与shRNA-NC对照组相比,TGFβR1干扰则显著增加颗粒细胞凋亡数量(P<0.05)。TGFβR1过表达和干扰会影响凋亡蛋白的表达(图3D),TGFβR1过表达会极显著抑制BAX和Caspase3蛋白的表达水平,TGFβR1干扰会极显著抑制BCL2蛋白的表达水平(P<0.01)。
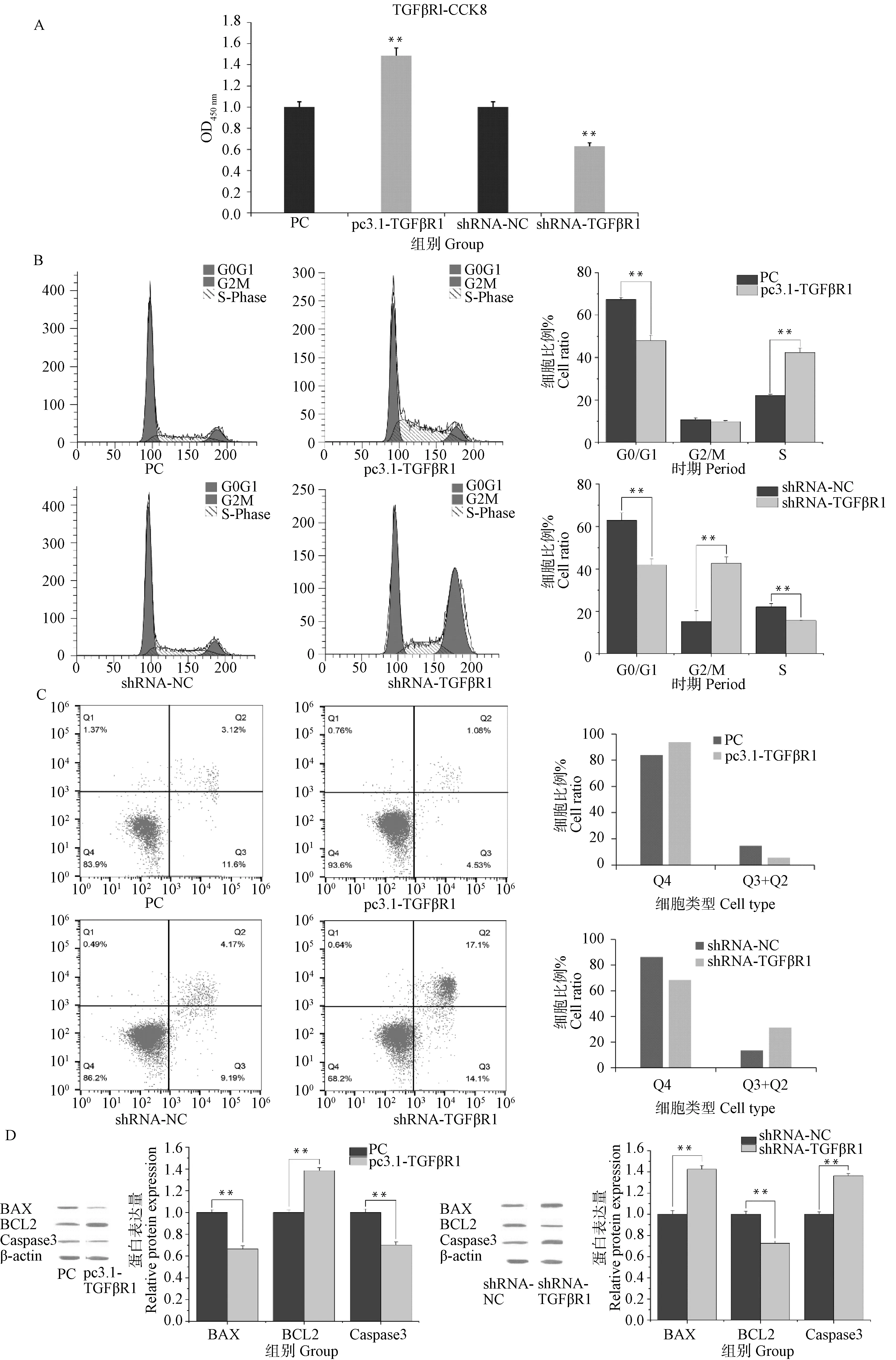
A.TGFβR1过表达/干扰后颗粒细胞CCK-8检测结果;B.TGFβR1过表达/干扰处理后颗粒细胞周期流式检测结果;C.TGFβR1过表达/干扰处理后颗粒细胞凋亡检测结果(Q1.坏死;Q2.凋亡晚期;Q3.凋亡早期;Q4.正常);D.TGFβR1过表达/干扰处理凋亡蛋白BAX、BCL2、Caspase3表达水平检测结果
2.4 SMAD4过表达和干扰的转染效率
通过Real-Time PCR及Western blot对过表达和干扰SMAD4载体的颗粒细胞中SMAD4的表达量进行检测,结果显示(图4A),pc3.1-SMAD4载体转染颗粒细胞后,SMAD4的表达量较对照组(PC组)极显著升高(P<0.01),而shRNA-SMAD4组转染颗粒细胞后,SMAD4的表达量较shRNA-NC组极显著降低(P<0.01)。通过Western blot方法对转染过表达和干扰SMAD4载体的颗粒细胞中SMAD4的蛋白表达变化进行检测,结果表明(图4B),SMAD4过表达会极显著增加其蛋白的表达量(P<0.01),干扰SMAD4极显著降低其蛋白的表达量(P<0.01)。以上结果表明,SMAD4过表达载体和干扰载体能够显著改变SMAD4的表达水平,均可用于后续试验。
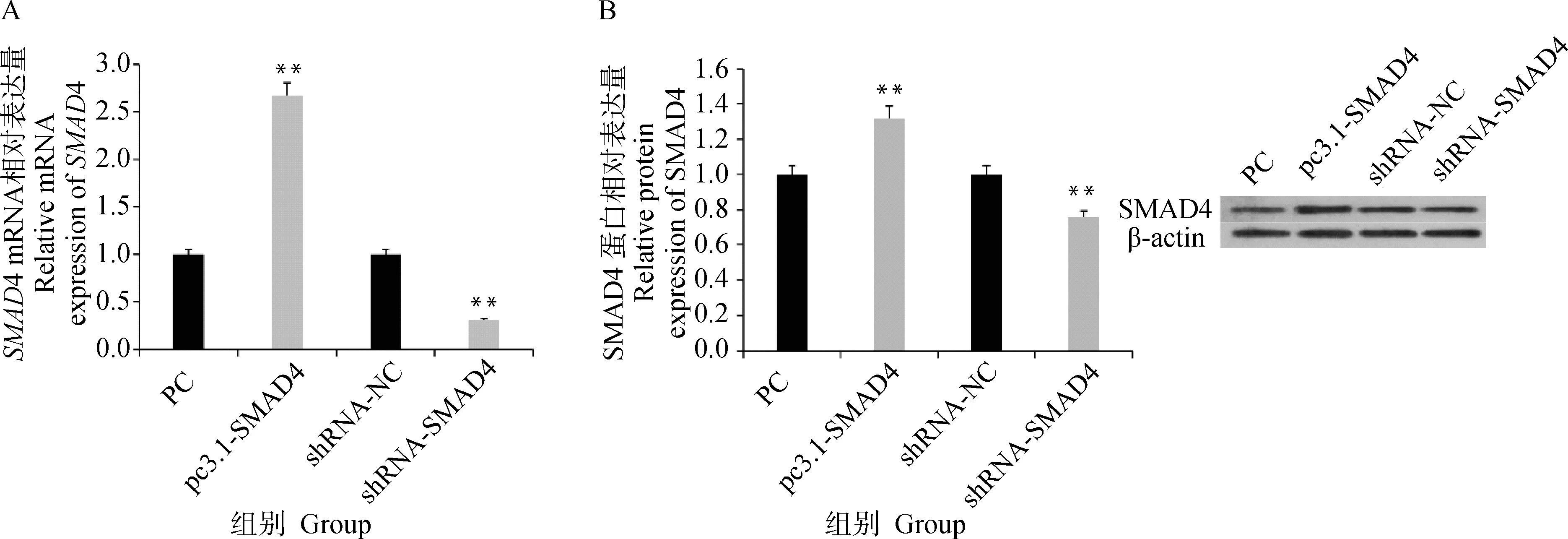
A.SMAD4 mRNA相对表达量;B.SMAD4蛋白相对表达量
2.5 SMAD4过表达和干扰对颗粒细胞增殖/周期/凋亡的影响
通过CCK-8方法检测转染过表达和干扰SMAD4载体的颗粒细胞增殖的情况(图5A),SMAD4过表达可极显著促进颗粒细胞的增殖(P<0.01),干扰SMAD4可极显著抑制颗粒细胞的增殖(P<0.01)。细胞周期检测结果显示(图5B),SMAD4过表达,G0/G1期的细胞数量极显著下降(P<0.01),G2/M期细胞数量显著降低(P<0.05),而S期细胞数量则极显著增加(P<0.01);干扰SMAD4后的颗粒细胞,G0/G1期的细胞数量极显著下降,G2/M期和S期细胞数量极显著增多(P<0.01)。细胞凋亡检测结果显示(图5C),pc3.1-SMAD4载体转染颗粒细胞后,降低了凋亡细胞比例,对细胞凋亡的抑制具有积极作用;shRNA-SMAD4组转染颗粒细胞后与对照组(shRNA-NC组)相比,细胞凋亡数量有所增多。进一步探究SMAD4对凋亡蛋白表达水平的影响发现(图5D),SMAD4过表达会极显著抑制BAX和Caspase3蛋白的表达,干扰SMAD4会极显著抑制BCL2蛋白的表达(P<0.01)。

A.SMAD4过表达/干扰后颗粒细胞CCK-8检测结果;B.SMAD4过表达/干扰后颗粒细胞周期流式检测结果;C.SMAD4过表达/干扰处理后颗粒细胞凋亡检测结果(Q1.坏死;Q2.凋亡晚期;Q3.凋亡早期;Q4.正常);D.SMAD4过表达/干扰后凋亡蛋白BAX、BCL2、Caspase3的蛋白表达水平检测结果
2.6 TGFβR1过表达和干扰对SMAD4蛋白表达的影响
TGFβR1过表达与干扰载体转染颗粒细胞后发现(图6),TGFβR1过表达会极显著促进SMAD4蛋白的表达(P<0.01),干扰TGFβR1后极显著降低SMAD4蛋白的表达(P<0.01),表明TGFβR1对SMAD4蛋白的表达具有促进作用。
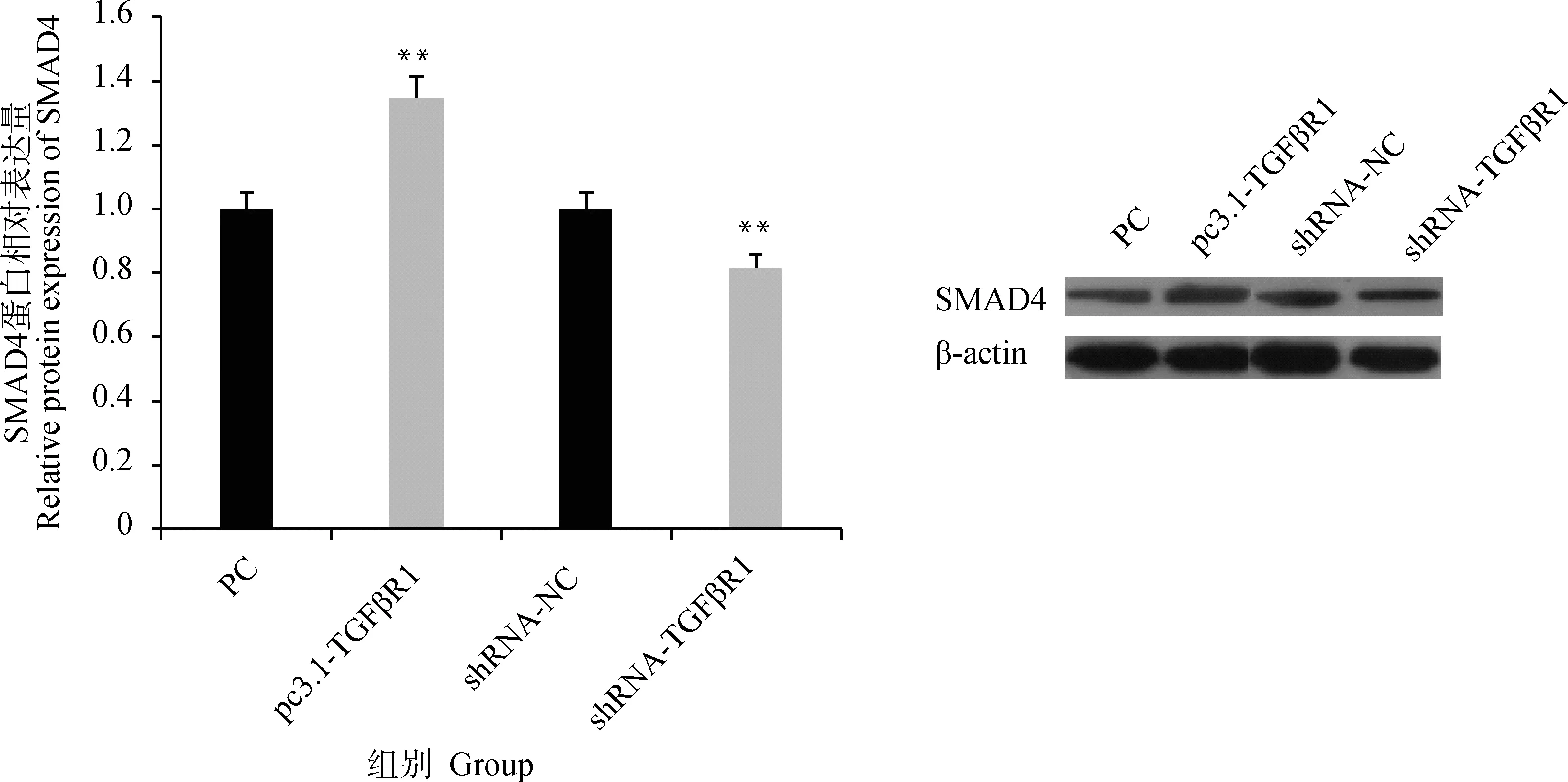
图6 TGFβR1过表达和干扰对SMAD4蛋白表达的影响
2.7 SMAD4过表达和干扰对TGFβR1蛋白表达的影响
SMAD4过表达和干扰载体转染颗粒细胞后,检测TGFβR1蛋白的表达情况发现(图7),SMAD4过表达会极显著增加TGFβR1蛋白的表达(P<0.01),干扰SMAD4极显著降低TGFβR1蛋白的表达(P<0.01)。
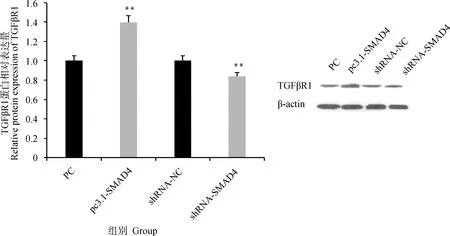
图7 SMAD4过表达和干扰对TGFβR1蛋白表达的影响
2.8 TGFβR1过表达和干扰对TGF-β信号通路蛋白表达的影响
TGFβR1过表达和干扰载体转染颗粒细胞后,检测TGF-β信号通路蛋白(p-TGFβR1、p-TGFβR2、p-SMAD2/3)的表达情况发现(图8),TGFβR1过表达极显著促进了TGFβR1、TGFβR2及SMAD2/3蛋白的磷酸化水平(P<0.01),与此同时,TGFβR1干扰会极显著抑制p-TGFβR1与p-TGFβR2的表达(P<0.01),会降低SMAD2/3的磷酸化水平。
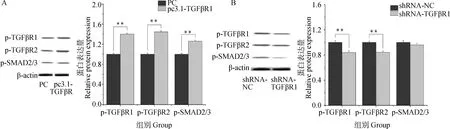
A.TGFβR1过表达后p-TGFβR1、p-TGFβR2、p-SMAD2/3蛋白的相对表达量;B.TGFβR1干扰后p-TGFβR1、p-TGFβR2、p-SMAD2/3蛋白的相对表达量
3 讨 论
绵羊胎产羔数的提升是近年来国内外研究的热点之一。绵羊卵泡发育影响繁殖力的高低,许多研究表明,颗粒细胞的发育状态与卵泡的命运有关。颗粒细胞增殖促进卵泡成熟和排卵,而凋亡导致卵泡闭锁和退化[24],抑制卵巢颗粒细胞凋亡,可促进卵泡发育,提高排卵率和胎产羔数。TGF-β/Smad信号通路在细胞增殖分化、个体发育、软骨发生以及生殖发育、组织创伤修复等过程中都发挥着极其重要的作用[25-26]。本试验探讨了TGFβR1对绵羊颗粒细胞增殖凋亡的作用,并进一步探究TGFβR1如何通过TGF-β/Smad信号通路参与颗粒细胞功能的调控。结果发现,过表达TGFβR1可加快细胞进程进入S期,促进绵羊颗粒细胞增殖,抑制颗粒细胞凋亡,干扰TGFβR1会发生G2/M期阻滞,抑制绵羊颗粒细胞的增殖,促进其凋亡。这些发现与前人的研究结果类似,TGFβR1是TGFβ配体的1型受体[27-28],参与下丘脑-垂体-卵巢轴的调控,促进卵子的发育成熟及黄体形成,参与滋养细胞的增殖、分化[29];TGFβR1还可以介导生长分化因子9(GDF9)的信号,促进颗粒细胞的增殖和人腔前卵泡的生长[30];敲除TGFβR1基因的小鼠能排卵和产生卵母细胞,但会发生胚胎死亡[31],同时还伴随着严重的输卵管畸形[28,32],这些结果显示,TGFβR1会对颗粒细胞的增殖产生促进作用。进一步研究发现,TGFβR1会抑制促凋亡基因BAX和Caspase3的表达,促进抗凋亡基因BCL2的表达。有研究表明,抗凋亡蛋白BCL2和促凋亡蛋白BAX是细胞凋亡的关键调节因子,其主要作用部位是线粒体膜:前者抑制细胞色素c(Cytc)的释放,后者启动Cytc的释放。BCL2蛋白通过调节生殖细胞和体细胞的凋亡,在卵泡生长发育和卵泡闭锁中发挥重要作用。BCL2基因缺陷的小鼠表现出卵母细胞和原始卵泡数量的减少[33],而BCL2的过表达减少了大的有腔卵泡的颗粒细胞凋亡,从而增加卵泡发生,提高排卵率。而BAX在卵母细胞和颗粒细胞中都有表达,缺失BAX基因的小鼠表现出过多的异常卵泡[34]。与正常卵泡相比,闭锁卵泡颗粒细胞中BAX的表达较强[35]。在猪颗粒细胞中,闭锁卵泡BAX的表达高于健康卵泡[24,36]。Caspase家族在介导细胞凋亡的过程中发挥重要作用[37],Caspase3是参与多种凋亡信号转导途径的关键执行分子[38-39],活化的Caspase3会裂解相应的胞浆胞核底物,最终导致细胞凋亡[40]。这些结果表明,TGFβR1通过调控BCL2、BAX和Caspase3基因的表达,参与颗粒细胞的增殖凋亡进程。干扰TGFβR1会抑制TGFβR1、TGFβR2以及SMAD2/3的磷酸化,表明TGF-β信号通路被阻断。SMAD2/3是转化生长因子-β信号转导的核心成分,是转化生长因子-β的信号中间产物,激活的TGFβR1通过磷酸化SMAD2/3(R-Smads)蛋白激活Smad信号通路,磷酸化的R-Smads共同与SMAD4蛋白结合,将信号由胞浆转移至细胞核内,调节靶基因的转录,诱导下游目的基因的表达[11,41]。
由于在TGF-β/Smad信号通路中,TGF-β二聚体结合TGFβR2,并导致TGFβR2自身磷酸化激活,同时将TGFβR1募集到高度保守的近膜区域,之后TGFβR2磷酸化激活TGFβR1并和其之间形成异四聚体复合物,磷酸化的TGFβR1将依次招募SMAD2和SMAD3与其结合将其磷酸化后转为活化状态,将信号传递到胞浆中,SMAD2/3与SMAD4形成异构体复合物,最终将信号由胞浆传递至细胞核中,在细胞核中调节下游基因的表达。SMAD4在该通路中发挥着关键作用,故进一步探究了TGF-β/Smad通路中TGFβR1下游的关键调节因子SMAD4与颗粒细胞功能的关系,研究发现,TGF-β/Smad通路的关键调节因子SMAD4与颗粒细胞的增殖凋亡有密切关系,过表达SMAD4会加快细胞进程进入至S期,促进颗粒细胞的增殖,抑制促凋亡蛋白BAX和Caspase3的表达,促进抗凋亡蛋白BCL2的表达;抑制SMAD4则发生G2/M期阻滞,抑制颗粒细胞增殖,抑制BCL2的表达,促进BAX和Caspase3的表达。SMAD4作为一种常见的TGF-β信号转导介质,被认为在调节卵泡生长和雌性生殖方面发挥了重要作用[9]。敲除卵巢特异性基因SMAD4的小鼠出现生育能力下降,生殖力随着时间的推移而下降,卵泡发生中存在多种缺陷,如严重的卵丘细胞缺陷和颗粒细胞过早黄体化[42]。已有研究发现,腔前颗粒细胞中SMAD4基因的缺失会导致后续卵泡发育和分化的严重缺陷[9]。以上发现证实,TGFβR1介导的TGF-β/Smad通路可以调控绵羊颗粒细胞功能,当SMAD4基因过表达即该信号通路信号传递增强时,可促进绵羊颗粒细胞的增殖,并抑制其凋亡。
4 结 论
TGFβR1促进绵羊颗粒细胞的增殖及周期进程,抑制颗粒细胞凋亡,通过介导TGF-β/Smad信号通路中SMAD2/3及SMAD4的表达正向调控绵羊颗粒细胞的增殖与周期,并负向调控其凋亡。

