褪黑激素对绵羊卵巢颗粒细胞增殖、凋亡、类固醇激素分泌的影响
贺名扬,马钰静,王 泳,杨若晨,刘月琴,张英杰,段春辉
(河北农业大学动物科技学院,保定 071000)
绵羊是短日照动物,季节性繁殖特征明显。前人研究表明MT作为光周期节律因子,其分泌随光照变化呈现春夏低秋冬高、夜间高白昼低的特点,并可调控季节性繁殖动物的卵泡发育、排卵等生殖活动[1-3]。研究发现,MT可通过下丘脑-垂体-性腺轴(hypothalamic-pituitary-ovarian axis,HPO)调控卵泡的发育。埋植MT后,其可通过与下丘脑上的受体结合刺激神经元分泌促性腺激素释放激素,进而提高垂体对非繁殖期母鹿促黄体素(LH)和促卵泡素(FSH)的分泌水平[4]。此外,MT也可通过HPO轴调控卵巢的生理机能。研究表明,MT可提高母羊优势卵泡数及腔前卵泡的生长[5-6];Adriaens等[7]研究发现,MT可以促进小鼠腔前卵泡雄烯二酮和P4的分泌。切除小鼠松果体后,MT分泌的下降,抑制了P4的分泌,促进了E2的分泌[8]。另外,卵泡颗粒细胞分泌的类固醇激素对卵泡生长发育至关重要。研究表明,MT可通过其受体介导MAPK途径调节人类颗粒-黄体细胞分泌P4[9]。以上的研究证明,MT影响了绵羊的季节性繁殖[10],但MT是否通过影响颗粒细胞功能调控卵泡发育有待研究。基于此,本研究通过在绵羊卵巢颗粒细胞体外培养过程中添加MT,探究MT对颗粒细胞增殖与凋亡、激素分泌及相关基因、蛋白表达的影响,以期解析MT调控绵羊繁殖的可能路径。
1 材料与方法
1.1 采集卵巢
绵羊卵巢来自河北省保定市唐县屠宰场,选择1岁龄体重相近、体况良好、来自同一牧场饲养条件相同的20只健康小尾寒羊母羊卵巢,收集后用生理盐水冲洗干净,保存在37 ℃含有青霉素(100 IU·mL-1)和链霉素(100 IU·mL-1)生理盐水的保温瓶中,在2 h内运回实验室。
1.2 颗粒细胞的分离和培养
将采集的卵巢先用75%的酒精冲洗,再用37 ℃预热的DPBS缓冲液清洗,去除表明酒精,之后将卵巢放在盛有37 ℃预热的含10%胎牛血清(FBS)、1%青霉素和链霉素的DMEM/F12培养液中,洗涤2次,以细胞培养液为割卵液,用灭菌刀片将直径为2~3 mm 的卵泡割破,卵泡液收集于10 mL离心管中,吹打后垂直静置10 min,使卵母细胞和其他组织沉淀,吸取上清液转移至另一个10 mL 离心管1 000 r·min-1离心10 min,弃掉上清,再加入含10%FBS、1%青霉素和链霉素的DMEM/F12培养液中使沉淀悬浮并均匀分散,进行离心洗涤(1 000 r·min-1,10 min),此步骤重复3次,使之成为单细胞悬液,用血细胞计数器计数,将颗粒细胞以每孔2×105个的密度接种于细胞培养板中,在37 ℃和5% CO2的环境下培养48 h,24 h更换1次培养液。
1.3 试验设计
将生长状况良好的绵羊颗粒细胞分别添加不同浓度MT(0、10-9、10-8、10-7、10-6mol·L-1)处理48 h检测颗粒细胞增殖活力和凋亡率;以影响颗粒细胞增殖活力和凋亡率最好的添加量组(10-7mol·L-1MT)为试验组,未添加MT为对照组,分析MT对绵羊颗粒细胞凋亡相关基因、类固醇激素分泌、相关受体基因、类固醇合成通路基因和蛋白表达的影响。
1.4 检测指标及方法
1.4.1 细胞增殖活力检测 颗粒细胞培养液中添加不同浓度MT(0、10-9、10-8、10-7、10-6mol·L-1)处理48 h,每个浓度5个重复,每孔加入10 μL CCK-8溶液,温育4 h后,酶标仪450 nm检测细胞吸光度。
1.4.2 细胞凋亡检测 颗粒细胞培养液中添加不同浓度MT(0、10-9、10-8、10-7、10-6mol·L-1)处理48 h,每个浓度5个重复,收集细胞,加70%乙醇4 ℃固定过夜;加入500 μL的Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide固定细胞进行染色,37 ℃避光反应5~15 min;BD Accuri C6流式细胞仪进行流式细胞分析,并使用FlowJo 7.6软件处理数据。
1.4.3 激素及cAMP测定 试验组和对照组颗粒细胞培养48 h,每组3个重复,收集培养液和细胞裂解液的上清,用绵羊ELISA试剂盒检测E2、P4和cAMP浓度,按照生产厂家的规程(江苏晶美生物科技有限公司)进行检测。
1.4.4 基因表达量分析 收集培养后的颗粒细胞用TRIzol法提取总RNA。凝胶电泳检测纯度,分光光度法测定RNA含量。用反转录试剂盒反转录为cDNA。根据NCBI数据库序列信息设计引物(表1),以GAPDH为内参,采用RT-qPCR检测MT对绵羊颗粒细胞中MT1、MT2、凋亡基因BAX、Caspase-3、Bcl-2及调控垂体激素基因LHR、FSHR和类固醇激素基因StAR、CYP11A1、CYP19A1、3β-HSDmRNA表达的影响,采用2^-ΔΔct方法分析数据。
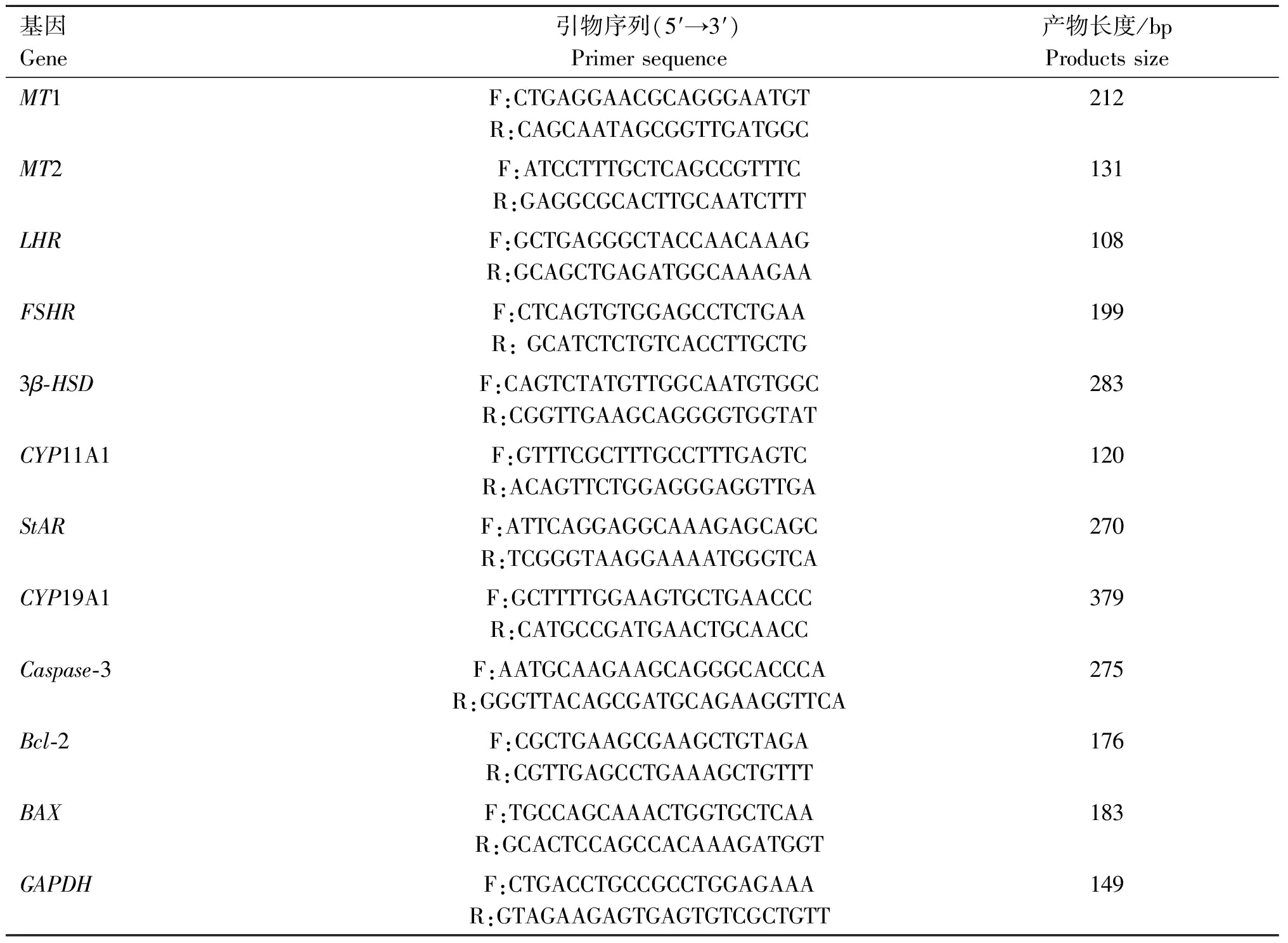
表1 荧光定量PCR引物序列
1.4.5 蛋白表达量检测 收集试验组和对照组培养48 h后的颗粒细胞,提取总蛋白。测定蛋白浓度,SDS变性,将蛋白质用10%聚丙烯酰胺凝胶进行SDS-PAGE。电泳结束后,转移分离胶到NC膜,300 mA恒流,转膜时间以目的蛋白分子大小而定。将膜完全浸没于5%牛奶-TBST中室温轻摇60 min。用5%牛奶-TBST稀释一抗,室温孵育15 min,放4 ℃摇床过夜;二抗室温孵育60 min,放入化学发光仪器,充分滴加发光液曝光后拍照分析灰度值。抗体信息如表2所示。
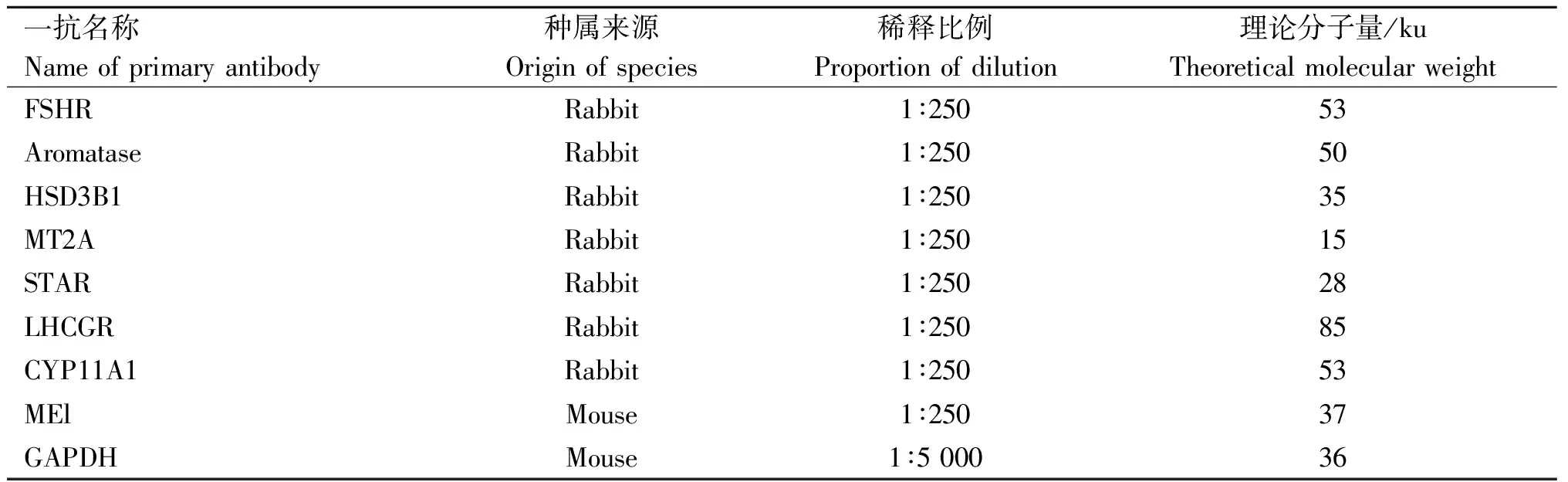
表2 一抗信息
1.5 数据分析
利用SPSS 22.0软件中的独立样本T检验和单因素ANOVA分析数据,用Duncan进行多重比较。数据以“平均值±SEM”表示,P<0.01表示差异极显著,P<0.05表示差异显著。
2 结 果
2.1 MT对绵羊卵巢颗粒细胞增殖和凋亡的影响
采用CCK8检测MT对绵羊卵巢颗粒细胞增殖的影响(图1)。由图1可知,添加MT后各组颗粒细胞的增殖活力均显著高于对照组(NC)(P<0.05)。在MT添加组中,10-6、10-7和 10-8mol·L-1组颗粒细胞增殖活力差异不显著(P>0.05),但显著高于10-9mol·L-1组(P<0.05),其中10-7组细胞活力最高。
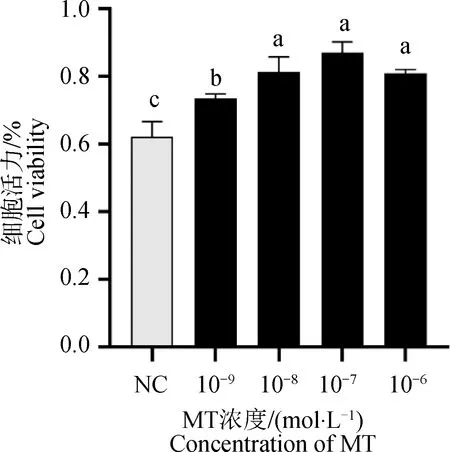
不同字母表示显著差异(P<0.05),相同字母表示差异不显著(P>0.05),下图同
利用Annexin V-FITC检测MT对颗粒细胞凋亡的影响(图2、图3)。图2A、2B、2C、2D和2E分别为对照组和10-6、10-7、10-8、10-9mol·L-1组颗粒细胞凋亡结果,图3A为不同浓度MT对颗粒细胞早期凋亡影响的统计分析,图3B为不同浓度MT对颗粒细胞晚期凋亡影响的统计分析。由图2和图3可知,10-6、10-7、10-8mol·L-1MT处理组颗粒细胞早期凋亡率及晚期凋亡率极显著低于10-9mol·L-1组和对照组(P<0.01),10-6、10-7、10-8mol·L-1MT处理组细胞凋亡率无显著差异(P>0.05),其中10-7组细胞晚期凋亡率最低,10-9mol·L-1组细胞凋亡率与对照组之间无显著差异(P>0.05)。
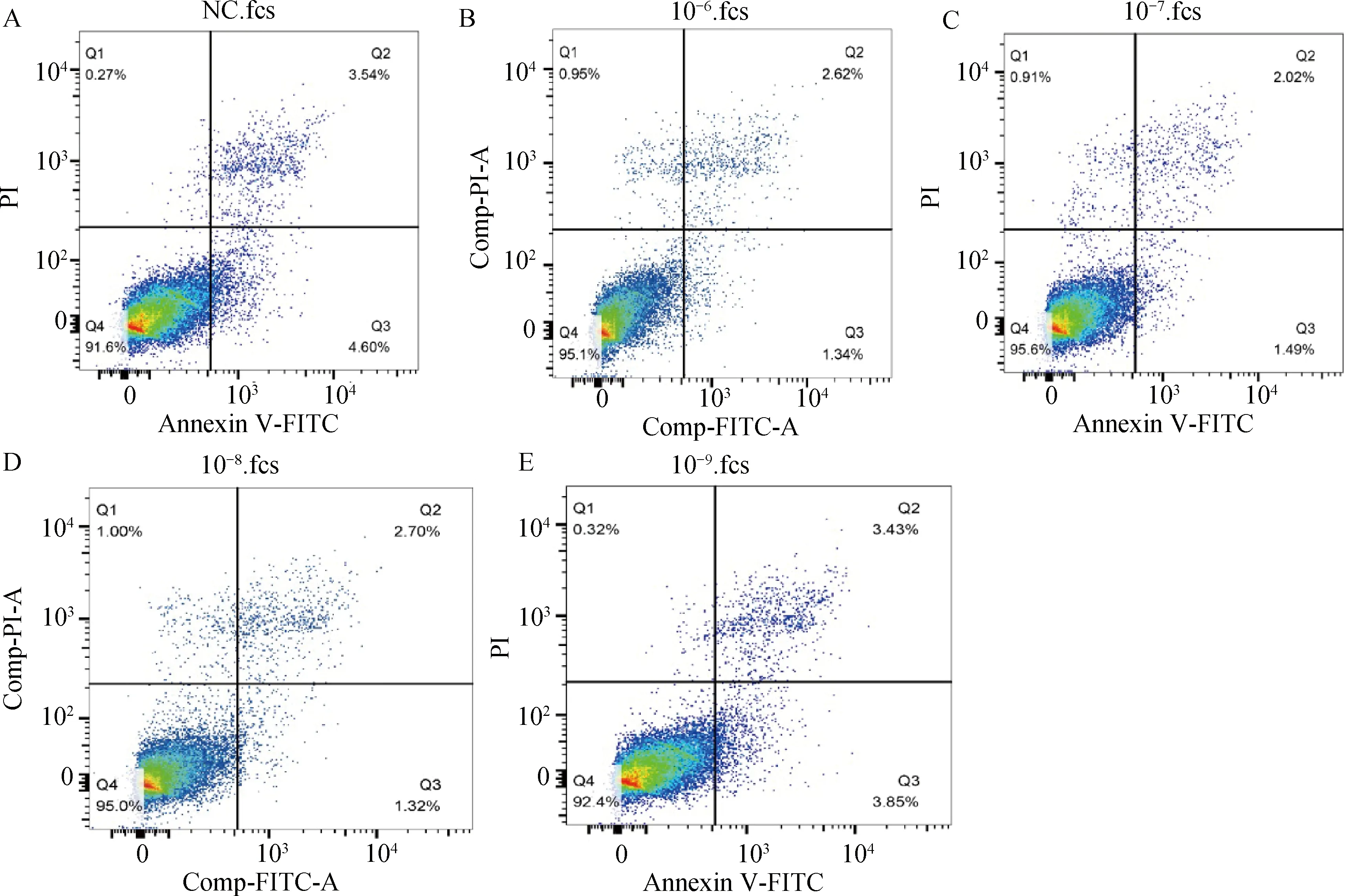
A,B,C,D,E.分别为NC、10-6、10-7、10-8、10-9 mol·L-1 MT对绵羊颗粒细胞凋亡的影响。Q1为机械损伤致死细胞;Q2为晚期凋亡细胞;Q3为早期凋亡细胞;Q4为活细胞。不同颜色代表荧光染色强度,Q1和Q3表示染色结果为单阳,Q2表示双阳,Q4表示未染色
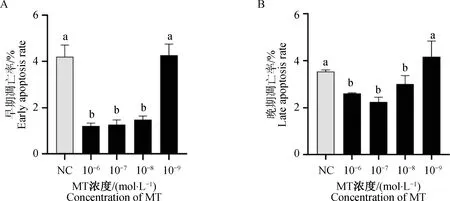
A.MT对绵羊颗粒细胞早期凋亡的影响;B.MT对绵羊颗粒细胞晚期凋亡的影响
2.2 MT对绵羊卵巢颗粒细胞凋亡相关基因表达的影响
利用RT-qPCR检测MT对颗粒细胞凋亡相关基因表达的影响。由图4可知,添加10-7mol·L-1MT处理48 h,显著下调了凋亡基因BAX、Caspase-3及BAX/Bcl-2的表达(P<0.05),显著上调抗凋亡基因Bcl-2的表达(P<0.05),流式凋亡结果相一致。
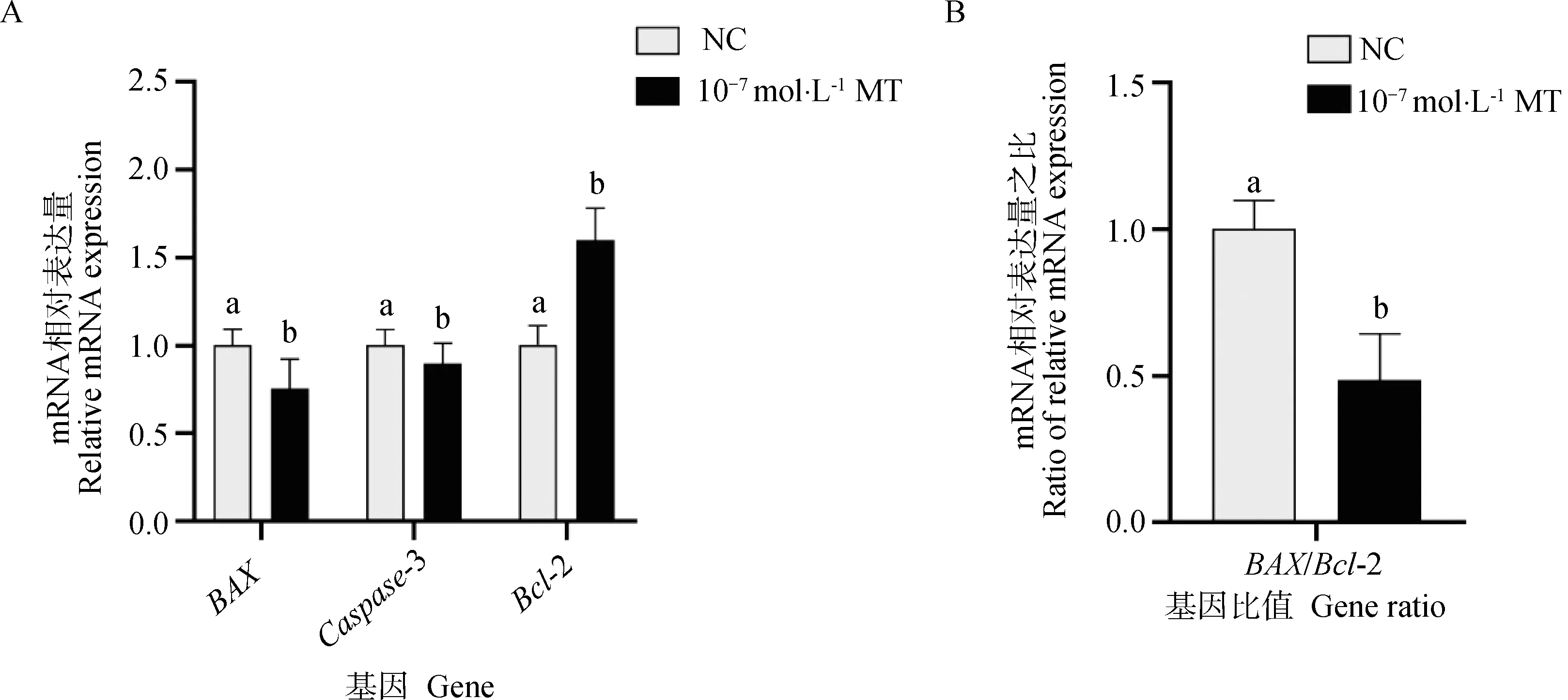
A.MT对颗粒细胞BAX、Bcl-2、Caspase-3 mRNA表达的影响;B.BAX/Bcl-2 mRNA相对表达量之比
2.3 MT对绵羊卵巢颗粒细胞E2、P4及cAMP分泌的影响
利用ELISA检测MT对颗粒细胞类固醇激素和cAMP分泌的影响。由图5A可知,添加10-7mol·L-1MT显著抑制了颗粒细胞P4的分泌(P<0.05),由图5B和图5C可知,MT对E2和cAMP的分泌无显著影响(P>0.05)。
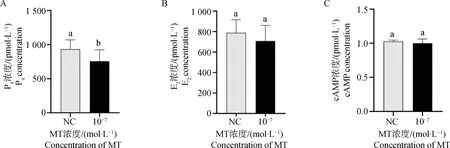
A.MT对P4分泌的影响;B.MT对E2分泌的影响;C.MT对cAMP的影响
2.4 MT对绵羊卵巢颗粒细胞MT受体、类固醇激素相关基因及蛋白表达的影响
利用RT-qPCR检测MT对颗粒细胞MT受体、促性腺激素受体和类固醇合成基因表达的影响。由图6可知,MT显著上调MT受体基因1(MT1)mRNA的表达水平(P<0.05),显著下调促性腺激素受体FSHR的mRNA表达(P<0.05),显著下调P4合成基因STAR、3β-HSD和CYP11A1的mRNA表达水平(P<0.05),对于MT受体基因2(MT2)、LHR和CYP19A1的表达无显著影响(P>0.05)。
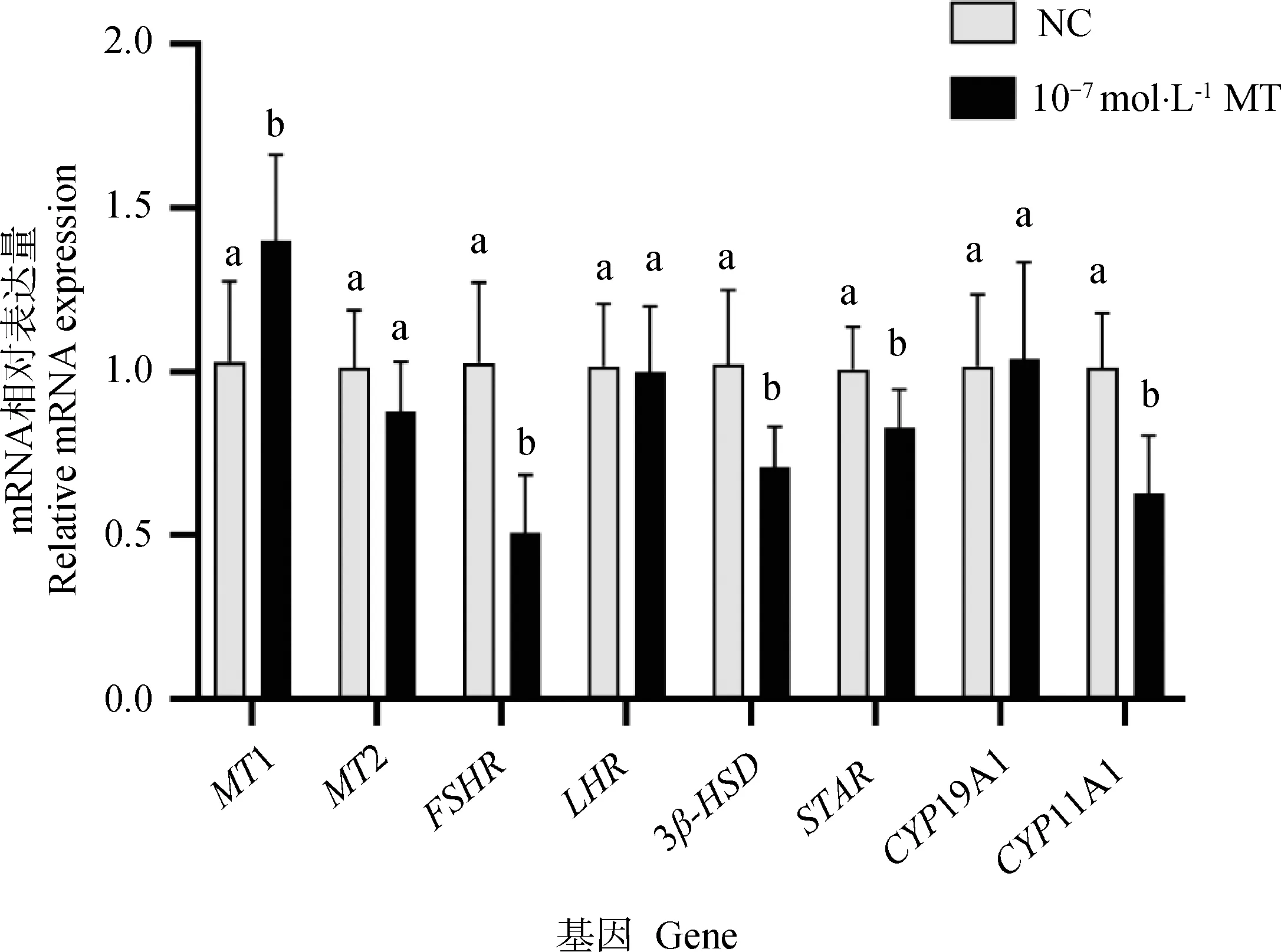
图6 MT对绵羊颗粒细胞MT受体和类固醇合成通路相关基因mRNA表达的影响
利用Western blot检测MT对颗粒细胞上述基因蛋白表达的影响,以印证mRNA表达结果。由图7可知,MT显著上调MT1的蛋白表达,显著下调FSHR、STAR、3β-HSD和CYP11A1蛋白表达(P<0.05);而对MT2、LHR和CYP19A1的蛋白表达无显著影响(P>0.05),与mRNA表达结果相一致。
3 讨 论
3.1 MT对绵羊卵巢颗粒细胞增殖和凋亡的影响
哺乳动物卵泡主要由卵母细胞、颗粒细胞和卵泡膜细胞组成,卵泡的成熟排卵和凋亡闭锁实质上是颗粒细胞的增殖分化和凋亡[11]。MT作为一种强效的抗氧化物质和活性氧清除剂[12-13],可保护机体免受氧化损伤。研究发现,MT不仅对人和猪卵丘细胞有明显的抗凋亡作用[14-15],也对人和小鼠颗粒细胞的凋亡有显著影响[16-17]。Tian等[18]发现,10-7mol·L-1MT可促进绵羊卵丘细胞增殖及卵母细胞成熟。本研究发现,10-9、10-8、10-7、10-6mol·L-1MT处理48 h后绵羊卵巢颗粒细胞增殖活力均显著升高,且细胞活力与对照组相比分别升高18.4%、31.0%、42.0%和25.6%,说明褪黑素可促进绵羊卵巢颗粒细胞增殖。在猪卵巢颗粒细胞中,添加0.01 和0.1 ng·mL-1MT显著提高了细胞增殖活力,抑制了细胞凋亡,且最适浓度0.01 ng·mL-1增殖活力和抗凋亡率最高[19]。在凋亡试验中发现,10-8、10-7、10-6mol·L-1MT不仅可以显著降低颗粒细胞早期凋亡率,也显著降低了晚期凋亡率,3组中10-7mol·L-1MT细胞凋亡率最低。此外,与其他MT处理组相比,10-9mol·L-1MT显著促进了颗粒细胞的早期凋亡和晚期凋亡。这表明MT对绵羊颗粒细胞的增殖和凋亡作用与其添加量不呈线性增加关系。
3.2 MT对绵羊卵巢颗粒细胞P4、E2及cAMP分泌的影响
颗粒细胞会通过类固醇激素分泌影响卵泡发育[20],但MT与绵羊卵巢颗粒细胞的功能关系尚不明确。本研究中,卵巢颗粒细胞中添加10-7mol·L-1MT处理48 h显著降低P4的分泌水平,而对E2的分泌无显著影响,说明在体外培养的绵羊卵巢颗粒细胞中添加MT会抑制P4的分泌,而P4水平的降低则会减缓下丘脑和垂体促性腺释放激素和促性腺激素分泌的负反馈调节,从而影响卵泡发育[21]。在人颗粒细胞中,200 pg·mL-1MT可显著促进P4的分泌,小于200 pg·mL-1对P4分泌无显著影响[22]。但在水牛颗粒细胞[23]中添加10-7mol·L-1MT处理24 h,显著降低培养液中P4分泌水平,而对E2的分泌无显著影响,与本研究结果一致。在猪卵巢颗粒细胞中[19],P4分泌水平随MT浓度的升高而显著降低,E2分泌随MT添加浓度升高呈现先升高后降低。以上研究结果说明,MT对哺乳动物卵巢颗粒细胞P4和E2分泌的影响可能存在物种差异。
MT与受体结合后通过第二信使发挥作用。研究表明,MT可能根据组织、器官和物种的不同诱导不同的第二信使发挥作用[24]。在下丘脑室旁核和视上核细胞中,cAMP作为第二信使在MT信号传导过程中发挥作用[25],在鸡颗粒细胞中,MT通过与G蛋白偶联抑制腺苷环化酶进而抑制cAMP水平[26]。除cAMP路径外,在垂体细胞、垂体远端部及下丘脑内侧基底部,MT也可通过钙离子、PKC和cGMP路径发挥作用[27-28]。Riaz等[23]发现,在牛颗粒细胞添加10-7mol·L-1MT不影响cAMP分泌,本研究与以上研究结果一致。在绵羊卵丘卵母细胞复合体[18]中发现,10-7mol·L-1MT组与对照组相比cAMP水平无显著差异,但显著提高了cGMP水平和促进了卵丘细胞增殖。对于MT是否通过其他第二信使对绵羊卵巢颗粒细胞发挥作用有待进一步研究。
3.3 MT对绵羊卵巢颗粒细胞中MT受体表达的影响
在鸡、猪、牛和羊等动物的卵巢、卵丘细胞和颗粒细胞中均检测到MT1和MT2基因的表达。在体外研究发现,MT主要通过MT1改善绵羊卵母细胞质量促进卵母细胞成熟[18]。在牛颗粒细胞中,MT显著提高MT1的表达,但对MT2的表达无显著影响[23,29]。在本研究中也有相似发现,MT显著上调MT1 mRNA和蛋白的表达,而对MT2 mRNA和蛋白的表达无显著影响,说明MT1在MT调控绵羊颗粒细胞的增殖凋亡中发挥重要作用。此外,在其他物种中有不同发现,在猪颗粒细胞中添加0.01 ng·mL-1MT显著促进MT2表达,对MT1表达无显著影响[19]。在鸡卵巢颗粒细胞中添加1 ng·mL-1MT两种受体表达量均显著升高[26]。以上研究表明,MT对于不同物种可通过不同受体调控颗粒细胞的增殖与凋亡。
3.4 MT对绵羊卵巢颗粒细胞凋亡基因及类固醇激素合成相关基因表达的影响
自由基和活性氧是诱导颗粒细胞发生凋亡的重要因素之一。随着卵泡的发育,卵泡内细胞的新陈代谢能力和类固醇激素水平的上升,可导致自由基在卵泡内的堆积并引起氧化损伤[30]。在卵巢颗粒细胞凋亡过程中Bcl-2介导内源凋亡通路调控细胞凋亡[31]。在热应激的绵羊颗粒细胞中,MT通过促进Bcl-2抑制凋亡基因p53表达,保护颗粒细胞免受氧化应激损伤[32]。在牦牛黄体细胞[33]中,MT显著上调抗凋亡基因Bcl-2的表达,下调凋亡基因BAX的表达及BAX/Bcl-2的比值,从而抑制黄体细胞凋亡。MT通过促进Bcl-2表达,降低Caspase-3表达,抑制水牛颗粒细胞凋亡[23]。本研究结果与上述报道基本一致,MT通过上调Bcl-2的表达、下调BAX、Caspase-3和BAX/Bcl-2比值,抑制绵羊颗粒细胞凋亡。
FSH通过与颗粒细胞上的受体FSHR结合活化芳香化酶,刺激P4分泌,影响卵巢颗粒细胞类固醇激素相关基因表达;也可通过诱导LHR表达,促进LH与受体结合介导雄烯二酮转化为E2[34-35]。FSH和MT均可通过受体直接作用于卵巢颗粒细胞,且MT可抑制FSH与其受体结合[23]。在牛颗粒细胞中10-7mol·L-1MT处理24 h,显著下调FSHR的表达,上调LHR的表达[23]。本研究中,MT显著下调了FSHR的mRNA和蛋白表达水平,而对LHRmRNA和蛋白表达无显著影响,这与P4和E2的分泌结果相一致。
StAR是类固醇激素合成过程中重要的调节因子,可编码孕酮合成过程中胆固醇向线粒体内膜的跨膜运输。有研究发现,CYP11A1和3β-HSD的表达与卵泡液中P4含量呈正相关[36]。CYP11A1和3β-HSD是P4合成的主要催化酶,前者调控胆固醇向孕烯醇酮的转化过程,后者将孕烯醇酮转化为P4[37]。在体外培养水牛和猪颗粒细胞中发现,MT通过下调StAR和CYP11A1的表达抑制P4分泌[23,38]。在本研究中,MT显著抑制了CYP11A1、StAR和3β-HSD的表达,说明MT通过抑制P4合成酶编码基因的表达,抑制了绵羊卵巢颗粒细胞P4的分泌。在E2合成过程中,芳香化酶可调节雄烯二酮和睾酮转化为E2,是E2合成的重要限速酶,由CYP19A1编码生成[39]。本研究发现,MT对CYP19A1基因及蛋白的表达无显著影响。
4 结 论
本研究表明,MT通过上调Bcl-2的表达、下调BAX、Caspase-3表达和BAX/Bcl-2比值,抑制绵羊颗粒细胞凋亡;MT通过与颗粒细胞上MT1结合下调FSHR、StAR、3β-HSD和CYP11A1基因表达,抑制P4的分泌。

