免疫检查点抑制剂联合仑伐替尼对TACE抵抗晚期原发性肝癌患者生活质量及不良反应的影响
刘方丽
菏泽市牡丹人民医院肿瘤科,山东菏泽 274000
肝癌在我国恶性肿瘤病死率中排名第二位[1]。主要分为原发性和继发性两大类,该病患者常见肝区疼痛、腹胀、纳差、乏力等症状,发病率高,危害大,严重者极易导致患者死亡,预后较差。据相关定义[2]:晚期或进展期肝癌患者已缺乏外科切除指征,可用经动脉化疗栓塞(transarterial chemoemboli‐zation, TACE)向肿瘤局部注射高浓度药物从而发挥肿瘤细胞杀伤作用,具有微创、安全性高、术后恢复快等优势,可控制患者病情进展,但多数患者术后极易出现疼痛、发热等并发症,影响手术效果。但仍有部分患者疗效不理想,因此应优化治疗方案。仑伐替尼能通过抑制血管内皮生长因子及其受体等,阻滞肿瘤细胞继续增殖[3]。免疫检查点抑制剂可抑制免疫细胞小分子蛋白的识别功能,调节免疫激活程度,发挥抗肿瘤作用[4]。选取使患者获益最大的治疗方案是有必要的。有指南推荐[5],肝癌领域治疗应多方式,避免单一治疗的局限性。鉴于此,本研究选取2019年9月—2022年12月菏泽市牡丹人民医院收治的65例晚期原发性肝癌患者作为研究对象,现报道如下。
1 资料与方法
1.1 一般资料
本研究已经本院医学伦理委员会批准。选取本院收治的65例晚期原发性肝癌患者作为研究对象,以抽签法分为对照组(n=32)与观察组(n=33)。其中对照组男21例、女11例;年龄53~63岁,平均(58.69±3.66)岁;肿瘤直径6~9 cm,平均(7.23±1.02)cm;临床分期Ⅲb期16例、Ⅳ期16例;病因乙肝23例、丙肝6例,其他3例。观察组男22例、女11例;年龄54~63岁,平均(58.03±3.98)岁,肿瘤直径6~9 cm,平均(7.31±1.16)cm;临床分期Ⅲb期18例、Ⅳ期15例;病因乙肝24例、丙肝5例,其他4例。两组基线资料对比,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:符合《中国肿瘤整合诊治指南-肝癌》[6]中的疾病诊断标准;患者及其家属签署同意书;符合TACE抵抗定义[7]:更换化疗药物/供血动脉经重新评估,连续TACE治疗≥2次,1~2月后(CT/MRI)检查显示:靶病灶与上次治疗相比仍存在≥50%/出现新病灶;发生血管侵犯/肝外转移;治疗后肿瘤相关指标持续上升;临床资料完整;预计生存期>3个月。
排除标准:合并其他恶性肿肿瘤者;合并其他重要脏器损害、感染等者;合并凝血功能障碍者;合并免疫系统障碍者。
1.3 方法
对照组:给予仑伐替尼注射液(进口药品注册证号H20180052;规格:4 mg/粒)8 mg(体质量<60 kg)、12 mg(体质量≥60 kg),口服,1次/d。
观察组:在对照组基础上另给予替雷利珠单抗注射液(国药准字S20190045;规格:100 mg)200 mg(20 mL)与0.9%氯化钠溶液100 mL相溶,静脉滴注,200 mg/d,以3周为一个治疗周期,于每周期首日应用。
两组均治疗3个月。
1.4 观察指标
①对比两组疗效。根据《实体瘤疗效评价标准》[8]进行评价:完全缓解为全部目标病灶均消失;部分缓解为全部目标病灶直径相加减小≥30%;稳定为全部目标病灶直径相加减小<30%或增大<20%;疾病进展为均未达到以上标准,或新病灶出现。客观缓解率(objective response rate, ORR)=完全缓解率+部分缓解率;局部控制率(local control rate, LCR)=1-疾病进展率。
②对比两组血管生成因子。于治疗前后,抽取两组静脉血进行离心处理(3 000 r/min转速、7 cm半径)10 min,取血清,以酶联免疫吸附法测定血小板源生长因子(platelet-derived growth factor,PDGF)、干细胞培养关键因子(key factors in stem cell culture, bFGF)、血管内皮生长因子(vascular en‐dothelial growth factor, VEGF)。
③对比两组生活质量。治疗前后,采用癌症患者生活质量量表(Quality of Life Scale for Cancer Pa‐tients, QLQ-C30),包括30个内容,126分制,分数与生活质量呈负相关。
④对比两组不良反应。记录两组发生胃肠道反应、发热、皮肤与肌肉瘙痒或疼痛、肝功能受损情况。
1.5 统计方法
采用SPSS 22.0统计学软件处理数据,计量资料符合正态分布,以(±s)表示,组间差异比较采用t检验;计数资料以例数(n)和率表示,组间差异比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者疗效对比
观察组ORR、LCR为66.67%、93.94%,分别高于对照组的40.63%、75.00%,差异有统计学意义(P<0.05)。见表1。

表1 两组患者疗效对比
2.2 两组患者血管生成因子水平比较
治疗前两组血管生成因子水平对比,差异无统计学意义(P>0.05),治疗后观察组血管生成因子水平均低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者血管生成因子水平比较(±s)
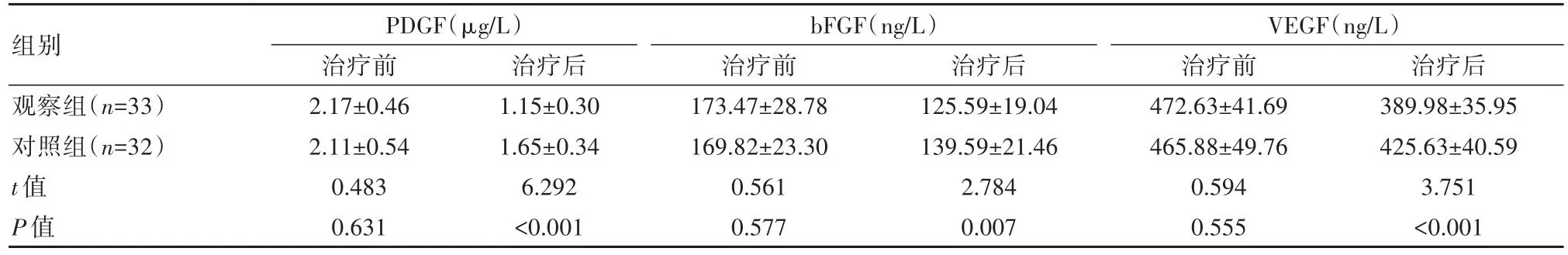
表2 两组患者血管生成因子水平比较(±s)
组别观察组(n=33)对照组(n=32)t值P值PDGF(µg/L)治疗前2.17±0.46 2.11±0.54 0.483 0.631治疗后1.15±0.30 1.65±0.34 6.292<0.001 bFGF(ng/L)治疗前173.47±28.78 169.82±23.30 0.561 0.577治疗后125.59±19.04 139.59±21.46 2.784 0.007 VEGF(ng/L)治疗前472.63±41.69 465.88±49.76 0.594 0.555治疗后389.98±35.95 425.63±40.59 3.751<0.001
2.3 两组患者生活质量比较
治疗前两组生活质量比较,差异无统计学意义(P>0.05),治疗后,观察组的QLQ-C30评分低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者生活质量比较[(±s),分]

表3 两组患者生活质量比较[(±s),分]
组别观察组(n=33)对照组(n=32)t值P值治疗前98.09±8.12 98.96±7.90 0.438 0.663治疗后66.15±5.38 69.98±6.27 2.646 0.010
2.4 两组患者不良反应比较
观察组不良反应总发生率27.27%高于对照组的15.64%,但差异无统计学意义(P>0.05),见表4。

表4 两组患者不良反应对比
3 讨论
原发性肝癌患者的肝实质趋于动脉血管化,以此为基础给予TACE治疗能够促使肿瘤细胞缺血缺氧,从而产生细胞毒性物质,最终使肿瘤细胞死亡[9]。但因晚期肝癌患者异质性大,此治疗方式难以获得满意疗效,在应用上仍存在一定局限性。靶向药物如仑伐替尼在肝癌治疗领域已占据重要位置,能够同时靶向较多与肿瘤驱动作用相关的分子靶点生长因子相关通路[10]。包括对磷脂酶信号传导、信号级联、磷脂酰肌醇3-激酶等经典肿瘤信号通路活性产生抑制,从而避免肿瘤细胞发生增殖、转移等,对病情进行全方位控制。此外,仑伐替尼还可对免疫检查点进行抑制,增强表达T细胞共刺激分子,调节免疫抑制环境。但同时,有研究指出,靶向单药治疗晚期肝癌患者疗效有限,临床需要难以满足[11],因此,及时寻求一种更有效的治疗方案非常有必要。
邸亮等[12]学者研究证实了,在仑伐替尼基础上另给予免疫检查点抑制剂对TACE抵抗晚期原发性肝癌患者可提高疗效,提高生活质量。本文数据显示,观察组ORR为66.67%,高于对照组的40.63%(P<0.05);观察组LCR为93.94%,高于对照组的75.00%(P<0.05);治疗后观察组生活质量评分低于对照组(P<0.05)。这与邸亮等学者的研究结论具有一致性。一般情况下,免疫检查点可避免机体免疫功能异常时,与调节免疫激活相关的一系列分子对自身正常细胞进行攻击,起到抑制过度活化作用。但当机体受多种因素影响使免疫检查点能力激增导致其过度表达,此时机体免疫力下降,易导致肿瘤细胞发生、增殖、转移等。替雷利珠单抗为一种PD-1(免疫抑制分子)抑制剂,可通过作用于细胞毒性T淋巴细胞相关蛋白4、程序性死亡受体1、程序性细胞死亡蛋白配体,解除免疫抑制作用使免疫细胞再次激活并发挥作用,以此消灭癌细胞[13]。两药物联合使用分别发挥不同机制,共同加强了增强抗肿瘤活性。此外,我国部分原发性肝癌患者在首诊时已被确诊为晚期,手术切除治疗效果不理想,且多数患者不愿接受复杂、痛苦等治疗方案,此时临床更注重姑息治疗及之后的生活质量,这也是近年来临床医学工作者讨论的热点[14]。肿瘤的发生、进展、转归、社会心理因素等均可影响患者的生活质量,晚期肝癌患者多以肝区疼痛为主要表现,且可伴随食欲不佳、全身乏力、腹部肿胀等,主要与肝癌细胞侵犯或浸润周围神经、血管、组织等并对其造成压迫从而产生疼痛;或肿瘤自身产生的化学物质、代谢产物、分解产物等刺激机体各感受器从而产生相应症状。此时患者躯体、心理、预后等难以与社会相适应,故导致生活质量下降。通过免疫检查点抑制剂联合仑伐替尼联合治疗后,患者目标病灶清除效果较好,ORR及LCR提高,其症状改善明显,由此生活质量得以提升。
本文数据显示,治疗后观察组PDGF、bFGF、VEGF分别为(1.15±0.30)µg/L、(125.59±19.04)ng/L、(389.98±35.95)ng/L,明显低于对照组(1.65±0.34)µg/L、(139.59±21.46)ng/L、(425.63±40.59)ng/L(P<0.05),这与彭雨等[15]的研究结论“观察组aFGF、bFGF和VEGF水平分别为(4.1±0.8)pg/L、(5.1±1.0)pg/L和(13.5±2.7)ng/mL,均显著低于对照组的(5.3±0.9)pg/L、(6.1±0.8)pg/L和(18.6±3.1)ng/mL(P<0.05)”相似。肝癌属于高度血管化恶性肿瘤,癌细胞的增殖、浸润、转移等与血管生成密不可分。因此,通过抑制肿瘤血管生成因子来减少肝癌血管生成与转移至关重要。仑伐替尼通过多靶点抑制肿瘤形成需要的新生血管,能够有效抑制肿瘤进展,但长期干预也存在一定耐药性,考虑与肿瘤干细胞产生异制细胞有关。在此基础上给予免疫检查点抑制剂,可结合于T淋巴细胞表面负性共刺激分子的特异性,可抑制诱导细胞发生凋亡、失活、耗竭等,使肿瘤免疫状态被解除,实现抗肿瘤目的。同时,用药安全性是治疗方案是否合理必须考虑的重点问题,观察组不良反应总发生率27.27%,高于对照组15.64%,但组间比较差异无统计学意义(P>0.05),这与高琦雯[16]研究结论“PD-1单克隆抗体治疗组(B组)与联合治疗组(C组)皮疹发生率比较,但差异无统计学意义(P>0.05)”相一致,认为与单一用药相比,联合用药通过双重靶点作用于病灶,有助于良好控制病情,安全性尚可,患者更易接受及认可。
综上所述,两药联合治疗TACE抵抗晚期原发性肝癌患者疗效确切且安全性尚可,可对血管生成因子有一定影响,提升患者生活质量,临床建议使用。

