星孢寄生菇个体发育对可控环境因子的响应
赵娅通,吴 丹,周会明,梁 婷,沈清林,谷朝政,陈雪雯,宁亚娟
(滇西科技师范学院生物技术与工程学院 云南临沧 677000)
星孢寄生菇隶属于真菌门(Eumycota)、担子菌纲(Basidiomycota)、伞菌目(Agaricales)、离褶伞科(Lyophyllaceae)、寄生菇属(Asterophora),主要分布于我国的云南、贵州、四川等地区[1]。该菇是一种兼有寄生与腐生的菌寄生菇,有着独特的营养方式。在人工培养基上,星孢寄生菇的菌丝体与一般食用菌相比具有生长速度快、出菇迅速的特点[2]。因此,研究其出菇机制与遗传学原理对推动名贵食药用真菌人工栽培进程具有重要意义。
适宜的环境因子是众多野生菇类得以出菇的必备条件,而个体发育是菇类在环境因子影响下遗传基因的外在表达,也是菇类对环境因子的最终响应。然而,目前绝大多数野生菇类仍无法有效地人工栽培,其子实体发育机制也难以解释,驯化模式仍受内在因素与环境因素的影响[3]。笔者以独特的星孢寄生菇为研究对象,探究其个体发育与可控环境因子的关系,对于阐释其出菇机制、遗传学原理及其应用具有重要的意义。
目前,国内外有关星孢寄生菇的研究主要集中于形态学[4]、种质资源[5-6]、亲缘关系[7]等方面。王建东等[2]对该菇个体发育所需的基础培养基、碳源、氮源、温度以及pH 行了初步筛选,但除此之外,关于该菇的生理学研究未见其他报道,导致野生星孢寄生菇的开发与利用严重滞后,因此有必要对该菇进行更深入的研究。
环境因子能够影响菇类的生理代谢过程[8],从而影响其生长发育全过程。因此,厘清不同环境因子胁迫下菇类个体的发育规律与特点,是野生菇类人工驯化的基础[9]。与此同时,随着人们生活水平的提高,菇类的消费需求呈快速增长趋势,而野生菇类驯化的速度却缓慢滞后[10],这种矛盾日益凸显。因此,探究该菇个体发育对可控环境因子的响应对突破野生菇类资源人工化难度大这一瓶颈意义重大。
笔者的研究从星孢寄生菇菌种的活化入手,重点探究不同温度、琼脂浓度、酸碱度、氧气含量、光照时长等可控环境因子单因素及其正交组合对该菇菌丝生长、原基分化及子实体发育的影响,旨在筛选该菇个体发育的最佳可控环境因子组合,厘清该菇生长发育过程中的主要影响因素,并为其进一步开发与利用提供一定的理论参考。
1 材料和方法
1.1 材料
1.1.1 供试菌株 星孢寄生菇菌株YAASM4665由云南省农业科学院生物技术与种质资源研究所鉴定、提供及保存。
1.1.2 培养基 母种培养基(PDA):马铃薯浓度(w,后同)20%、葡萄糖浓度2%、琼脂浓度1.5%、蒸馏水1 L、pH 自然。基础培养基(PSA):马铃薯浓度20%、蔗糖浓度2%、琼脂浓度1.5%、蒸馏水1 L、pH 自然。
1.2 方法
1.2.1 培养基的制作 试验于2021 年5 月在滇西科技师范学院食用菌实训室内进行。马铃薯去皮、弃芽眼并清洗干净,将其切成1 cm3的小块,用蒸馏水对其煮沸10 min,并经4 层纱布过滤后取滤液,再加入蔗糖和琼脂,待上述药品完全溶解后用蒸馏水定容,将培养基分装于250 mL 的锥形瓶内,在121 ℃下灭菌30 min。灭菌结束后,趁热倒平板并将其放入自制的缓慢降温容器中,以防止平板内产生小水珠[11]。
1.2.2 菌种的活化、接菌、培养及测定 取4 ℃冰箱内保存的菌株YAASM4665,将其置于培养室常温下活化培养3~5 d。在无菌操作条件下,取黄豆大小的菌块接种于母种培养基平板中央,将其25 ℃下倒置培养7 d,备用。用上述同样的方法,将直径为5 mm 的菌块接入培养基平板中央,用保鲜膜密封,记录菌丝萌发时间(d)、菌丝与子实体颜色、原基分化时间(d)。待同一因素下最大菌落直径长到平板2/3 时,测定菌丝生长势(“+++及以上”表示浓密健壮,“++”表示较浓密,“+”表示生长稀疏、“─”表示不生长)[12]、菌落直径(mm)、生长速度(mm·d-1)[13]、原基分化数量(个·皿-1)、菌盖直径(mm)、菌柄 直 径(mm)、菌柄长度(mm)以及子实体数量(个·皿-1)。
1.2.3 温度试验 在基础培养基平板上设置9 个梯度的5 ℃温差(0、5、10、15、20、25、30、35、40 ℃)进行初试。根据初试最佳温度范围设计2 ℃温差试验。菌丝在遮光下培养,下同。
1.2.4 琼脂浓度试验 通过控制琼脂浓度来改变基础培养基的含水量,设计琼脂浓度为0.2%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%的7 个梯度试验。在菌丝生长最佳温度下培养,下同。
1.2.5 pH 试验 使用1 mol·L-1HCl 溶液和1 mol·L-1NaOH 溶液调节基础培养基的pH 值,设置19 个pH 梯度试验[14],分别为4.0、4.5、5.0、5.2、5.4、5.6、5.8、6.0、6.2、6.4、6.6、6.8、7.0、7.5、8.0、8.5、9.0、9.5、10.0。在菌丝生长最佳琼脂浓度下培养,下同。
1.2.6 氧气含量试验 通过改变培养皿直径的大小控制氧气含量,设计培养皿直径为60、70、90、100 mm 的4 种基础培养基平板试验。在菌丝生长最佳pH 值下进行培养,下同。
1.2.7 光照时长试验 在基础培养基平板上,设置光照时间分别为0、12、24 h·d-1的3 组处理试验[15]。除氧气试验外,上述研究培养皿直径均为60 mm。
1.2.8 正交试验 以温度、琼脂浓度、pH、光照和含氧量5 个单因素进行设计,分别以菌丝体生长速度(表1)、原基分化数量(表2)及子实体发育数量(表3)为指标,进行L16(45)正交试验。
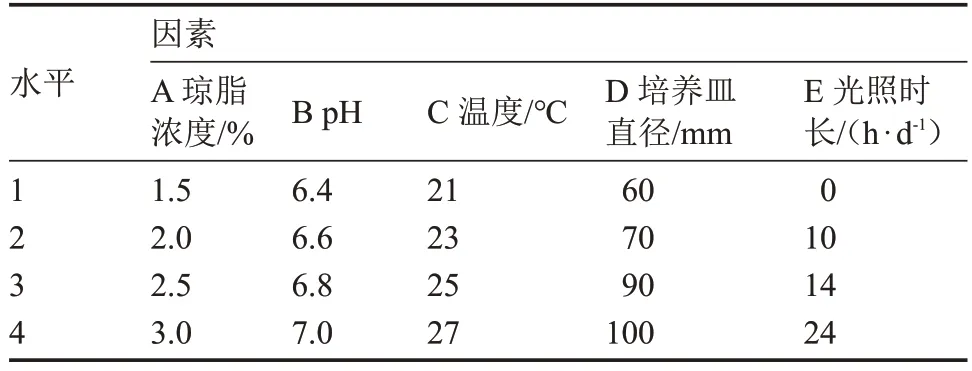
表1 基于菌丝体生长速度的正交试验因素与水平表Table 1 The orthogonal test factors and levels based on mycelium growth rate

表2 基于原基分化数量的正交试验因素与水平Table 2 The orthogonal test factors and levels based on number of primordial differentiation
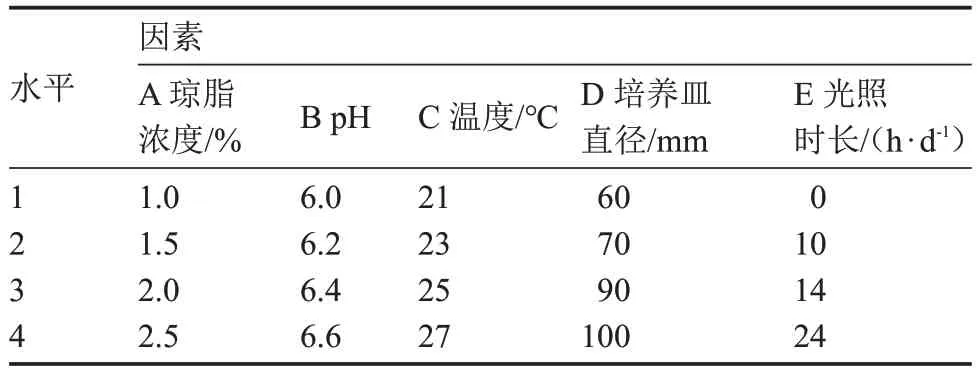
表3 基于子实体发育数量的正交试验因素与水平Table 3 The orthogonal test factors and levels based on number of fruiting body development
1.2.9 数据分析 所有试验数据均为3 次重复,采用SPSS 22.0 软件进行处理分析[16]。
2 结果与分析
2.1 温度对菌株YAASM4665生长发育的影响
2.1.1 5 ℃温差试验 由表4 可知,当温度≤10 ℃或≥35 ℃时,该菇菌丝不萌发,而在15~30 ℃范围内,均能生长且为白色(图1)。当温度为25 ℃时,其菌丝萌发时间最短,浓密健壮,菌落直径最大,生长速度最快,达到(6.33±0.06)mm·d-1,与其他处理呈极显著差异,而30 ℃处理其菌丝生长情况最差。总之,该菇菌丝生长受温度的影响较大,25 ℃是该菇菌丝生长的最适温度。

图1 5 ℃温度梯度下菌株YAASM4665 在PSA 平板中的培养情况Fig.1 The cultivation of bacterial strain YAASM4665 in PSA slab at 5 ℃temperature gradient

表4 5 ℃温度梯度下菌丝体生长情况Table 4 The mycelium growth at 5 ℃temperature gradient
该菇在温度为15~25 ℃范围内,原基分化与子实体均能正常发育,而温度≤10 ℃或≥30 ℃时,该菇无法形成原基和子实体(表5)。当温度为25 ℃时,该菇的原基分化与子实体发育各项指标综合表现最佳,与其他处理均呈极显著差异,而15 ℃处理该菇生长发育情况最差。总之,温度较高或较低时,该菇的原基分化与子实体发育受到限制,25 ℃是该菇原基分化与子实体发育的最适温度。
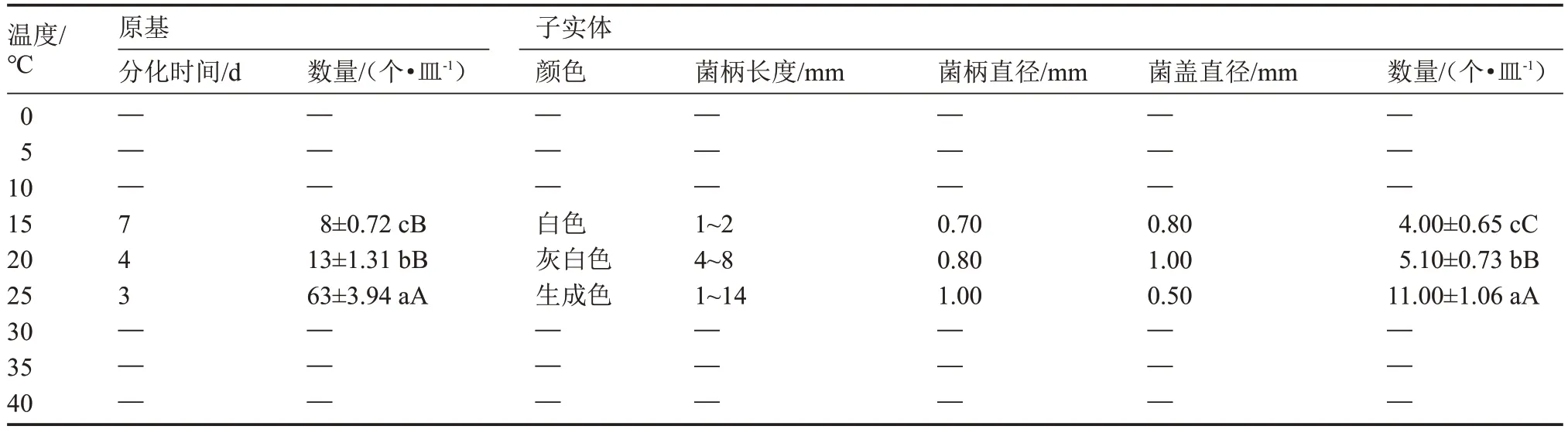
表5 5 ℃温度梯度下原基分化与子实体发育情况Table 5 The primordial differentiation and fruiting body development at 5 ℃temperature gradient
2.1.2 2 ℃温差试验 由表6 可知,在19~29 ℃范围内,该菇菌丝为白色且均能生长(图2)。25 ℃的温度处理下其菌丝生长情况各项参数表现最佳,该结果与5 ℃温差试验结果相符。

图2 2 ℃温度梯度下菌株YAASM4665 在PSA 平板中的培养情况Fig.2 The cultivation of bacterial strain YAASM4665 in PSA slab at 2 ℃temperature gradient

表6 2 ℃温度梯度下菌丝体生长情况Table 6 The mycelium growth at 2 ℃temperature gradient
由表7 可知,19~27 ℃是该菇原基分化与子实体发育正常进行的温度范围,而温度≥29 ℃时,该菇停止发育。在25 ℃的温度处理下,该菇原基分化与子实体发育的各项指标也表现最佳,与上述5 ℃温差试验结果相符。

表7 2 ℃温度梯度下原基分化与子实体发育情况Table 7 The primordial differentiation and fruiting body development at 2 ℃temperature gradient
2.2 琼脂浓度对菌株YAASM4665 生长发育的影响
由表8 可知,在培养基琼脂浓度0.2%~3.0%的范围内,该菇菌丝均能正常生长,呈白色,萌发时间均为2 d。当琼脂浓度为3.0%时,菌丝较浓密(图3),菌落直径最大,生长速度最快[(7.17±0.10)mm·d-1],与其他处理呈极显著差异,而琼脂浓度为0.2%时,菌丝长势稀疏,生长速度最慢[(5.51±0.10)mm·d-1]。总之,不同的培养基琼脂浓度对该菇菌丝生长影响较大,3.0%是其菌丝生长最佳琼脂浓度。

图3 不同琼脂浓度下菌株YAASM4665 在PSA平板中的培养情况Fig.3 The cultivation of bacterial strain YAASM4665 in PSA slab at different agarose gel concentration

表8 不同琼脂浓度下菌丝体生长情况Table 8 The mycelium growth at different agarose gel concentration
由表9 可知,该菇在所有琼脂浓度处理下均能正常生长发育,其中原基分化时间均为3 d。而琼脂浓度为2.5%时,该菇的原基分化数量最多[(106±7.13)个·皿-1],与其他处理相比,达到极显著差异,而1.0%的琼脂浓度处理,该菇原基分化情况最差。当琼脂浓度为1.5%时,该菇子实体呈灰白色,农艺性状综合表现最佳,发育数量最多[(8.67±0.58)个·皿-1],与其他处理呈显著差异,而0.2%的琼脂浓度处理,该菇子实体发育情况较差,数量最少。总之,培养基琼脂浓度的大小影响该菇的生长发育情况,其原基分化与子实体发育的最适琼脂浓度依次为2.5%、1.5%。

表9 不同琼脂浓度下原基分化与子实体发育情况Table 9 The primordial differentiation and fruiting body development at different agarose gel concentration
2.3 pH值对菌株YAASM4665生长发育的影响
由表10 可知,在培养基pH 4.0~10.0 的范围内,该菇菌丝均能正常生长,萌发时间均为2 d(图4)。当培养基pH 6.6 时,该菇菌丝较浓密,菌落直径最大,生长速度最快[(6.89±0.15)mm·d-1],除与培养基pH 6.8 的处理相比差异不显著外,与其他处理呈极显著差异。而培养基pH 4.0 时,该菇菌落直径最小,生长速度最慢[(4.48±0.54)mm·d-1]。总之,该菇在不同酸碱度的培养基上菌丝生长差异较大且最佳pH 为6.6~6.8。

图4 不同pH 值下菌株YAASM4665 在PSA 平板中的培养情况Fig.4 The cultivation of bacterial strain YAASM 4665 in PSA slab at different pH

表10 不同pH 值下菌丝体生长情况Table 10 The mycelium growth at different pH
在培养基pH 4.5~10.0 的范围内,该菇均能生长发育(表11)。当培养基pH 4.0 时,该菇无法形成原基,pH 10.0 时,子实体发育情况最差。在pH 5.4 的培养基上,该菇原基分化时间短(3 d),数量最多[(214±13.04)个·皿-1],与其他处理呈极显著差异。当培养基pH 为6.2 时,该菇子实体呈乳白色,农艺性状综合表现较佳,发育数量最多[(8.00±0.94)个·皿-1],除与培养基pH 6.0、6.4、6.6 的处理相比差异不显著外,与其他处理呈极显著差异。总之,该菇的生长发育受酸碱度影响较大,其原基分化与子实体发育的最适pH 值依次为5.4、6.0~6.6。

表11 不同pH 值下原基分化与子实体发育情况Table 11 The primordial differentiation and fruiting body development at different pH
2.4 氧气对菌株YAASM4665生长发育的影响
由表12 可知,该菇在所有型号的培养皿平板上均能生长,菌丝呈白色(图5),且萌发时间均为1 d。然而,随着培养皿直径的增大,该菇菌落的生长势逐渐减弱,其菌丝生长速度在各处理下无显著差异。因此,氧气对菌丝生长的影响较小。

图5 不同含氧量下菌株YAASM4665 在PSA 平板中的培养情况Fig.5 The cultivation of bacterial strain YAASM4665 in PSA slab at different oxygen content

表12 不同含氧量下菌丝体生长情况Table 12 The mycelium growth at different oxygen content
由表13 可知,该菇在各种型号的培养皿处理下均能生长发育,且原基分化时间均为2 d,子实体呈胡粉色。在培养皿直径为70 mm 的条件下,该菇的原基分化数量最多[(19.67±0.58)个·皿-1],且与其他处理呈极显著差异。而培养皿直径为100 mm时,该菇的子实体农艺性状综合表现较佳,发育数量最多[(4.33±0.58)个·皿-1],并且与培养皿直径为60 mm 的处理相比达到显著差异。总之,各类型号培养皿对该菇生长发育具有一定程度的影响,其原基分化与子实体发育的最适培养皿直径依次为70、70~100 mm。

表13 不同含氧量下原基分化与子实体发育情况Table 13 The primordial differentiation and fruiting body development at different oxygen content
2.5 光照时长对菌株YAASM4665 生长发育的影响
由表14 可知,该菇菌丝在不同光照时长处理下均能生长,呈白色(图6),且萌发时间均为2 d。在0 h·d-1的光照处理下该菇菌丝生长浓密健壮,菌落直径最大,菌丝生长速度最快[(7.15±0.25)mm·d-1],与24 h·d-1的光照时长处理相比差异显著,但与12 h·d-1的光照时长处理相比差异不显著。总之,黑暗处理组下该菇菌丝生长情况优于光照组。
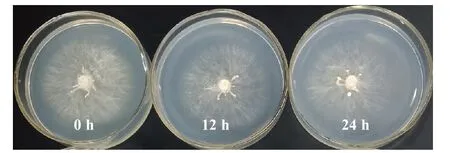
图6 不同光照时长的菌株YAASM4665 在PSA 平板中的培养情况Fig.6 The cultivation of bacterial strain YAASM4665 in PSA slab at different light time

表14 不同光照时长的菌丝体生长情况Table 14 The mycelium growth at different light time
该菇在不同光照时长下均能生长发育,其原基分化时间均为3 d(表15)。在12 h·d-1的光照下,该菇的原基分化数量最多[(16±3.14)个·皿-1],与其他处理相比有极显著差异,而24 h·d-1的光照处理下原基分化情况最差。当光照时间为24 h·d-1时,该菇的子实体呈生成色,其农艺性状综合表现最好,发育数量最多[(7.75±0.71)个·皿-1],与12 h·d-1的光照处理相比差异不显著,与0 h·d-1的光照时长处理呈极显著差异。总之,适宜的散射光有利于该菇原基的分化与子实体发育,其最适光照时间依次为12、12~24 h·d-1。

表15 不同光照时间下原基分化与子实体发育情况Table 15 The primordial differentiation and fruiting body development at different light time
2.6 正交试验
2.6.1 以菌丝体生长速度为指标的正交试验 由表16 可知,在16 种正交组合下,该菇菌丝呈白色且均能生长。在组合8 上菌丝萌发时间短,菌丝浓密健壮,生长速度最快[(9.72±0.38)mm·d-1](表17),与其他处理相比呈极显著差异,而组合9 和11 上菌丝生长情况最差。

表16 不同正交组合下菌丝体生长情况Table 16 The mycelium growth at different orthogonal combination

表17 以菌丝体生长速度为指标的极差分析Table 17 The range analysis based on mycelium growth rate
极差分析表明,各列极差大小顺序为R1>R3>R2>R4>R5,试验因素的主次顺序为A>C>B>D>E,即琼脂浓度对菌丝生长速度影响最大,其最优组合为 A1B4C3D2E4,该组合与显著性分析结果(A2B4C3D2E1)不一致。经试验验证,在组合A2B4C3D2E1培养基上,该菇菌丝生长速度最快[(9.02±0.18)mm·d-1]。因此,最优组合为琼脂浓度2%、pH 7.0、温度25 ℃、培养皿直径70 mm、0 h·d-1光照。
2.6.2 以原基数量为指标的正交试验 由表18 可知,在16 种正交组合条件下,该菇原基均能分化,在组合8 条件下,该菇原基分化数量最多[(17.67±1.06)个·皿-1],与其他处理相比有极显著差异。

表18 以原基数量为指标的极差分析Table 18 The range analysis based on number of primordial
极差分析表明,各列极差大小顺序为R1>R2>R5>R4>R3,试验因素的主次顺序为A>B>E>D>C,即琼脂浓度对原基分化影响最大,其最优组合为A2B3C3D1E1,该组合与显著性分析结果(A2B4C3D2E1)不一致。经试验验证,在组合A2B3C3D1E1培养基上,该菇的原基分化时间短(3 d),数量最多[(20.75±3.31)个·皿-1]。因此,最优组合为:琼脂浓度2%、pH 5.6、温度25 ℃、培养皿直径60 mm、0 h·d-1光照。
2.6.3 以子实体数量为指标的正交试验 由表19可知,在16 种正交组合条件下,该菇子实体均能发育。在组合10 条件下,该菇子实体呈白色,其农艺性状综合良好,发育数量最多[(5.25±0.71)个·皿-1](表20),与其他处理相比有显著差异。
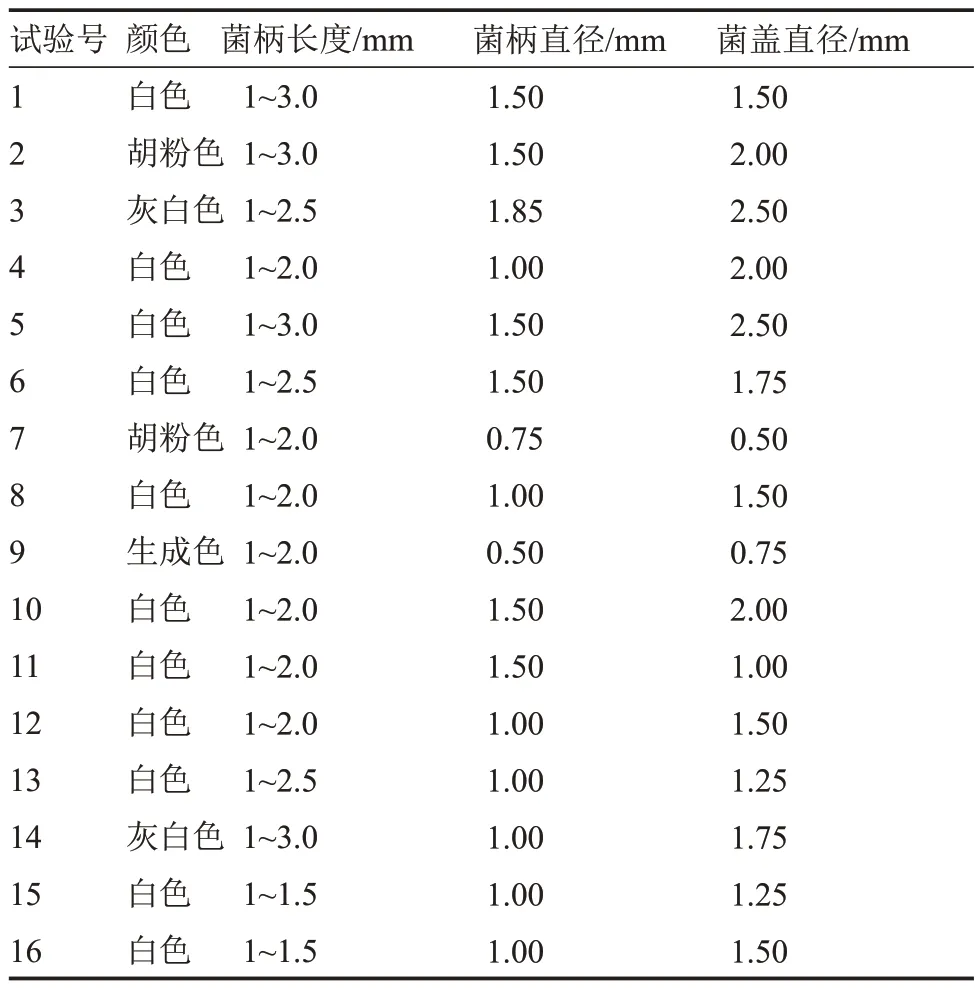
表19 不同正交组合条件下子实体发育情况Table 19 The fruiting body development at different orthogonal combination

表20 以子实体数量为指标的极差分析Table 20 The range analysis based on number of fruiting body
极差分析表明,各列极差大小顺序为R3>R4>R5>R2>R1,试验因素的主次顺序为C>D>E>B>A,即温度对子实体发育影响最大,其最优组合 A3B2C3D4E3,该组合与显著性分析结果(A3B2C4D3E1)不一致。经试验验证,在组合A3B2C3D4E3培养基上,该菇子实体发育数量最多[(5.50±0.58)个·皿-1]。因此,最优组合为:琼脂浓度2%、pH 6.2、温度25 ℃、培养皿直径100 mm、14 h·d-1光照。
3 讨论与结论
环境因子与个体发育的关系是菇类研究的热点和难点问题,也是野生菇类驯化栽培的研究基础[18]。通过对菇类生长的环境因子进行人为控制,能有效提高农业生产方面的经济效益[19]。
研究表明,星孢寄生菇在温度15~27 ℃、培养基pH 4.5~10.0 以及其他可控环境条件所有处理下均能生长发育,以25 ℃为最适温度。单因素试验条件下,在琼脂浓度3%、pH 6.6~6.8、光照时间0 h·d-1各处理下,该菇菌丝生长最快且培养皿直径大小对其无显著影响;在琼脂浓度2.5%、pH 5.4、培养皿直径70 mm、光照时间12 h·d-1各处理下,该菇原基数量最多。在琼脂浓度1.5%、pH 6.2、培养皿直径70~100 mm、光照时间12~24 h·d-1处理下该菇子实体数量最多。然而,除温度外,该菇生长发育的单因素最佳水平与最佳可控环境因子组合均不相符,其中琼脂浓度、温度是该菇关键的环境因素。
上述结果验证了适宜温度范围是菇类细胞正常代谢的基础[20],且不同菇类或同一菇类的不同品种,甚至同一品种在不同生长阶段其菌丝生长发育所需的温度也有所不同[21],该菇生长发育的温度以及pH 范围与王建东等[2]研究结果基本相同。前人也充分证明了菇类在整个发育过程中均依赖细胞储存的水分[22];酸碱度决定营养物质吸收的快慢进而影响菇类的农艺性状[23-24];多数菇类菌丝生长不需要光照,而子实体发育需要光的刺激;大多数菇类是好氧型真菌,O2的含量会影响菇类菌丝萌发和子实体发育[25]。同时,该菇的个体发育除与可控环境因子有关外,有必要进一步探究营养条件[26]、胞外酶活性[27]、基因转录组学[28]等与该菇个体发育的关系。
总之,星孢寄生菇菌丝生长的最佳组合为:温度25 ℃、琼脂浓度2%、pH 7.0、培养皿直径70 mm、光照时间0 h·d-1。该菇原基分化的最佳组合为:温度25 ℃、琼脂浓度2%、pH 5.6、培养皿直径60 mm、光照时间0 h·d-1。该菇子实体发育的最佳组合为:温度25 ℃、琼脂浓度2%、pH 6.2、培养皿直径100 mm、光照时间14 h·d-1。

