黄精多糖对糖尿病肾病大鼠铁死亡的影响
刘赫 ,李函舟 ,张辉 ,吕树泉 ,苏秀海 ,潘红梅,
1.河北中医学院研究生院,河北 石家庄 050091; 2.承德医学院,河北 承德 067000;3.河北中医学院附属沧州中西医结合医院,河北 沧州 061000
糖尿病肾病(diabetic nephropathy,DN)是糖尿病严重的微血管并发症[1],早期通常表现为微量白蛋白尿,随后逐步发展为大量蛋白尿、肾小球滤过率进行性下降、血肌酐(SCr)进行性升高[2]。若不及时治疗,可导致慢性进行性肾损伤,最终发展为终末期肾衰竭[3]。铁死亡是铁依赖的不饱和脂肪酸磷脂氧化累积导致的细胞死亡,主要表现为细胞内铁离子依赖的脂质过氧化物超限蓄积[4]。研究发现,肾小管上皮细胞损伤与铁死亡密切相关[5]。Wang等[6]发现,肾小管间质谷胱甘肽过氧化物酶4(GPX4)表达与DN病情严重程度及进展关系密切。GPX4作为触发铁死亡程序的重要靶点,是氧化应激和细胞死亡信号的传感器,GPX4表达降低会导致细胞内活性氧水平明显升高[7]。因此,通过调控铁死亡抑制肾小管上皮细胞死亡,缓解DN肾损伤可能是治疗DN的有效策略。
黄精多糖是黄精中含量最高且具有重要药理作用的一类成分,在改善DN肾功能及缓解炎症反应等方面发挥重要作用[8]。Li等[9]研究发现,黄精多糖干预可明显改善糖尿病小鼠糖脂代谢紊乱和胰岛素耐受。另有研究发现,黄精多糖干预后,DN模型小鼠血糖、24 h尿微量白蛋白、SCr和血尿素氮(BUN)水平明显降低[10]。黄精多糖治疗DN的具体作用机制尚不明确。本研究通过高糖高脂饲料喂养结合链脲佐菌素(STZ)注射建立DN大鼠模型,观察黄精多糖对模型大鼠铁死亡的影响,探讨黄精多糖对DN的作用机制。
1 材料与方法
1.1 动物
健康雄性SD大鼠50只,体质量(200±20)g,北京华阜康生物科技股份有限公司,动物生产许可证号SCXK(京)2021-0031。饲养于中国医学科学院放射医学研究所,温度(25±2)℃,相对湿度(50±15)%,12 h光暗周期,自由饮水进食。高糖高脂饲料(10%猪油、20%蔗糖、2.5%胆固醇、67.5%常规饲料)、普通饲料(4.8%脂肪、20%蛋白质及59.4%总糖),北京华阜康生物科技有限公司。本实验经沧州中西医结合医院伦理委员会审批(CZX2022-KY-023)。
1.2 药物及制备
黄精多糖(纯度70%,批号S27804),上海源叶生物科技有限公司。用生理盐水配制成浓度分别为200、800 mg/mL溶液。厄贝沙坦片(批号8A411),赛诺菲(杭州)制药有限公司,用生理盐水配制成30 mg/mL溶液。
1.3 主要试剂与仪器
尿蛋白(批号C035-2-1)、SCr(批号C011-2-1)、BUN(批号C013-2-1)、丙二醛(MDA,批号C003-1-2)、谷胱甘肽(GSH,批号C006-2-1)、总铁离子含量(批号A039-2-1)测定试剂盒,南京建成生物工程研究所;转铁蛋白(Transferrin)、铁蛋白重链(FTH1)、GPX4、 β -actin 一抗(批号分别为ab278498、ab75973、ab252833、ab179467),英国Abcam公司。iMark680多功能酶标仪,美国Bio-Rad公司;Fresco17离心机,美国Thermo公司;5810型台式冷冻离心机,德国Eppndorf 公司;ABI Prism®7500 荧光定量PCR仪,美国应用生物系统公司;DYCZ-24DN型垂直电泳槽,北京六一仪器厂;SH-523型化学发光成像系统,杭州申花科技有限公司。
1.4 造模、分组及给药
大鼠适应性喂养1周后,随机选取10只作为正常组,常规饲料喂养。剩余40只参照文献[11]方法建立DN大鼠模型:高糖高脂饲料喂养7周后,大鼠禁食不禁水12 h,腹腔注射STZ 30mg/kg。72 h后尾静脉采血检测随机血糖,≥16.7 mmol/L为糖尿病造模成功。继续高糖高脂饲料喂养1周,代谢笼收集大鼠24 h尿液,检测尿蛋白定量。血糖≥16.7 mmol/L,尿糖阳性、尿蛋白阳性,则DN模型制备成功[12]。
将造模成功大鼠随机分为模型组、阳性药组和黄精多糖低、高剂量组,每组10只。黄精多糖低、高剂量组按人与大鼠体表面积(1∶6.25)换算给药剂量,予黄精多糖溶液200、800 mg/kg灌胃,阳性药组予厄贝沙坦溶液30 mg/kg灌胃,灌胃体积1 mL/kg,正常组和模型组予等体积蒸馏水灌胃,1次/d,连续4周。每周周六晚禁食12 h,周日早8:00尾静脉采血检测空腹血糖(FBG),每2周称量大鼠体质量并记录。
1.5 指标检测
1.5.1 肾功能指标检测
给药结束后,大鼠禁食不禁水,放入代谢笼中收集24 h尿液,检测尿蛋白含量。过量麻醉处死大鼠,腹主动脉取血,3 000 r/min离心10 min,取血清,检测SCr、BUN水平。
1.5.2 肾组织病理染色
取肾组织,经10%福尔马林溶液固定24 h,水洗20 min,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片(5 μm),行HE染色。光学显微镜下观察大鼠肾组织病理改变。
1.5.3 肾组织氧化应激指标及总铁离子含量检测
取肾组织,预冷PBS漂洗3次,剪碎后称取0.1 g组织,加入900 μL生理盐水低温匀浆,3 000 r/min离心15 min,收集上清液,试剂盒检测肾组织MDA、GSH和总铁离子含量。
1.5.4 qPCR检测
取冻存大鼠肾组织,冰浴匀浆,裂解,提取总RNA,反转录合成cDNA。按PCR试剂盒说明书步骤操作,荧光定量PCR 仪进行定量分析。反应条件:95 ℃、15 min,95 ℃、20 s,56 ℃、20 s,共40个循环。2-ΔΔCt法计算mRNA相对表达量。引物序列见表1。

表1 各基因PCR引物序列
1.5.5 Western blot检测
取肾组织,加入RIPA裂解缓冲液150 μL,匀浆离心后留取蛋白上清液。采用BCA蛋白测定试剂盒测定总蛋白浓度,将蛋白浓度进行均一化。取等量蛋白20 μg,8%~12% SDS-PAGE 进行蛋白分离,将其转移至PVDF 膜,室温5%脱脂奶粉封闭2 h,分别加入Transferrin一抗(1∶2 000)、FTH1一抗(1∶3 000)、GPX4 一抗(1∶3 000)、β-actin 一抗(1∶5 000),4 ℃孵育过夜。洗膜,加入二抗(1∶9 000),室温孵育2 h。TBST洗膜,ECL法显影检测,使用Image J软件对条带灰度值进行分析,计算目的蛋白相对表达量。
1.6 统计学方法
采用SPSS Statistics 25.0统计软件进行分析。计量资料以±s表示,所有数据进行正态性和方差齐性检验,若满足则采用t检验,若不满足则采用非参数检验。P<0.05表示差异有统计学意义。
2 结果
2.1 黄精多糖对模型大鼠体质量和空腹血糖的影响
与正常组比较,模型组大鼠体质量明显减少(P<0.01),FBG明显升高(P<0.01);与模型组比较,阳性药组大鼠体质量明显增加(P<0.05),各给药组大鼠FBG差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠体质量和FBG比较(±s)
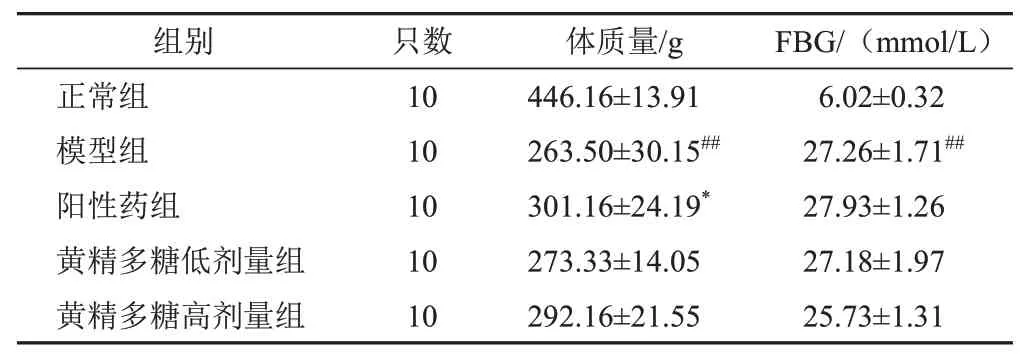
表2 各组大鼠体质量和FBG比较(±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05
?
2.2 黄精多糖对模型大鼠肾功能指标的影响
与正常组比较,模型组大鼠SCr、BUN及24 h尿蛋白含量明显升高(P<0.01);与模型组比较,阳性药组及黄精多糖高剂量组大鼠SCr、BUN及24 h尿蛋白含量明显降低(P<0.05,P<0.01)。见表3。
表3 各组大鼠肾功能指标比较(±s)

表3 各组大鼠肾功能指标比较(±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
?
2.3 黄精多糖对模型大鼠肾组织病理形态的影响
正常组大鼠肾小球、肾小管结构未见异常,系膜及系膜基质未见增生,无炎性细胞浸润等现象;模型组大鼠可见肾小管局灶变性、萎缩,肾小球基底膜略增厚,系膜增生,肾小球、肾小管出现脂肪变性;各给药组大鼠病变减轻,以阳性药组和黄精多糖高剂量组改善更明显。见图1。

图1 各组大鼠肾组织形态(HE染色)
2.4 黄精多糖对模型大鼠肾组织氧化应激指标及总铁离子含量的影响
与正常组比较,模型组大鼠肾组织MDA、总铁离子含量明显增加,GSH含量明显减少(P<0.01);与模型组比较,阳性药组和黄精多糖高剂量组大鼠肾组织MDA、总铁离子含量明显减少,GSH含量明显增加(P<0.05,P<0.01)。见表4。
表4 各组大鼠肾组织MDA、GSH和总铁离子含量比较(±s)

表4 各组大鼠肾组织MDA、GSH和总铁离子含量比较(±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
?
2.5 黄精多糖对模型大鼠肾组织铁死亡相关基因表达的影响
与正常组比较,模型组大鼠肾组织Transferrin、FTH1 mRNA表达明显升高,GPX4 mRNA表达明显降低,差异有统计学意义(P<0.01);与模型组比较,黄精多糖高剂量组大鼠肾组织Transferrin、FTH1 mRNA表达明显降低,阳性药组和黄精多糖高剂量组GPX4 mRNA表达明显升高,差异有统计学意义(P<0.01,P<0.05)。见表5。
表5 各组大鼠肾组织Transferrin、FTH1、GPX4 mRNA表达比较(±s)

表5 各组大鼠肾组织Transferrin、FTH1、GPX4 mRNA表达比较(±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
?
2.6 黄精多糖对模型大鼠肾组织铁死亡相关蛋白表达的影响
与正常组比较,模型组大鼠肾组织Transferrin、FTH1 蛋白表达明显升高,GPX4 蛋白表达明显降低(P<0.05,P<0.01);与模型组比较,阳性药组和黄精多糖低、高剂量组大鼠肾组织Transferrin、FTH1 蛋白表达明显降低,GPX4蛋白表达明显升高(P<0.05,P<0.01)。见图2、表6。

图2 各组大鼠肾组织Transferrin、FTH1、GPX4蛋白免疫印迹
表6 各组大鼠肾组织Transferrin、FTH1、GPX4蛋白表达比较(±s)
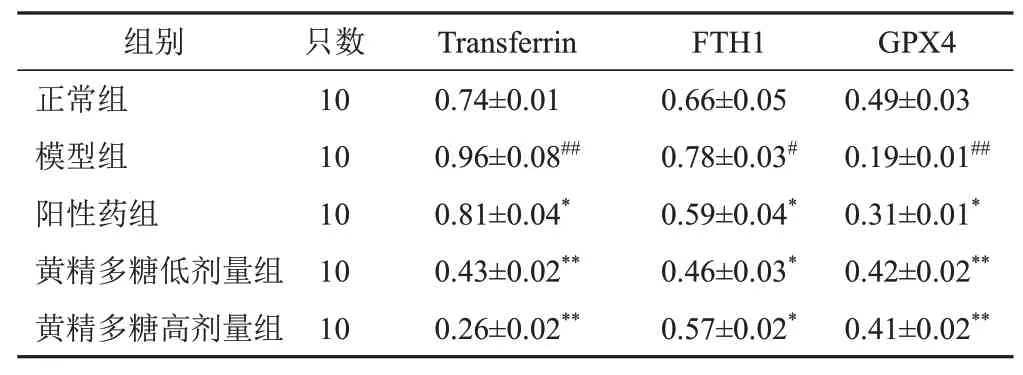
表6 各组大鼠肾组织Transferrin、FTH1、GPX4蛋白表达比较(±s)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
?
3 讨论
DN属中医学“肾消”“下消”“水肿”“尿浊”等范畴,病位主要在脾肾。脾为后天之本,主运化,水谷精微需肾中阳气温煦,肾为先天之本,主藏精,肾中精气亦赖后天水谷精微的不断补充与化生,脾肾两脏互滋互养,相互为用。河北省名中医苏秀海主任医师经多年临证,总结DN中医病机为脾肾亏虚,固摄失权,其中痰湿、瘀血、热毒损及肾络,造成精微物质漏泄,病久阴损及阳,致阴阳两虚,浊毒内停,严重者发展为肾衰竭。黄精味甘,性平,具有补气、养阴、健脾、润肺、益肾功效,在治疗DN中作用突出。基于此,本研究通过建立DN大鼠模型,明确黄精多糖对DN的治疗作用,探讨黄精多糖治疗DN的作用机制。
本研究结果显示,模型组大鼠血糖、SCr、BUN及24 h尿蛋白含量较正常组明显升高,病理观察发现,模型组大鼠肾组织出现明显的肾小管萎缩及肾小球增生,同时有一定程度的炎性细胞浸润,与DN病理学表现一致[13]。GSH和MDA是反映机体氧化损伤程度的重要指标。本研究发现,黄精多糖可不同程度改善DN大鼠肾功能相关指标,缓解肾组织病理变化,减轻机体氧化应激损伤,且以黄精多糖高剂量组最为明显。提示黄精多糖对DN有一定治疗作用。
铁死亡与DN发生发展关系密切。糖尿病小鼠予铁死亡抑制剂Ferrostatin-1干预后,尿白蛋白肌酐比显著降低,且Ferrostatin-1可显著降低肾脏中铁蛋白及肾小管铁含量[14]。Transferrin是由结构相似的2个亚基组成的糖蛋白,是铁死亡特异标志物之一,通常每个亚基可结合1个三价铁离子,共结合2个三价铁离子,组成三价载铁Transferrin复合物(holo-Tf)[15]。holo-Tf与转铁蛋白受体(TfR)结合后通过受体介导的内吞作用进入细胞核形成核内体,因核内体酸化,holo-Tf/TfR复合物构象发生改变,铁离子随即从复合物中释放进入胞质,参与合成各类含铁酶,调控细胞生命活动[16]。铁蛋白是机体最主要的铁储存仓,最重要的作用是为细胞提供铁缓冲能力,通过储存细胞内游离铁离子维持细胞铁稳态,由2 种多肽链组成:铁蛋白轻链(FTL)和FTH[17]。FTH1有铁氧化酶活性,能催化亚铁氧化[18]。GPX4是清除脂质过氧化物的酶,在铁死亡过程中发挥核心调控作用。抑制GPX4活性或其表达缺失会引发不受控制的多不饱和脂肪酸氧化和脂肪酸自由基生成,进一步通过脂质活性氧依赖性方式促进铁死亡发生。反之,上调GPX4表达则可减少脂质活性氧诱导的细胞铁死亡[19]。本研究中模型组大鼠肾组织总铁离子含量增加,Transferrin、FTH1 mRNA和蛋白表达明显升高,GPX4 mRNA和蛋白表达明显降低,表明DN伴有铁死亡发生。而黄精多糖可通过降低DN大鼠肾组织总铁离子含量及Transferrin、FTH1表达,升高GPX4表达,抑制铁死亡,从而发挥治疗DN作用。

