牦牛DRA基因克隆测序及生物信息学分析
张 丽,王媛媛,王 瑞,刘丽霞
(西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
主要组织相容性复合物(major histocompatibility complex, MHC)是一组紧密连锁的基因簇,MHC基因的遗传多样性水平降低可导致畜禽种群内个体对突发性、传染性病原体的易感性增高,致使畜禽抗病能力单一、生存力下降[1]。牛MHC又称牛白细胞抗原(bovine leucocyte antigen, BoLA),是一类高度多态的基因座位组成的细胞表面转膜蛋白,通过向T细胞提供抗原,从而调节免疫反应,在疾病抵抗中起主要作用,与牛的疾病呈强相关[2]。MHC可分为MHCⅠ类、MHCⅡ类和MHCⅢ类抗原基因[3],MHCⅡ类抗原基因是由编码Ⅱ类抗原α链的DA基因和编码β链的DB基因构成,DA基因含有DRA、DQA、DMA、DNA和DYA共5个基因座位,其中DRA基因既是一个高度表达的基因座位,又是MHCⅡ类抗原最主要的组成部分,主要负责编码α链。大多数MHC基因具有丰富的多态性,但DRA基因较保守[4]。
大通牦牛是生长于高寒高海拔地区的唯一一个培育品种,具有明显的野牦牛特征,在生理生化、行为生态等方面与同海拔的其他牦牛亚种相比,表现出一定的特殊性,其产肉性能、繁殖性能、抗逆性能等均优于一般家养牦牛,遗传性能更加稳定。为了解和找出高寒高海拔地区牦牛抗病性的遗传基础,本研究对大通牦牛MHCⅡ类DRA基因编码区进行PCR扩增、克隆及测序,筛查该基因单核苷酸多态性(single nucleotide polymorphism, SNP)突变位点,通过生物信息学的方法对大通牦牛DRA基因突变前后编码蛋白质的理化性质、结构与功能进行对比分析,为全面解析牦牛MHCⅡ类基因结构与功能的研究奠定基础,为牦牛遗传育种方面研究提供基因方面的参考数据。
1 材料与方法
1.1 血样采集及全基因组DNA提取
青海省大通种牛场采集大通牦牛血样55份,医用采血管保存。全基因组DNA提取采用传统苯酚-氯仿抽提法进行全基因组DNA提取,去离子水溶解稀释。经1%琼脂糖凝胶电泳检测DNA提取效果,用紫外分光光度计检验每个样品DNA浓度,加蒸馏水调整样品DNA浓度至100 ng·μL-1,每20个DNA构建1个总DNA池,-20 ℃冷冻保存备用。
1.2 引物设计
根据GenBank数据库中DRA基因序列(登录号AJ505000和M30120),利用NCBI在线软件Primer-BLAST设计4对特异性引物如表1,送至苏州金唯智生物有限公司合成。

表1 大通牦牛DRA基因引物序列
1.3 PCR扩增与测序
PCR反应体系为20 μL:2×TaqPCR Master Mix 11 μL,上、下游引物各0.4 μL,基因组DNA 0.8 μL,双蒸水7.4 μL。PCR扩增步骤为:94 ℃预变性5 min;95 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸30 s,35个循环;72 ℃延伸10 min,4℃保存。扩增后的PCR产物经l%琼脂糖凝胶电泳检测,凝胶成像仪拍照并记录结果。检验良好的PCR产物经琼脂糖凝胶回收试剂盒纯化回收后直接送至苏州金唯智生物有限公司进行正反双向测序,测序结果用Lasergene7.0软件比对、校正,最终获得大通牦牛DRA基因序列,结合BLAST分析并确定SNPs位点。
1.4 克隆测序
为保证结果准确性,将清晰无杂带的PCR产物用凝胶纯化回收试剂盒纯化回收后连接到T载体,并转化到大肠埃希菌DH5α细胞内,阳性菌落接种于含氨苄青霉素的LB液体培养基中培养12 h,经转化后的克隆菌液送至杭州金唯智有限公司进行测序。使用BioEdit和Lasergene软件分析测序峰图并判断突变位点及突变方式。
1.5 等位基因频率的估算及生物信息学分析
利用Bioedit软件查看测序结果,并运用MWSnap软件对各SNPs等位基因峰高进行测量。按照文献[5-7]中介绍的在线软件对大通牦牛DRA基因编码区进行突变前后的生物信息学分析比较。
2 结果与分析
2.1 大通牦牛DRA基因扩增琼脂糖电泳图
大通牦牛DRA基因4个外显子PCR扩增片段条带清晰,特异性较好,片段大小与理论大小符合,如图1所示。

M,DL2000 marker;泳道1~4,BoLA-DRA基因Exon1-Exon4 PCR扩增产物。
2.2 大通牦牛DRA基因测序峰图结果
各SNPs测序峰图如图2所示。序列测序结果表明,大通牦牛DRA基因共有3个SNPs,以该基因全序列第1个碱基为基准,在DRA基因的第2 376 bp处存在C→T突变,位于第2外显子;第2 851 bp处存在C→G突变,位于第2内含子;第3 016 bp处存在C→A突变,位于第3外显子,分别命名为g.2376C>T、g.2851C>G、g.3016C>A。其中g.3016C>A突变为错义突变(图3),使第162位原来的亮氨酸(Leu)变成蛋氨酸(Met)。g.2376C>T属于沉默突变,不影响氨基酸的表达。BLAST比对发现,所得大通牦牛DRA基因核苷酸序列和氨基酸序列与NCBI中黄牛序列同源性达到了99%以上。
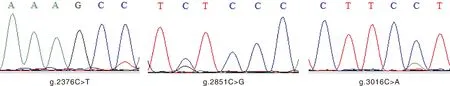
图2 大通牦牛DRA基因SNPs测序峰图

图3 大通牦牛DRA基因编码蛋白质突变前氨基酸对比
2.3 突变前后大通牦牛DRA基因编码蛋白基本信息比较
大通牦牛DRA基因发生g.3016C>A碱基突变后,编码蛋白质第162位氨基酸由亮氨酸(Leu)突变为蛋氨酸(Met),其蛋白的分子量增加了18.03 u,原子组成是C1304H2028N330O361S10,原子总数减少了2个,脂肪系数减少了1.54,不稳定系数增加了0.97,总平均亲水性减少了0.007,其他基本信息未发生改变(表2)。突变前后DRA基因编码蛋白均为疏水蛋白,且均为稳定蛋白。
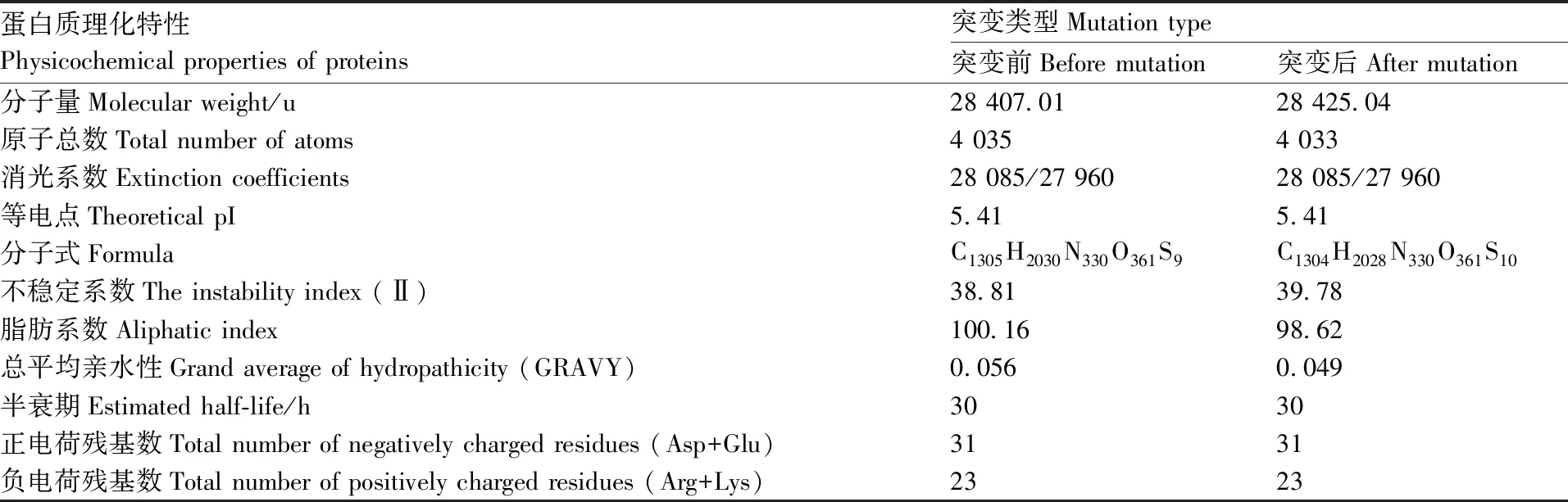
表2 大通牦牛DRA基因突变前后编码蛋白基本信息比较
2.4 等位基因频率估算
大通牦牛DRA基因各SNPs等位基因频率估算结果见表3,等位基因频率在突变前后有较大差异。

表3 大通牦牛DRA基因SNPs等位基因估算结果
2.5 大通牦牛DRA基因mRNA二级结构分析
对引起突变的2个SNPs进行mRNA二级结构预测结果表明,大通牦牛DRA基因突变前mRNA二级结构最小自由能为-241.80 kcal·mol-1,突变后g.2376C>T和g.3016C>A的最小自由能分别为-240.00 kcal·mol-1、-239.40 kcal·mol-1。由此可见,g.2376C>T和g.3016C>A降低了大通牦牛DRA基因mRNA二级结构的稳定性(图4)。

图4 大通牦牛DRA基因SNPs突变前后mRNA二级结构对比
2.6 大通牦牛DRA编码蛋白质突变前后二级结构预测分析
对引起错义突变的第162位亮氨酸(Leu)→蛋氨酸(Met)蛋白质突变前后二级结构预测分析结果表明,无规则卷曲(Cc)在突变前后所占的比例均最高,是大通牦牛DRA基因突变前后编码蛋白质二级结构的主要元件。其次是β折叠(Ee)、α螺旋(Hh)和β转角(Tt),均分散在整个蛋白质二级结构中。α螺旋(Hh)和β转角(Tt)在突变前后所占比例相同,无规则卷曲(Cc)和β折叠(Ee)所占比例在突变前后有明显差异(表4),突变后DRA基因编码蛋白二级结构β折叠(Ee)减少了8.54%,无规则卷曲增加了2.77%。

表4 蛋白质突变前后二级结构分析
2.7 大通牦牛DRA编码蛋白质突变前后三级结构预测分析
为了解蛋白质结构及其相关功能,对引起错义突变的亮氨酸(Leu)→蛋氨酸(Met)编码蛋白突变前后三级结构预测分析结果表明,1个氨基酸的改变对大通牦牛DRA基因编码蛋白质突变前后三维结构影响不大(图5)。

图5 蛋白质突变前后三级结构对比
3 讨论
MHC基因与反刍动物如牛、羊的许多疾病的抗性和易感性相关[8-9]。MHCⅡ类抗原基因最主要的组成部分是高度表达的DRA基因座,由于这类基因编码的功能区能形成抗原结合位点(antigen-binding site, ABS),其多态性直接与各种疾病的发生率有关。牛DRA基因编码MHCⅡ类抗原基因DR分子的α链,其第2外显子编码的抗原结合区在抗原呈递中发挥重要作用[10]。因此,对牛DRA基因多态性的研究主要集中在第2外显子区域。李彥清等[11]研究发现,牦牛和奶牛DRA基因第2外显子区域内存在2个SNPs(以第2外显子的第一个碱基为基准分别命名为116G>A和197T>C),内含子2区域存在3个突变位点(A>G、T>C和C>T突变)。安添午[12]分析甘南牦牛和天祝白牦牛DRA基因序列发现,存在5个不同类型的等位基因,其中Bogr-DRA*01015是新发现的等位基因,其他4个等位基因与其他牛科动物共享,这一点也说明BoLA-DRA具有明显的跨种保守性。付保强等[13]研究发现,奶牛DRA基因第1外显子第1位和第2位之间存在1个碱基T的插入。高树新等[14]研究认为,中国西门塔尔牛、三河牛DRA基因第2外显子两个突变位点形成6个基因型,其中CC基因型可能与这两种牛的乳房炎易感性有关,BC基因型可能与这两种牛的乳房炎抗性有关。对大通牦牛MHCⅡ类DRA基因扩增序列测序结果表明,第2外显子存在1个C→T转换(g.2376C>T),第2内含子存在1个C→G颠换(g.2851C>G),第3外显子存在1个C→A颠换(g.3016C>A)。各突变位点等位基因频率在突变前后有较大差异。其中g.2376C>T与李彥清等[11]在牦牛和奶牛DRA基因第2外显子上197T>C转换为同一突变位点。DNA序列上3 016 bp上发生C>A的颠换导致大通牦牛MHCⅡ类DRA编码蛋白质第162位一个氨基酸的改变(L→M)。g.2376C>T是在大通牦牛亚种群中新发现的一个沉默突变,不影响氨基酸的表达。大通牦牛DRA基因没有太多变异,这与Sena等[4]早期阐明的DRA基因在所有哺乳动物尤其是反刍动物中高度保守的观点是一致的。
大通牦牛是适应高海拔地区的新品种,具有较强的耐寒性和很好的适应性,是我国重要的牦牛遗传资源。然而,一些重要性状的遗传基础在牦牛中尚待探索。当前还没有对大通牦牛DRA基因研究的相关报道,但是对牦牛BoLA-DRA基因进行全面系统的遗传多态性研究十分有必要,可为牦牛BoLA-DRA基因遗传变异分析提供分子基础。本研究成功地利用DNA混合池扩增和直接测序法获得大通牦牛DRA基因4个外显子约779 bp,组合序列包含762 bp的开放阅读框(open reading frame, ORF)完整序列,编码253个氨基酸产物,该结果与蒲兰屏等[15]在犏牛上的研究结果完全一致。开放阅读框、外显子边界和外显子大小类似于普通牛DRA基因。开放阅读框以起始密码子ATG在核苷酸位置(20~22 bp)开始,终止密码子TGA在核苷酸位置(779 bp)终止。大通牦牛与黄牛MHCⅡ类DRA基因762 bp的编码区同源性为99%,表现出高度同源。蒲兰屏等[15]表明,犏牛与黄牛MHCⅡ类DRA基因编码区同源性高达99%,Swathi等[16]发现,印度Deoni牛与水牛的DRA基因同源性达到了97.38%,Sakaram等[17]认为,水牛DRA基因的编码区与黄牛的同源性为98%。牦牛DRA基因具有跨种特性,这一重要研究结果支持了牦牛与普通牛、瘤牛和野牛都归为牛属的观点。
DRA基因多态性的贫乏或许与BoLA-DRA基因第2外显子是构成其蛋白分子的最基本的骨架有关,也可能是由于包括牦牛在内的反刍动物在进化过程中较近物种的分离以及反刍动物在进化过程中经历的相似性。大通牦牛DRA基因编码蛋白质第162位氨基酸发生了错义突变,氨基酸由突变前的亮氨酸(Leu)突变为蛋氨酸(Met),其蛋白质的分子量28 425.04 u,原子总数4 033,脂肪系数98.62(越高越稳定),蛋白质不稳定系数39.78(小于阈值40),总平均亲水性0.049,其中亲水性氨基酸49.01%,疏水性氨基酸50.99%,为疏水性稳定蛋白,有利于其在细胞内发挥作用。蛋白质结构决定了蛋白质功能,结构发生变化时,功能也随之发生改变。因此,推测该位点可能影响牦牛DRA蛋白的生物学功能。对大通牦牛DRA基因编码区突变的2个SNPs进行mRNA二级结构分析表明,g.2376C>T和g.3016C>A自由能由突变前的-241.80 kal·mol-1减小到突变后的-240.00 kal·mol-1和-239.40 kal·mol-1。由此可知,编码区的2个碱基突变降低了大通牦牛DRA基因mRNA二级结构的稳定性。对引起错义突变的编码蛋白质突变前后二级结构预测分析表明,无规则卷曲在突变前后所占的比例均最高,是大通牦牛DRA编码蛋白质二级结构的主要元件,β-折叠、α-螺旋和β-转角分散在蛋白质二级结构中。这一结果与刘丽霞等[18]在猪SLA-DRA基因上的研究结果一致;其编码氨基酸在NCBI BLAST结果显示与黄牛相似度高达99%,三级结构预测分析表明1个氨基酸的改变对大通牦牛DRA编码蛋白质突变前后三维结构影响不大。综上所述,BoLA-DRA基因是MHC基因家族中高度保守的基因,本研究结果丰富了BoLA-DRA基因序列库,是对前人研究结果的补充,可为深入研究牦牛DRA基因结构和功能提供理论基础。
——上汽大通D90……虞展

