城固酒窖泥微生物多样性及糖代谢过程分析
陈国伟, 解修超*,2, 宋 玉,2, 邓百万,2, 胥彦明, 田国强
(1. 陕西理工大学 生物科学与工程学院, 陕西 汉中 723001;2. 陕西省食药用菌工程技术研究中心, 陕西 汉中 723001;3. 陕西省城固酒业股份有限公司,陕西 汉中 723000)
中国白酒历史悠久,按香型可分为:浓香型、清香型、酱香型、米香型和兼香型五大香型[1]。 城固位于陕南汉中盆地, 浓香型白酒已有3 000 多年酿造历史。 城固酒素有“城固佳酿味甘美,醉倒东西南北客”之誉[2]。 白酒窖泥中含有丰富的微生物,微生物的数量及种类决定了窖泥质量的好坏,直接影响酒的品质。 因此,对窖泥微生物的群落组成、多样性及基因注释等进行分析,并对微生物和环境进行双向研究,有利于白酒酿造过程的改善。
20 世纪60 年代, 我国才开始对窖泥中的微生物展开研究,目前对窖泥微生物的研究技术主要采用纯培养技术与免培养技术[3]。 传统纯培养技术分析微生物存在一定的局限性,纯培养菌株离开了白酒生产中的真实环境,无法完全反映发酵过程中各微生物之间的联系, 不能从整体上研究微生物结构,且绝大多数微生物是未培的[4-7]。 基于微生物总基因组DNA 的高通量测序法是免培养技术方法之一,以高通量及低成本为主要特征,并在此基础上保持了第一代测序的高准确性,逐渐成为目前窖泥中微生物研究的重要手段[8-9]。 高通量测序技术能全面反映窖泥中微生物的群落结构,从整体上对微生物进行研究,并可对特定微生物类群进行深入分析。
作者采用传统培养以及高通量测序法,分析城固酒窖泥中的菌群组成和基因功能,为进一步筛选及应用功能菌株来调控改善城固酒的品质提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 窖泥样品: 陕西省城固酒业股份有限公司; 细菌基因组DNA 提取试剂盒、 真菌基因组DNA 提取试剂盒:安诺伦(北京)生物科技有限公司产品。
1.1.2 试剂 牛肉浸粉、氯化钠、蛋白胨、葡萄糖、硫酸镁、磷酸二氢钾等:均为分析纯。
1.1.3 培养基 孟加拉红培养基、察氏培养基、YPD培养基: 北京奥博星生物技术有限责任公司产品;牛肉膏蛋白胨培养基、 葡萄糖马铃薯琼脂培养基:作者所在实验室配制。
1.2 仪器设备
LS-B50L 高压蒸汽灭菌锅:上海申安医疗器械厂;BSA8201 电子分析天平: 北京赛多利斯科学仪器有限公司;Alliance 4.7 荧光凝胶成像仪: 英国UVItec 公司;TANON EPS300 凝胶电泳仪: 上海天能科技有限公司;Vortex Genius 3 涡旋混合仪:德国IKA 集 团;TC-4000 热 循 环PCR 扩 增 仪: 英 国TECHEN 公司;ZWY-2112B 恒温培养振荡器:上海智诚分析仪器制造有限公司。
1.3 传统法分析窖泥微生物多样性
1.3.1 窖泥微生物分离纯化 称取10.00 g 窖泥样品,倒入90 mL 无菌水锥形瓶中,140 r/min、37 ℃富集培养30 min。 利用传统稀释涂布平板法分离窖泥微生物,从分离平板挑取形态不同的单菌落于新的固体培养基上,多次划线纯化,获得纯化菌株。 真菌于4 ℃马铃薯琼脂糖培养基斜面传代保藏, 细菌于-20 ℃体积分数20%的甘油中保藏。
1.3.2 窖泥微生物鉴定 形态学观察:将筛选的目标菌株在相应的平板上划线, 分别于37 ℃和28 ℃培养后观察菌落的形态特征。
分子生物学鉴定:细菌采用水煮法提取基因组DNA,用27F(5′-AGAGTTTGATCCTGGCCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)通用引物对细菌基因组DNA 扩增。PCR 反应条件为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,72 ℃再延伸10 min,4 ℃保存, 共33 个循环。 真菌采用CTAB 法提取基因组DNA,用ITS1 和ITS4 通用引物对真菌基因组DNA 扩增,PCR 反应条件为:94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,72 ℃再延伸10 min,4 ℃保存,共33 个循环。 PCR 产物经琼脂糖凝胶电泳检测合格后送至生工生物工程(上海)股份有限责任公司测序, 结果在NCBI 的GenBank 数据库进行BLAST 序列比对,选择分类信息较为完整且相似度高的序列确定同缘关系。
1.4 高通量测序分析窖泥微生物多样性
1.4.1 样品的预处理 取适量窖泥放入灭菌的2 mL 离心管中,离心后取沉淀进行提取。
1.4.2 样品总DNA 提取 采用磁珠法提取DNA,在裂解液和蛋白酶共同作用下裂解消化,经结合液和磁珠吸附纯净DNA, 用1 g/dL 琼脂糖凝胶电泳(电压:200 V;时间:30 min)检测DNA 完整性,无降解,用Qubit 定量检测gDNA 质量浓度,确保达到构建二代测序文库要求。
1.4.3 16S rRNA、ITS 的扩增、测序与分析 采用细菌提取试剂盒和真菌提取试剂盒提取gDNA。 细菌引物采用341F (5′-CCTACGGGNGGCWGCAG) 和805R(5′-GACTACHVGGGTATCTAATCC),真 菌 引物采用ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA)和ITS2(5′-GCTGCGTTCTTCATCGATGC)对靶序列扩增后测序,测序得到的数据进行微生物多样性分析。
1.4.4 宏基因组测序和数据分析 取质量合格的gDNA 样品,对DNA 进行片段化处理,先将测序的原始数据通过FastQC 软件进行质量评估, 并通过Trimmomatic 软件进行过滤处理, 得到相对准确的有效数据进行序列拼接,将组装后的序列结果进行ORF 预测,得到具有潜在功能的基因,然后基于不同的数据库进行物种和功能基因的注释与分类。
2 结果与分析
2.1 窖泥微生物分离鉴定结果
利用传统稀释涂布分离法从窖泥中分离出细菌49 株,共21 属;真菌21 株,共14 属,其中包括3株酵母菌。 图1 为部分窖泥微生物菌落形态图。
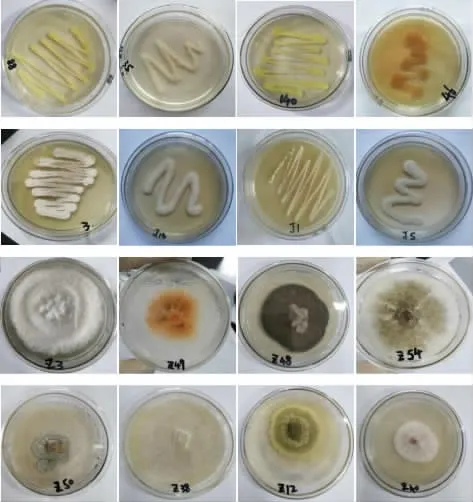
图1 部分窖泥微生物菌落形态Fig. 1 Colony morphology of microorganism in some pit mud
细菌菌株经过16S rRNA 扩增后测序, 真菌菌株经过ITS 基因扩增后测序, 测序结果在NCBI 上BLAST 比对,并用MEGA7.0 构建系统发育树,见图2 和图3。
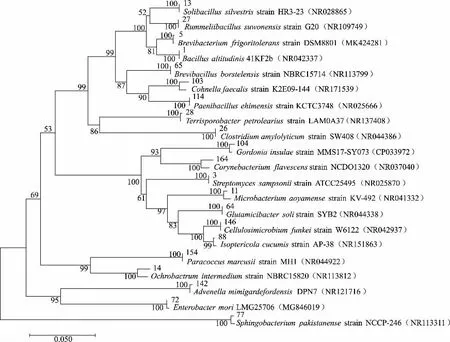
图2 窖泥细菌系统发育树Fig. 2 Phylogenetic tree of bacterial in pit mud
通过鉴定和系统发育分析可知,窖泥中细菌可分为Bacillus、Streptomyces、Brevibacterium、Clostridium、Terrisporobacter、Enterobacter 等。 真 菌 可 分 为Aspergillus、Cladosporium、Monascus、Penicillium、Debaryomyces、Rhodotorula 及Saccharomyces 等。
2.2 高通量测序结果统计分析
2.2.1 测序数据质量评估 城固酒窖泥样品基因组包含44 967 652 条序列,G+C 比例为51.15 %。由图4 可以看出,序列读长为150 bp,图中所测碱基质量整体都在Q{35}左右,没有太大的质量值波动,表明本次测序结果较好。 根据碱基的位置,对每个位置上的A、T、C、G 的数量进行统计, 判断AT、CG是否有分离现象和过表达序列。 由图5 可知,因随机引物扩增偏差的原因, 会导致前面10 bp 的碱基出现杂乱的波动,之后所有位点上的每条线平等且接近,呈水平线,表明测序样品未污染。
图4 碱基质量分布图Fig. 4 Distribution of base quality
图5 碱基比例分布图Fig. 5 Distribution of base content
2.2.2 菌群多样性分析 单样品的多样性分析不仅可以反映微生物群落的丰度和多样性,还可通过一系列统计学分析指数估计环境群落的物种丰度和多样性。 作者以Alpha 稀释性曲线和多样性指数分析样本,研究测序数据量的合理性和单个样品内部物种的丰度及多样性。 样本有效序列计算后的Alpha 稀释性曲线见图6, 多样性指数分析见表1,Shannon 指数见图7。 本实验中稀释性曲线达到平缓,说明本次测序数据量足够大,可以反映样品中绝大多数的微生物物种信息,文库覆盖率反映了测序结果的准确性, 能代表样本的真实情况。 真菌Chao1 指数大于细菌Chao1 指数, 说明真菌物种总数大于细菌物种总数。 细菌Simpson 指数远大于真菌Simpson 指数,说明细菌的群落多样性远高于真菌。
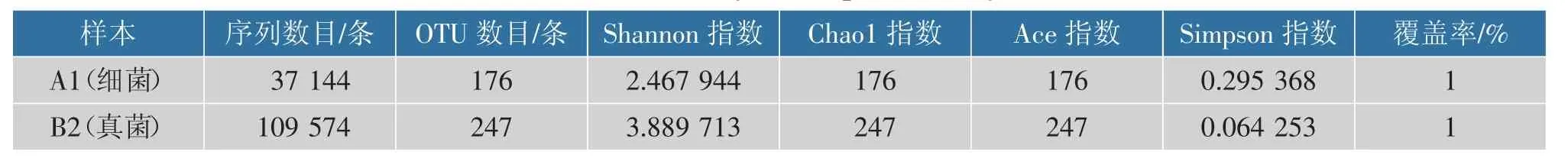
表1 Alpha 多样性分析Table 1 Analysis of alpha diversity
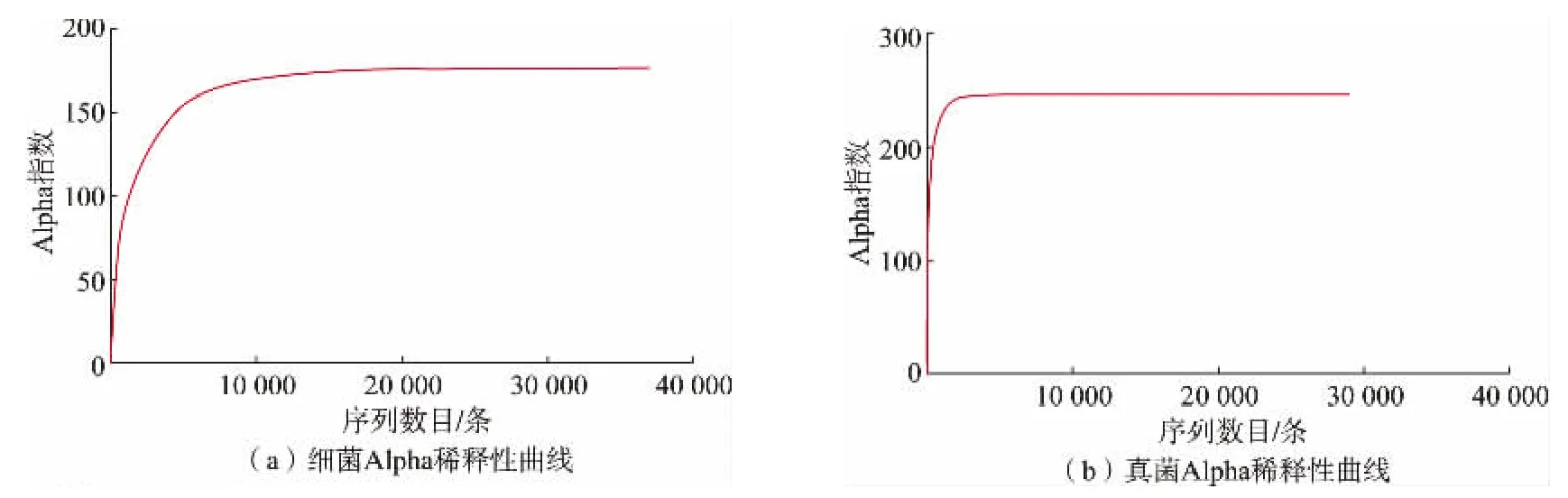
图6 Alpha 指数稀释性曲线Fig. 6 Rarefaction curve of alpha index
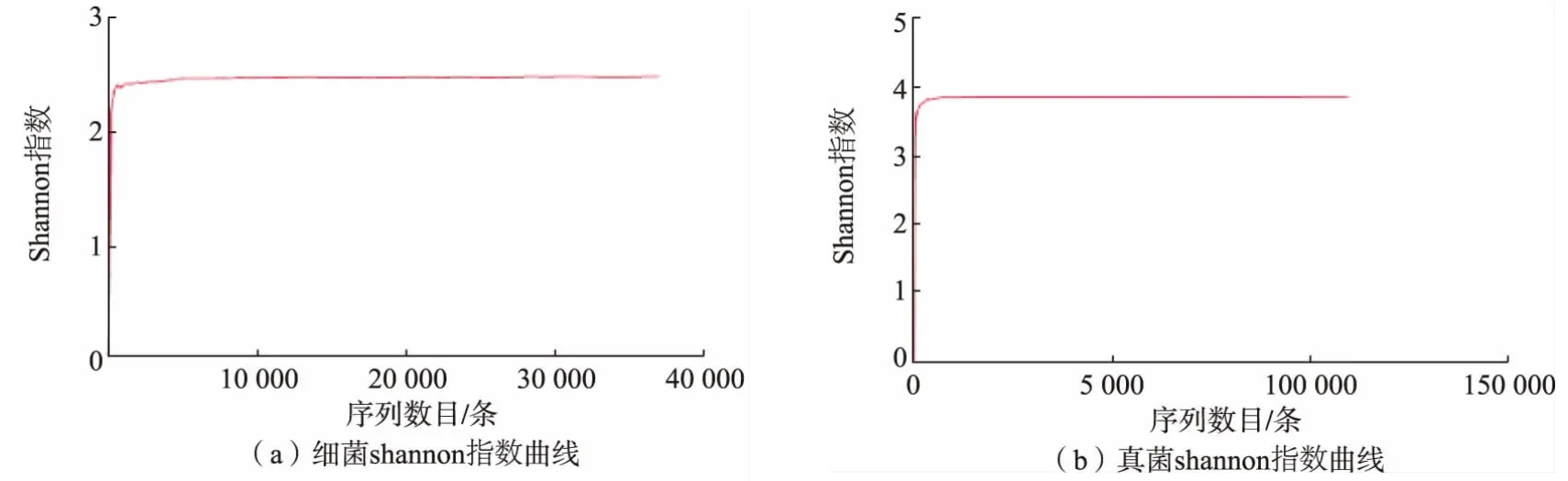
图7 Shannon 指数稀释性曲线Fig. 7 Rarefaction curve of Shannon index
2.2.3 细菌与真菌群落结构分析 城固酒窖泥属水平分类结果见图8。 细菌(A1) 在属水平上,测序共划分了68 个菌属和其他未分类种群, 但只有12个属相对丰度在1%以上,主要核心菌属为Petrimonas(相对丰度为10.54%)、Bacillus(相对丰度为9.21%)、Sedimentibacter(相对丰度为2.37%)、Clostridium(相对丰度为1.21%)。 真菌(B2)在属水平上,测序共划分了149 个菌属和其他未分类种群, 但只有16 个属丰度在1%以上,主要核心菌属为Issatchenkia(相对丰度为17.12%)、Debaryomyces (相对丰度为13.83%)、Pichia(相对丰度为8.00%)、Aureobasidium(相对丰度为7.64%)、Aspergillus (相对丰度为4.66%)。
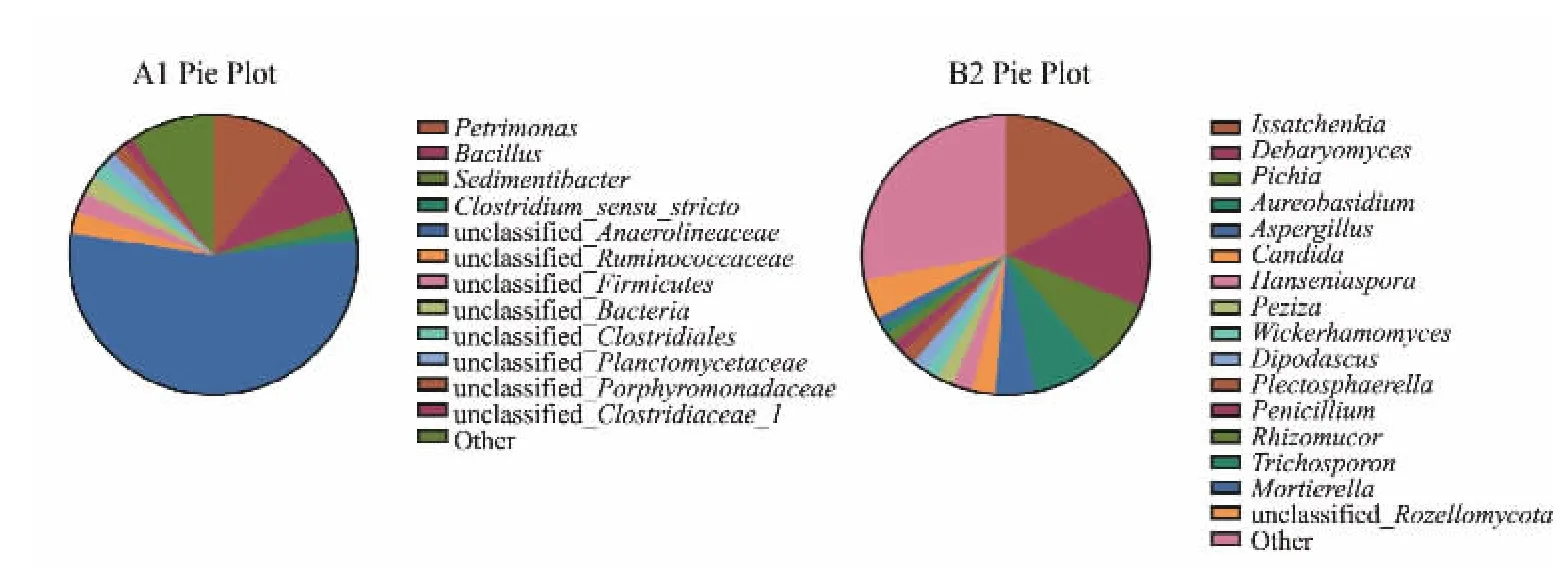
图8 细菌与真菌群落结构Fig. 8 Community structure of bacteria and fungi
2.2.4 KEGG 功能注释分析 城固酒窖泥中共注释了236 022 个unigene。从属于KEGG 数据库中六大等级分类的42 个KEGG 二级通路见图9。六大类分别为环境信息处理 (26 363,11.17%)、 代谢通路(149 319,63.26%)、遗传信息处理(30 109,12.76%)、细 胞 过程 (15 080,6.39%)、 人 类疾病(10 323,4.37%)和生命系统(4 848,2.05%)。 富集差异表达基因最多的10 个二级通路为碳水化合物代谢(carbohydrate metabolism,28 434)、 概观(overview,27 511)、 氨基酸代谢 (amino acid metabolism,21 910)、能量代谢(energy metabolism,17 715)、膜运输(membrane transport,16 820)、辅因子和维生素代谢(etabolism of cofactors and vitamins,13 552)、核苷酸 代 谢 (nucleotide metabolism,13 197)、 翻 译(translation,12 916)、信号传导(signal transduction,9 477)、复制和修复(replication and repair,9 402)。其中有149 319 个unigene 参与微生物新陈代谢,碳水化合物代谢为主要代谢活动, 有15 条碳水化合物代谢途径,包括丙酮酸代谢、糖酵解和糖异生、氨基糖和核苷酸糖代谢以及丁酸代谢等。 这些代谢途径表明窖泥具有良好的糖类代谢及风味物质合成的能力。还原糖与氨基酸、蛋白质之间发生的一系列复杂反应[10-11]可生成多种香味物质,也可生产高微量成分的调味液来提高白酒的香味强度[12]和丰富白酒风味,如酮、醛、吡嗪、呋喃、酚类等[13],而四甲基吡嗪还具有扩张血管、改善微循环及抑制血小板集聚等作用[14]。 窖泥样品中代谢功能旺盛的碳水化合物和氨基酸代谢为还原糖与氨基酸、 蛋白质之间的反应提供了基础。
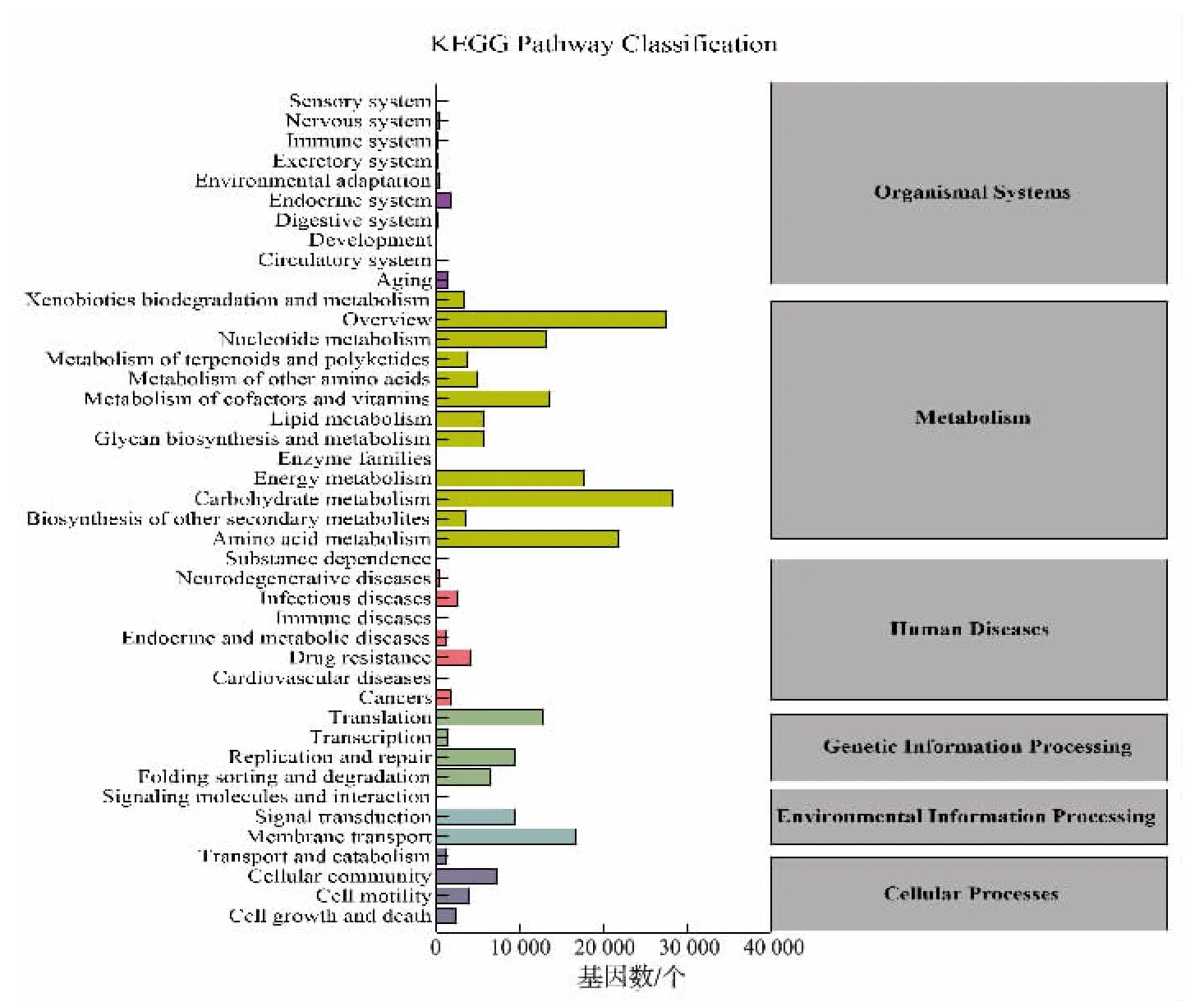
图9 KEGG pathway 功能注释分类Fig. 9 Functional annotation classification in KEGG pathway
2.2.5 CAzY 功能注释分析 CAzY 是碳水化合物活性酶的数据库,主要包括糖苷水解酶(GHs)、糖基转移酶(GTs)、多糖裂解酶(PLs)、糖类酯解酶(CEs)和氧化还原酶(AAs)。此外,还包括碳水化合物结合模块(CBMs)。将宏基因组基因集序列与CAzY 数据库比对,共注释到210 个碳水化合物酶类。 窖泥样品中注释到的酶类及数量见图10。在窖泥样品中糖苷水解酶和糖基转移酶类数量最多,占总数的74%。糖苷水解酶能水解寡糖、多糖等各种含糖化合物的糖苷键,生成单糖、寡糖或糖复合物,在寡糖、芳香基糖苷的合成、氨基酸和多肽的糖基化方面发挥了重要作用[15]。 糖基化反应是生物体内最为重要的转化反应[16],它们将活性糖基从糖基供体转移到糖基受体,从而影响糖基受体的水溶性,改善其化学稳定性和生物活性,同时维持自身代谢的平衡[17-18]。 糖基转移酶基因分为98 个家族糖基转移酶, 能催化各种二糖、寡聚糖及多聚糖合成[19-20]。 窖泥中丰富的糖苷水解酶和糖基转移酶有利于糖类的生成、转化及代谢。

图10 CAzY 功能注释分类Fig. 10 Functional annotation classification in CAzY
2.2.6 COG 功能注释分析 将基因集蛋白质序列与COG 数据库比较, 对预测蛋白质进行归类和功能注释,绘制功能注释统计图,见图11。窖泥样品中预测蛋白质分属于23 个主要的功能大类, 未知功能的预测蛋白质最多,其次为大概的功能预测。 这与郑琦采用宏基因组技术研究浓香型白酒香味类微生物生物质代谢相关的基因结果一致[21]。 未来随着生物信息学的发展,更多的计算方法和技术将被应用到对这部分预测蛋白质的研究。
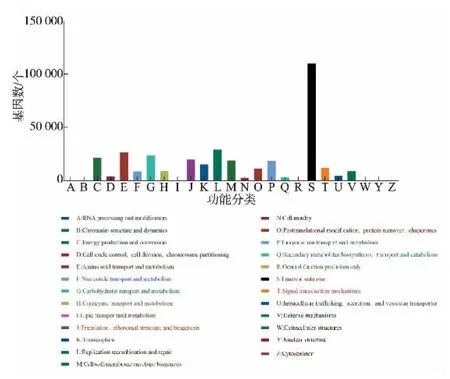
图11 COG 功能注释分类Fig. 11 Functional annotation classification in COG
2.3 糖代谢转运系统基因分析
2.3.1 糖转运系统 窖泥中微生物的糖转运系统分布见表2。 通过对糖转运系统分析发现, 山梨糖醇、麦芽糖、甘露糖、海藻糖、N-乙酰氨基葡萄糖、甘露醇、葡萄糖(α-糖苷)、纤维二糖可通过磷酸转移酶系统、渗透酶蛋白和ABC 转运蛋白3 种转运系统转运至细胞内代谢;乳糖、阿拉伯糖、鼠李糖、D-阿洛糖和低聚糖等可以通过渗透酶蛋白和ABC 转运蛋白系统2 种方式转运;蔗糖、半乳糖、半乳糖醇和α-葡萄糖苷只能由磷酸转移酶系统转运;果糖可由磷酸转移酶系统和ABC 转运蛋白系统2 种方式转运;纤维二糖可由磷酸转移酶系统和渗透酶蛋白系统2 种方式转运;木二糖只能由特异性ABC 蛋白转运系统转运。 窖泥中甘露糖、甘露醇、甲基半乳糖苷、果糖、蔗糖、乳糖分别有控制基因拷贝数477、73、233、127、42、60 个,表明白酒酿造过程中窖泥微生物对甘露糖的转运能力最强。
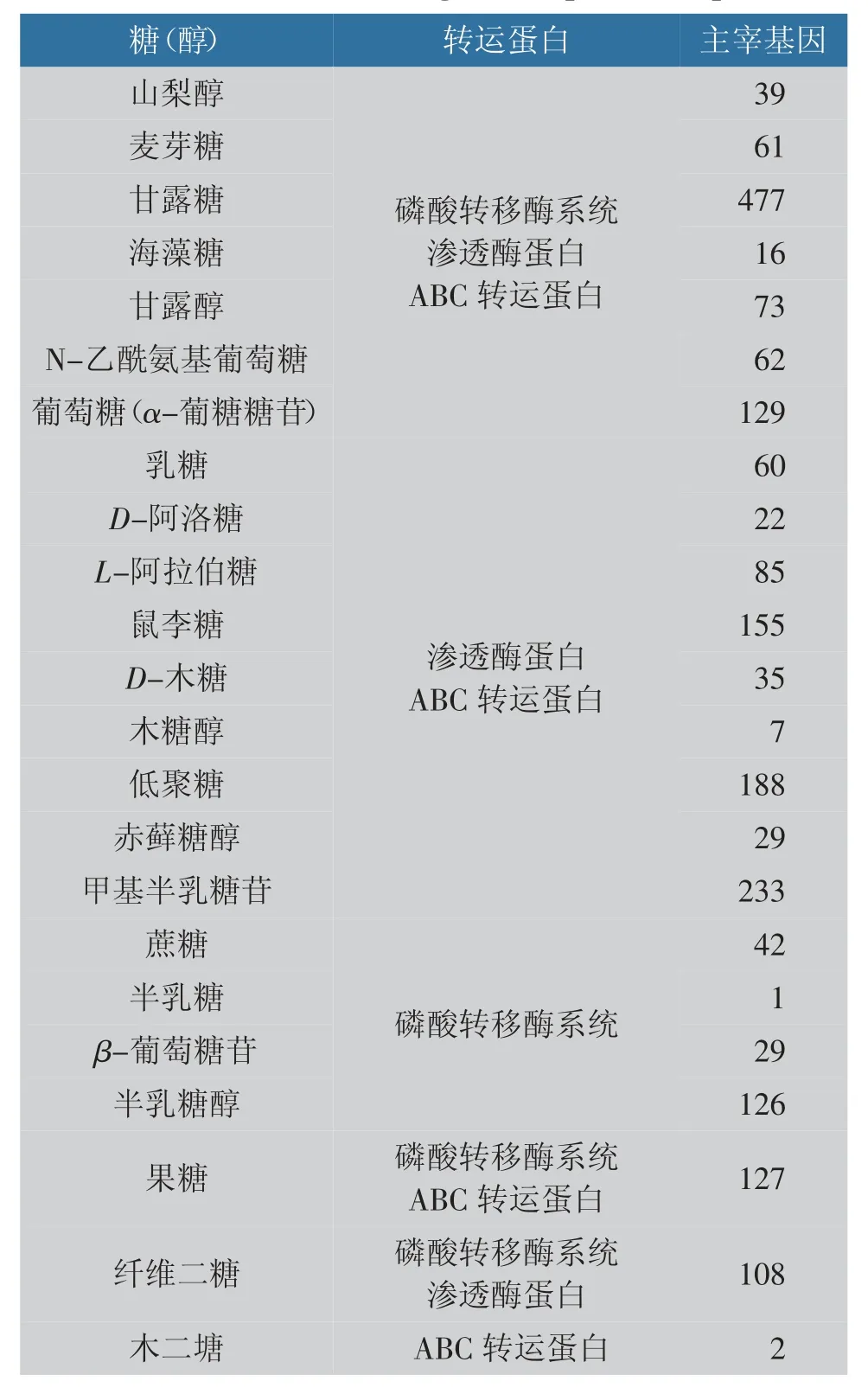
表2 窖泥糖转运系统的分布Table 2 Distribution of sugar transporters in pit mud
2.3.2 糖类物质转化成糖酵解途径中间产物的过程分析 窖泥微生物基因组中参与将果糖和甘露糖降解形成糖酵解中间产物的特色代谢通路见图12。 参与将糖类物质转化为糖酵解中间产物的关键酶基因见表3。
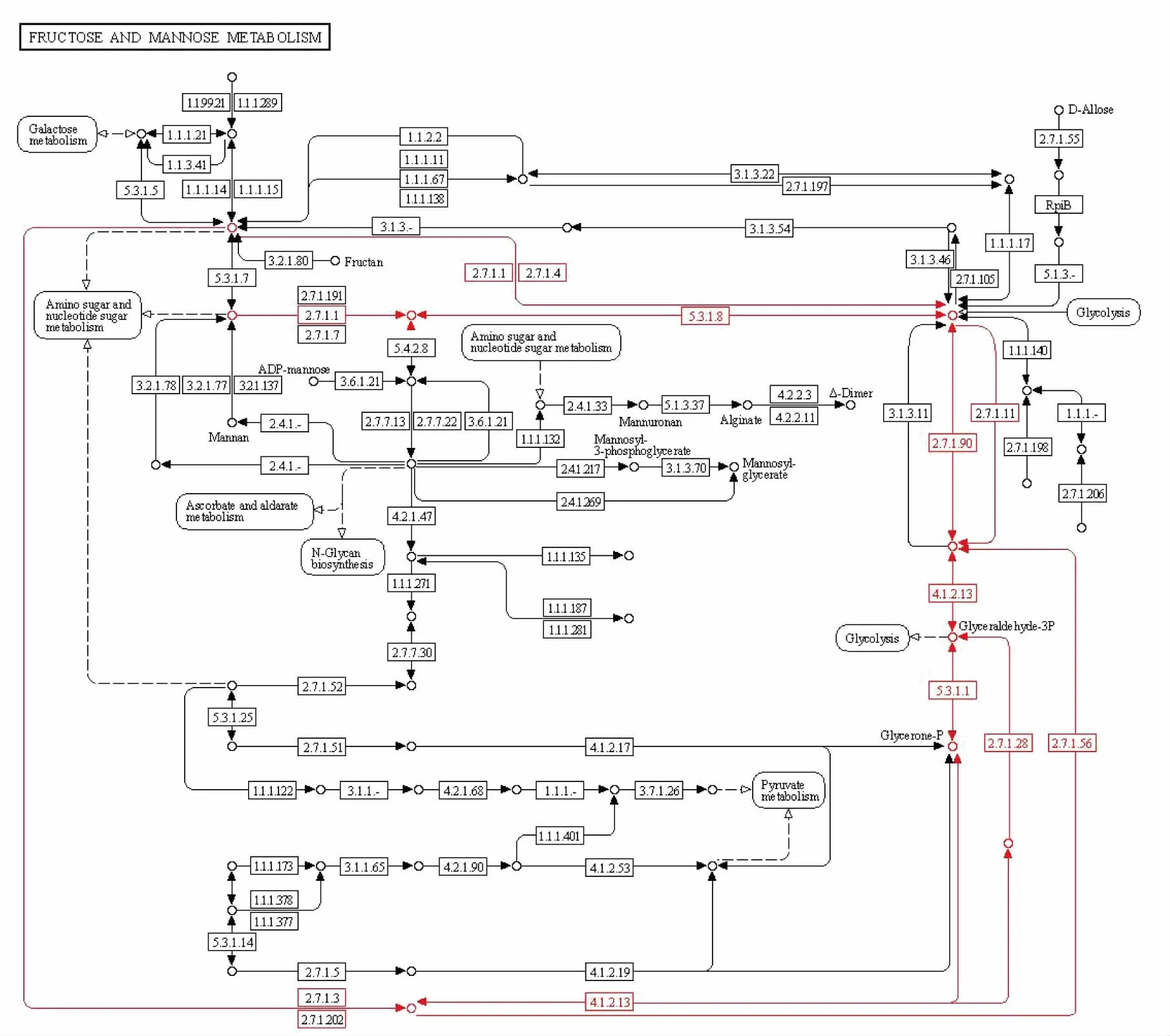
图12 果糖和甘露糖降解形成糖酵解中间产物的过程Fig. 12 Degradation of fructose and mannose into the glycolytic intermediates
1)D-1-磷酸甘露醇的转化 经过磷酸转移酶系统进入细胞的糖都会发生磷酸化。 甘露醇在磷酸转移酶系统酶II 的作用下发生磷酸化, 最终形成D-1-磷酸甘露醇进入细胞,在1-磷酸甘露醇-5-脱氢酶的作用下最终转化为糖酵解中间产物β-D-6磷酸果糖。
2)6-磷酸山梨醇的转化 山梨醇在磷酸转移酶系统酶II 的作用下经磷酸化形成6-磷酸山梨醇进入细胞, 在6-磷酸山梨醇-2-脱氢酶的作用下最终转化成糖酵解中间产物β-D-6 磷酸果糖。
3)麦芽糖的转化 麦芽糖通过渗透酶蛋白进入细胞,在麦芽糖磷酸化酶的作用下直接转化成糖酵解中间产物β-D-1-磷酸葡糖,参与糖酵解途径。
4)D-6-磷酸甘露糖的转化 甘露糖经磷酸转移酶系统最终形成D-6-磷酸甘露糖进入细胞,在6-磷酸甘露糖异构酶的作用下转化成β-D-6-磷酸果糖。
5)海藻糖的转化 海藻糖可通过渗透酶蛋白、ABC 转运蛋白及磷酸转移酶系统3 种转运方式进入细胞,在海藻糖磷酸化酶的作用下转化成糖酵解中间产物β-D-1-磷酸葡糖, 后者可进一步在β-磷酸葡萄糖变位酶的作用下转化成D-6-磷酸葡糖。
6)N-乙酰氨基葡萄糖的转化 N-乙酰氨基葡萄糖通过渗透酶蛋白、ABC 转运蛋白及磷酸转移酶系统3 种转运方式进入细胞, 之后经过N-乙酰氨基葡萄糖焦磷酸化酶和N-乙酰-1-磷酸氨基葡萄糖转移酶、 磷酸葡萄糖胺变位酶、6-磷酸果糖转氨酶、6-磷酸葡萄糖异构酶等5 种酶的催化下最终转化为糖酵解中间产物α-D-6-磷酸葡糖。
7)6-磷酸纤维二糖的转化 纤维二糖通过渗透酶蛋白和磷酸转移酶系统进入细胞,在磷酸转移酶系统酶II 的作用下磷酸化形成6-磷酸纤维二糖。在β-葡萄糖苷酶作用下转化为糖酵解中间产物α-D-1-磷酸葡糖。
8)乳糖的转化 乳糖通过渗透酶蛋白和ABC转运蛋白进入细胞,经过2 条途径转化为糖酵解的中间产物α-D-6-磷酸葡糖。 途径I、II 分别是在α-半乳糖苷酶、己糖激酶和葡萄糖激酶、醛糖1-表异构酶、半乳糖激酶、UPD 葡萄糖-1-磷酸己糖尿苷酰转移酶和磷酸葡萄糖变位酶的作用下生成糖酵解中间产物α-D-6-磷酸葡糖。
9)D-1 磷酸果糖的转化 果糖通过磷酸转移酶系统进入细胞,最终形成D-1-磷酸果糖,而后通过3 条途径转化成糖酵解中间产物D-3-磷酸甘油醛。 3 条途径的关键酶分别为I 类果糖二磷酸醛缩酶和磷酸丙糖异构酶、1-磷酸果糖激酶和I 类果糖二磷酸醛缩酶、I 类果糖二磷酸醛缩酶和丙糖激酶。
3 讨 论
采用传统分离培养方法得到的细菌主要属有Bacillus、Brevibacterium、Enterobacter 等, 真菌主要属有Aspergillus、Cladosporium、Monascus、Penicillium等。 通过高通量测序结果显示,窖泥中细菌和真菌的优势属为Petrimonas(10.54%)、Bacillus(9.21%)、Issatchenkia(17.12%)、Debaryomyces(13.83%)等。细菌和真菌的传统分离与高通量测序结果存在些许偏差,这是因为窖泥中大多数微生物为未/难培养微生物,培养条件要求苛刻,很难做到全部纯培养且只能培养出微生物群落中数量占优势的菌群,但传统分离筛选技术仍占有重要的地位[22]。因此,在分析窖泥微生物的群落结构时要采用2 种或多种方法,才能得到更为全面、客观的结果。通过检索文献[23-27]发现,城固酒细菌群落组成分类上与同香型白酒具有一定的相似性, 特别是Bacillus 在同香型白酒中基本均存在, 这是因为窖泥发酵过程中抗逆性强,耐高温的芽孢能适应复杂的酿造环境,并能够为白酒提供香味物质[28]。 但核心菌属与其他白酒产区存在较大差异,城固酒细菌属以Petrimonas 为主,为易降解碳水化合物的发酵细菌[29-30];真菌属多为酵母菌, 两者显著区别于其他产区的群落结构,这表明城固酒糖代谢途径更为活跃也更复杂,出酒率更快更高,使得城固酒酿造周期显著缩短于其他产区且具有自身独特的白酒风味。 由此可见,不同酿造环境、原料、水质等的不同对窖泥中微生物的多样性影响很大,这造成了不同地域白酒风味特点的差异。
4 结 语
通过KEGG 数据库比对,共注释了236 022 个unigene,碳水化合物代谢为主要代谢活动,有15 条碳水化合物代谢途径。通过CAzY 数据库比对,共注释到210 个碳水化合物酶类,其中糖苷水解酶和糖基转移酶类数量最多,占碳水化合物活性酶总数的74%,这可能与城固窖泥中以Petrimona 主的易降解碳水化合物的发酵细菌有关,在大量糖基转移酶和糖苷水解酶的作用下能快速降解糖类,从而为糖类的进一步生成、转化及代谢提供了物质基础和反应条件。
在糖代谢途径中,窖泥编码了多种糖类的糖转运系统基因,通过3 种不同的转运方式将相关糖类物质转运至细胞内,具备将多种糖类物质转化为糖酵解中间产物的关键酶基因,其中对甘露糖的转运能力最强,这与夏亚男采用宏基因组测序分析酒醅糖转运系统结果一致[30]。 甘露糖作为葡萄糖的异构体和多种多糖的组成成分,通过多种糖代谢途径转化和生成,并参与糖酵解过程。 作者在分析窖泥微生物多样性的基础上,进一步研究了窖泥微生物代谢活动及糖代谢过程的关键基因,为后续进一步筛选及应用功能菌株,分析其在代谢通路中的作用和关键酶基因,为城固酒窖泥的改善、制备及品质的提升提供理论依据。

