空肠弯曲菌β1,3-半乳糖基转移酶(CgtB)突变体的设计及活性鉴定
邓梦雪, 杨秀怡, 龙云峰, 刘若兰, 刘行辉, 苏延停
(湖北科技学院 基础医学院,湖北 咸宁 437100)
糖基化修饰是一种最普遍的蛋白质翻译后修饰之一,调控蛋白质的诸多功能,例如蛋白质折叠、蛋白质的识别等[1]。 在近几十年,研究者已经在脊椎动物中发现了几百种糖基转移酶, 合成了7 000 多种糖结构[2]。 不同的糖链组成和连接方式使糖结构变得十分复杂,这给分析糖基化修饰造成了很大的困难[3]。
蛋白质的糖基化修饰根据连接的基团和氨基酸分为N-连接糖基化修饰和O-连接糖基化修饰。N-连接糖基化修饰过程起始于内质网,成熟于高尔基体,共价连接在天冬酰胺的氨基上。 而O-连接糖基化修饰主要发生在高尔基体,共价连接在丝氨酸或苏氨酸等的羟基上。O-连接糖基化修饰一般是以GalNAc 为第一个单糖直接结合氨基酸上,随后其他的单糖继续添加到GalNAc 后延伸。 缩短的O-连接糖链特别是只含有一个单糖即O-GalNAc 修饰在很多肿瘤细胞里出现了高表达,所以O-GalNAc 修饰又被称为肿瘤相关抗原即Tn 抗原[4]。 目前仍然不是很清楚Tn 抗原在肿瘤发展过程中到底扮演着什么样的角色。 在结肠直肠癌中,Tn 抗原可以结合树突状细胞和巨噬细胞表面的半乳糖凝集素即MGL,导致这些细胞活性受到抑制,最终肿瘤细胞发生逃逸[4]。 在乳腺癌中,高表达的Tn 抗原可以通过招募Galectin-3 和MUC1 使肿瘤细胞能够吸附在内皮细胞上,从而促进了肿瘤细胞的转移[5]。
目前识别O-GalNAc 修饰的工具很有限, 有很多文献报道能够识别O-GalNAc 修饰的单克隆抗体, 但是大部分抗体对O-GalNAc 修饰的识别依赖于2 个以上连续的O-GalNAc 修饰, 有些单克隆抗体还会对氨基酸序列有一定的依赖性,这样就导致了这类单克隆抗体可能对很多O-GalNAc 修饰的蛋白质的识别不敏感, 不适用于O-GalNAc 修饰的大规模鉴定[6-7]。 而凝集素仍然是广泛应用于识别这种修饰的有力工具,这些凝集素大多来源于植物和真菌。 目前发现了有很多凝集素可以识别O-GalNAc修饰,例如凝集素VVL、TL2、MPL、DBA 和Ricin 等[8]。这些报道识别O-GalNAc 修饰的凝集素都是由二聚体或者四聚体通过非共价连接, 特异性不专一,会结合其他的单糖例如galactose 末端糖结构。 综合而言, 目前并没有一个对O-GalNAc 修饰十分特异的凝集素,识别工具的缺乏也导致了对O-GalNAc 修饰的研究十分困难。
CgtB 是来源于空肠弯曲菌的β1,3-半乳糖基转移酶,CgtB 已经广泛用于体外合成O-连接糖基化修饰, 例如应用多操纵子原核表达元件同时表达CgtB、ppGalNAc-T2 糖基转移酶和目的蛋白质,成功表达出含有O-连接糖基化修饰的目的蛋白质[9]。对CgtB 的结构研究表明,不同菌株的CgtB 的N 端前108 个氨基酸高度保守, 可能是供体UDP-半乳糖的结合位点,而C 端则是受体糖蛋白(O-GalNAc修饰蛋白质)的结合位点,同时C 端去除30 个氨基酸后偶联MBP 标签会提高酶的效率[10]。对于糖基转移酶的改造有很多尝试,目前已有用来源于产气荚膜梭菌的糖苷水解酶的突变 (突变了活性位点,保留了糖结合活性)来识别相应糖基化修饰[11-12]。 对N-乙酰葡糖胺转移酶I(hGnT-I)的突变(截除N 端跨膜域)仍然能催化特异性糖基化[13]。作者所在团队对CgtB 进行基因改造, 将其N 端部分序列和C 端末尾30 个氨基酸删除, 从而只保留CgtB 对OGalNAc 修饰的结合活性。 通过原核表达,成功纯化出突变体CgtB 蛋白质即Cgt1, 通过糖蛋白结合实验证明了Cgt1 保持了结合O-GalNAc 的活性,并且可以作为识别肿瘤细胞中O-GalNAc 修饰的工具,这为进一步研究O-GalNAc 修饰打下了基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和培养基 pMal-c5x 质粒、克隆菌DH5α 和表达菌BL21(DE3):购于武汉擎科生物公司,引物合成及基因测序由武汉擎科生物公司完成;LB 培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠10 g/L;LA 培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠10 g/L, 琼脂粉20 g/L,121 ℃高压蒸汽灭菌20 min 后备用。
1.1.2 主要试剂和抗体 Taq DNA 聚合酶、限制性核酸内切酶Nde I 和EcoRⅠ、DNA Ligation Kit、氨苄青霉素、MBP 层析柱及填料、丽春红染料:购于碧云天生物技术公司;考马斯亮蓝R-250 染料:购于Biosharp; 免疫印迹检测及ELISA 所用抗体: 购于Proteintech。
1.2 方法
1.2.1 CgtB 突变体Cgt1 的改造方案 首先将CgtB的C 端去除30 个氨基酸, 再将CgtB 的N 端去除30 个氨基酸即为Cgt1。改造的基因序列由生工生物工程(上海)股份有限公司合成。
1.2.2 Cgt1 突变体的目的基因扩增及质粒载体pMal-c5x 的双酶切 以改造的Cgt1 突变体的合成基因序列为模板进行扩增,1 g/dL 琼脂糖凝胶电泳,电压140 V, 电泳15 min, 回收扩增的目的基因片段。 Cutsmart Buffer 5 μL,pMal-c5x 质粒3 μg,限制性核酸内切酶Nde I 和EcoRⅠ各2 μL, 补ddH2O至50 μL,37 ℃双酶切30 min, 经1 g/dL 琼脂糖凝胶电泳回收。
1.2.3 重组质粒pMal-c5x-Cgt1 体系的构建 以10 μL DNA 无缝连接酶、3 μL Cgt1 基因扩增片段、1 μL pMal-c5x 质粒双酶切产物,补6 μL ddH2O 至20 μL 体系,50 ℃、20 min 无缝连接得重组质粒pMal-c5x-Cgt1,重组质粒图谱见图1。 取10 μL 重组质粒pMal-c5x-Cgt1 转入50 μL 的DH5α 感受态细胞中, 冰浴30 min,42 ℃热激1 min, 加入1 mL LB 培养基,37 ℃培养1 h,3 000 r/min 离心1 min。取下层100 μL 涂布于氨苄青霉素抗性平板, 过夜培养后挑取单菌落,37 ℃培养9 h 后菌液进行PCR初步验证,后进行单向测序进一步验证。 取阳性菌液扩大培养提取质粒, 将所提质粒转化到表达菌BL21(DE3)中。
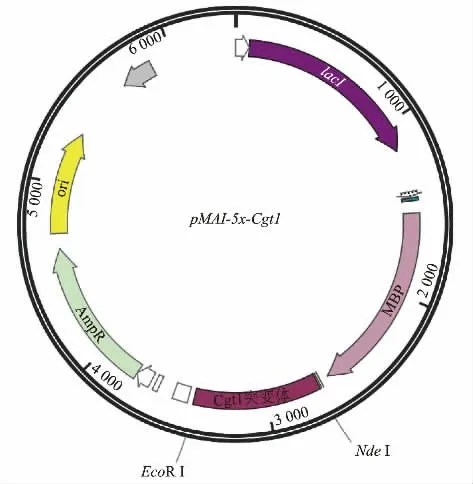
图1 重组质粒pMal-c5x-Cgt1 的质粒图谱Fig. 1 Plasmid profile of the recombinant plasmid pMalc5x-Cgt1
1.2.4 Cgt1 的少量诱导 取Cgt1 阳性菌液于1 mL LB 培养基中,37 ℃扩大培养, 随后以1∶100 菌液体积比转入到10 mL LB 培养基中,37 ℃扩大培养2.5 h,至OD 值达对数期即0.6~1.0,然后加入IPTG使其终浓度为1 mmol/L,16 ℃、160 r/min 诱导12 h。菌液于12 000 r/min 离心1 min,弃上清液,用1 mL PBS 缓冲液重悬混匀沉淀。 超声破碎后于4 ℃、12 000 r/min 离心20 min。
1.2.5 Cgt1 的大量表达及纯化 取阳性菌液在1 mL LB 培养基中过夜扩大培养, 以1∶100 菌液比转入到10 mL LB 培养基中培养7 h, 随后转入到1 L的LB 培养基中,扩大培养约2.5 h 使OD 值达到对数期即0.6~1.0,然后加入IPTG 使终浓度为1 mmol/L,16 ℃、160 r/min 诱导12 h。将1 L 菌液于4 000 r/min离心20 min, 去上清液, 用40 mL 0.01 mol/L MBP缓冲液(20 mmol/L Tris-HCl、200 mmol/L NaCl、1 mmol/L EDTA, pH 7.4)将沉淀重悬混匀。 超声破碎,功率为200 W,破碎10 s,停10 s,共90 次。破碎完毕后于12 000 r/min 离心20 min, 收集上清液中蛋白质样品,过0.45 μm 滤膜除去不溶物。 上样于预先用MBP 缓冲液平衡好的MBP 亲和层析柱,流量为1 mL/min,上样完成后,用MBP 缓冲液洗去非特异性结合的杂蛋白质,直到蛋白质检测仪所测值不再变化,大约需1 h,最后用50 mmol/L 麦芽糖进行洗脱,收集洗脱峰,层析柱用ddH2O 洗涤后用体积分数20%乙醇洗涤后保存。
1.2.6 Cgt1 的ELISA 活性检测 用包被液(pH 9.6的NaHCO3)分别将黏蛋白(含有O-GalNAc 修饰,以O-连接糖基化为主), Transferrin (含有NGlycans)标准糖蛋白稀释至10 μg/mL,每孔100 μL,4 ℃包被过夜。 吸出包被液, 用体积分数0.1%的PBST(PBS 缓冲液,体积分数0.1%的Tween 20)洗涤3 次, 用3 g/dL 的BSA 室温封闭1 h,PBST 洗涤3 次, 开始孵育质量浓度为20 μg/mL 的Cgt1 突变体蛋白质溶液,室温孵育1 h,用PBST 洗涤5 次,随后室温孵育鼠源MBP 一抗(1∶1 000)1 h,洗涤5 次后室温孵育羊抗鼠二抗(1∶5 000)1 h,PBST 洗涤5 次, 向每孔加入100 μL TMB 反应液避光显色,30 min 后加入100 μL、1 mmol/L 盐酸终止反应,用酶标仪检测每孔在450 nm 的吸光值。
1.2.7 Cgt1 对细胞中O-GalNAc 修饰的鉴定 分别准备两组相同的HeLa 和HepG2 细胞样品,同时制样,并于10 g/dL SDS-PAGE 分析,在Marker 的10 000 条带接近板底部时停止电源, 开始转膜至PVDF 膜上,5 g/dL 的BSA 室温封闭1 h。 一组室温孵育2 μg/mL Cgt1 蛋白质溶液;另一组室温孵育提前混合旋转1 h 的2 μg/mL Cgt1 蛋白质和50 mmol/L N-乙酰半乳糖胺的混合溶液1 h,即糖封闭过程,洗涤后于室温孵育鼠源GST 一抗(1∶2 000)1 h,随后室温孵育辣根过氧化物酶标记的羊抗鼠二抗(1∶5 000)1 h,显影液反应后,暗室显影。
2 结果与分析
2.1 Cgt1 突变体的基因改造分析
为增加其可溶性表达, 去除CgtB C 端的30 个氨基酸。 大量研究发现,不同菌株的CgtB 的N 端前108 个氨基酸高度保守,可能是供体UDP-半乳糖的结合位点,所以为了突变CgtB 的催化活性位点,将CgtB (C 端已经删除30 个氨基酸) 的N 端去除30个氨基酸即为Cgt1,改造路线见图2。

图2 CgtB 的改造路线Fig. 2 Transforming strategy of CgtB
2.2 Cgt1 突变体基因扩增及pMal-c5x 质粒双酶切结果
以合成的Cgt1 基因序列作为模版扩增目的基因,所得3 管PCR 扩增产物经1 g/dL 的琼脂糖凝胶电泳验证,见图3。 在800 bp 附近均有明显条带,与改造后的目的基因大小(753 bp)一致。 将双酶切质粒产物与酶切前的质粒经1 g/dL 琼脂糖凝胶电泳对照,结果见图4。可见双酶切后的质粒从3 条带变成1 条带, 并且酶切前后条带大小有明显差异,说明pMal-c5x 双酶切成功。
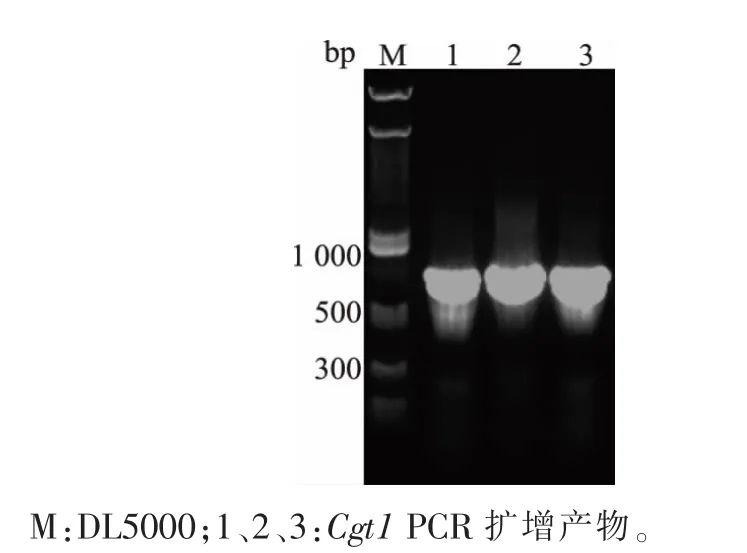
图3 Cgt1 突变体PCR 基因扩增Fig. 3 Gene PCR amplification of Cgt1 mutant

图4 pMal-c5x 质粒的双酶切Fig. 4 Double enzyme digestion of pMal-c5x plasmid
2.3 重组质粒转化后的PCR 验证
将重组质粒转化到克隆菌DH5α 后,随机挑取2 个单克隆菌落在1 mL LB 培养基中培养扩大,9 h后以1 μL 菌液作为模板进行PCR 验证,1 g/dL 琼脂糖凝胶电泳结果见图5。 可见2 个单克隆菌落均在800 bp 左右有明显条带,与预期大小一致,初步判断为阳性。 取该菌液进一步测序验证,其序列均完全符合,为阳性。

图5 pMal-c5x-Cgt1 重组质粒体系的菌液PCR 验证Fig. 5 PCR validation for pMal-c5x-Cgt1 recombinant plasmid system
2.4 Cgt1 突变体的表达及纯化
取未诱导的阳性菌上清液和IPTG 少量诱导的阳性菌上清液各400 μL,蛋白质抽提制样(甲醇氯仿抽提,V蛋白质液∶V甲醇∶V氯仿为4∶4∶1), 经SDS-PAGE和考马斯亮蓝染色,结果见图6(a)。 Cgt1 可溶性表达,随后大量表达Cgt1 蛋白质。 将上样前的蛋白质液和MBP 亲和层析柱纯化收集到的2 个样品即50 mmol/L 麦芽糖的洗脱液、穿流液,各取200 μL 分别进行蛋白质抽提制样(甲醇氯仿抽提,V蛋白质液∶V甲醇∶V氯仿为4∶4∶1)。 与超声破碎后的沉淀样品经SDSPAGE 和考马斯亮蓝染色,结果见图6(b)。 可见目的蛋白质Cgt1 富集于50 mol/L 麦芽糖的洗脱液中,条带纯度较高,和预期大小(70 000)一致。 用PBS反复超滤置换原始的缓冲液,超滤后测得Cgt1 蛋白质的终质量浓度为0.5 mg/mL。

图6 Cgt1 的表达与纯化Fig. 6 Expression and purification of Cgt1
2.5 Cgt1 的ELISA 活性检测
Cgt1 的ELISA 检测结果见图7。结果显示,Cgt1能特异结合O-GalNAc 修饰的mucin 标准糖蛋白,而对BSA 和含有N-连接糖基化的Transferrin 即转铁蛋白没有结合活性, 该结果说明Cgt1 保留OGalNAc 结合活性。

图7 Cgt1 对不同糖蛋白的结合Fig. 7 Bindings profiles of Cgt1 to different glycoproteins
2.6 Cgt1 对不同肿瘤细胞中的O-GalNAc 修饰鉴定
Cgt1 作为糖识别工具的免疫印迹结果见图8。在HepG2 和HeLa 复杂肿瘤细胞样品中,Cgt1 均鉴别到大量O-GalNAc 修饰信号,该结果证明Cgt1 具有O-GalNAc 修饰结合活性。
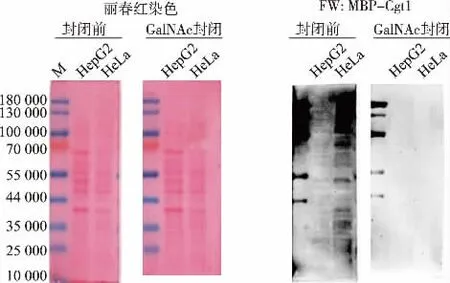
图8 Cgt1 对不同肿瘤细胞的O-GalNAc 修饰鉴定Fig. 8 O-GalNAc modification in different tumor cells identified by Cgt1
3 结 语
作者所在课题组通过改造CgtB 的基因, 突变其催化活性位点,保留其糖结合位点,实现了其突变体Cgt1 在大肠杆菌中的大量表达、MBP 亲和层析柱纯化,并在纯化后验证了Cgt1 对O-GalNAc 修饰的结合活性。 通过糖蛋白结合实验,证明Cgt1 保留了其O-GalNAc 修饰结合活性, 并且可以作为鉴别O-GalNAc 修饰的鉴定工具, 这对O-GalNAc 修饰的研究起到了极大的推动作用。

