红丹中二氧化铅含量检测方法探究
屈颖,杨会琳,马逢伯,高鹤,董晓斌,张华,陈志雪
(风帆有限责任公司,河北 保定 071057)
0 引言
蓄电池的容量与循环寿命很大程度上取决于活性物质的结构。为了使铅酸蓄电池,特别是 AGM电池的正极板更容易化成,研究人员将正极铅膏配方进行了相应的调整,加入了一定质量的工业红丹(Pb3O4)。红丹不但能改善正极板的化成效果,还对蓄电池性能有重要影响。因此,为了保证原材料质量和铅膏配方的准确,对 Pb3O4和 PbO2的含量进行精准的检测就变得至关重要。笔者按照化工行业标准 HG/T 3850—2006《红丹》(后文简称“行标”)[1]、生产厂家的实验方法和所在实验室自研方法检测 Pb3O4和 PbO2的含量,通过对比给出优选方法。
1 行标检测方法
行标 HG/T 3850—2006 中的检测方法是,先检测出 PbO2的含量,再经过系数的计算得出 Pb3O4的含量。红丹被硫代硫酸钠、乙酸、乙酸钠混合溶液溶解后,通过碘标准溶液滴定过量的硫代硫酸钠消耗的体积来计算 Pb3O4的含量。具体方法如下:首先,精准称取 500~800 mg 试样(准确至1 mg),放入 250 mL 锥形瓶中。其次,在锥形瓶中依次加入 25 mL 0.05 mol/L 的硫代硫酸钠溶液、25 mL 600 g/L 的乙酸钠溶液和 20 mL 300 g/L 的乙酸溶液。接着,慢慢搅拌锥形瓶中混合物以溶解试样,同时用平头玻璃棒把红丹颗粒弄碎。然后,小心冲净玻璃棒。若有痕量红丹难以溶解,可加入不多于 500 mg 的硫化钾。最后,当铅氧化物完全溶解后(除金属铅等不溶物),用 0.1 mol/L 的碘标准溶液滴定过量的硫代硫酸钠溶液,以淀粉溶液(把 10 g 可溶性淀粉与 10 g 碘化汞和约 30 mL 水混合,摇匀,形成均匀的悬浮液,接着将悬浮液倒入 1 000 mL 沸水中煮沸 3 min,然后冷却备用)做指示剂。按照以上顺序,以相同步骤,同样数量的试剂,不加试样做空白试验。
通过上述方法得到检测结果后,按照公式
计算 PbO2含量。式中:V1—滴定含试样溶液所消耗的碘标准溶液的体积;V2—滴定空白试验溶液所消耗的碘标准溶液的体积;c—碘标准溶液的物质的量的浓度;m1—试样的质量;0.119 6 mg—消耗1 mL 0.1 mol/L 的碘标准溶液的 PbO2质量。然后,再按照公式
得出 Pb3O4含量。
2 生产厂家自检方法
红丹生产厂家的检测方法是,先检测出 Pb3O4的含量,再根据系数代入公式进行计算,得出PbO2含量。将试样置于乙酸–乙酸钠溶液中,加入碘化钾与 Pb3O4进行反应,然后用硫代硫酸钠标准溶液进行滴定。根据硫代硫酸钠标准溶液的消耗量计算 Pb3O4的含量。具体方法如下:首先,准确称取 500~800 mg 试样(精确至 0.2 mg),置于碘量瓶中。其次,往碘量瓶中加入 30 mL pH 在 4~5 之间的乙酸–乙酸钠溶液,再加入 800 mg 碘化钾,使溶液呈透明的橙红色。然后,用c(Na2S2O3) ≈ 0.1 mol/L 的硫代硫酸钠标准溶液进行滴定,至溶液变为淡黄色。最后,加入 10 g/L 的淀粉指示液 1 mL,继续用c(Na2S2O3) ≈ 0.1 mol/L 的硫代硫酸钠标准溶液滴定至溶液蓝色消失并保持 30 s 不变,表明已到终点。按照以上顺序,以相同步骤,同样数量的试剂,不加试样做空白试验。
通过上述方法得到检测结果后,按照公式
计算 Pb3O4含量。式中:V—滴定含试样溶液所消耗的硫代硫酸钠标准溶液体积;V0—滴定空白试验溶液所消耗的硫代硫酸钠标准溶液体积;c—硫代硫酸钠标准溶液的物质的量的浓度;m—试样的质量;M—1 mol Pb3O4的质量。然后,再按照公式
得出 PbO2含量。式中:M1—1 mol PbO2的质量;M2—1 mol Pb3O4的质量。
3 实验室自研采用的方法
在硝酸溶液中,PbO2可以定量氧化过氧化氢,而剩余的过氧化氢又被高锰酸钾定量氧化,所以可以根据高锰酸钾溶液的消耗量,计算出 PbO2的含量。本实验室自研检测方法具体为:首先,称取全部通过 120 目筛的试样 400 mg(精确至 0.1 mg),置于 250 mL 三角杯中。其次,在三角杯中加入15 mL 硝酸溶液(1+1),并用移液管准确加入 10 mL过氧化氢溶液(1+40)。接着,轻轻摇动三角杯30 min,使试样溶解完全。当试样中含有活性炭等添加剂导致不易判断时,可仔细观察溶液。如无小气泡产生则表示溶解完全。最后,用 0.100 0 mol/L 的高锰酸钾标准溶液滴定至溶液呈浅红色(保持 30 s 不变)时停止。按照以上相同步骤,同样数量的试剂,不加试样做空白试验。
将检测结果代入公式
计算 PbO2的含量。式中:c1—高锰酸钾标准溶液的物质的量的浓度;V0—滴定空白试验溶液所消耗的硫代硫酸钠标准溶液体积;V1—滴定含试样溶液所消耗的高锰酸钾标准溶液体积;m0—试样的质量;0.119 6 mg—消耗 1 mL 高锰酸钾标准溶液[c(1/5 KMnO4) = 0.1 mol/L]的 PbO2质量。再按照上述公式(2)得出 Pb3O4含量。
4 方法比对
通过以上 3 种检测方法,都可以准确地检测出 PbO2和 Pb3O4的含量,但是在前期准备和过程操作上彼此之间存在一定差异。3 种检测方法共同点是:都是先检测出 PbO2或 Pb3O4含量,再经过与系数的运算得到相对应的 Pb3O4或 PbO2含量。三者的差异是:行标和本实验室自研方法都是通过先检测 PbO2含量,再换算得出 Pb3O4含量;而红丹生产厂家则是先检测 Pb3O4含量,再换算出 PbO2含量。那么,哪种实验方法更加便捷呢?
业内通常认为,一般在 2 h 内能够报出结果的理化检测方法,即可被认作快速检验方法。所谓的快速检测主要体现在以下 3 方面:① 实验前期准备工作简单化,且所用试剂的种类尽可能少。②样品经过简单的预处理后就可进行检测。③ 分析检测的方法准确、简单、快速。
化学检测时通常利用比对试验来进行内部控制和检测评价。比对试验,就是指设定两个或两个以上的实验组,按照预先规定的条件,就同一或类似的检测样品进行检测和评价[2]。实验室比对的形式主要包括人员比对、仪器比对、方法比对和留样再测这几种类型[3]。经过认真的筛选,本实验室选定了方法比对形式,对以上 3 种检测方法进行科学的比对。针对每种实验方法随机测试 10 份样品,对每份样品平行测试 2 次。以检测 PbO2含量为对比项目,测得的数据见表1 和图1。通过计算,三种实验方法检测结果的均值如下:34.200(行标检测法)、34.250(厂家检测法)、34.200(自研方法)。
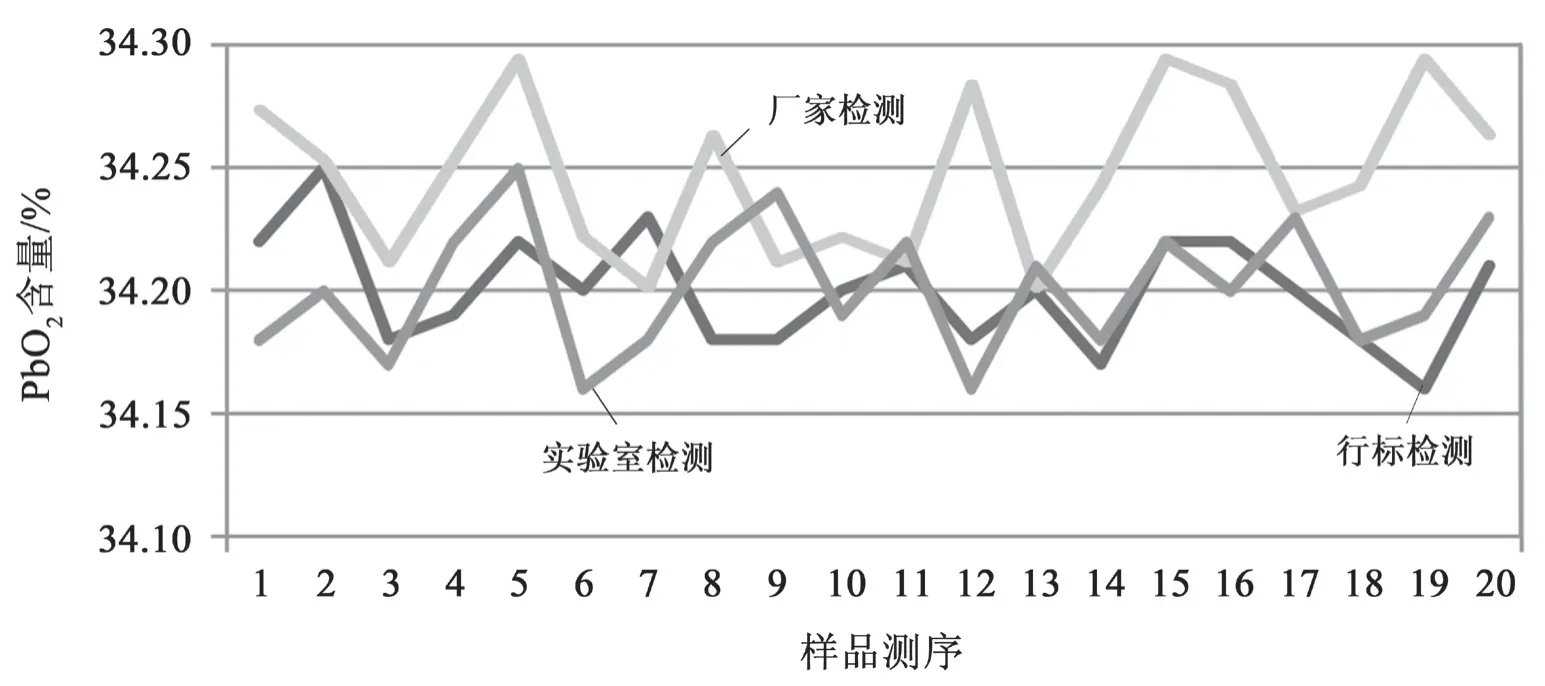
图1 3 种检测方法检测 PbO2 所得数据汇总折线图
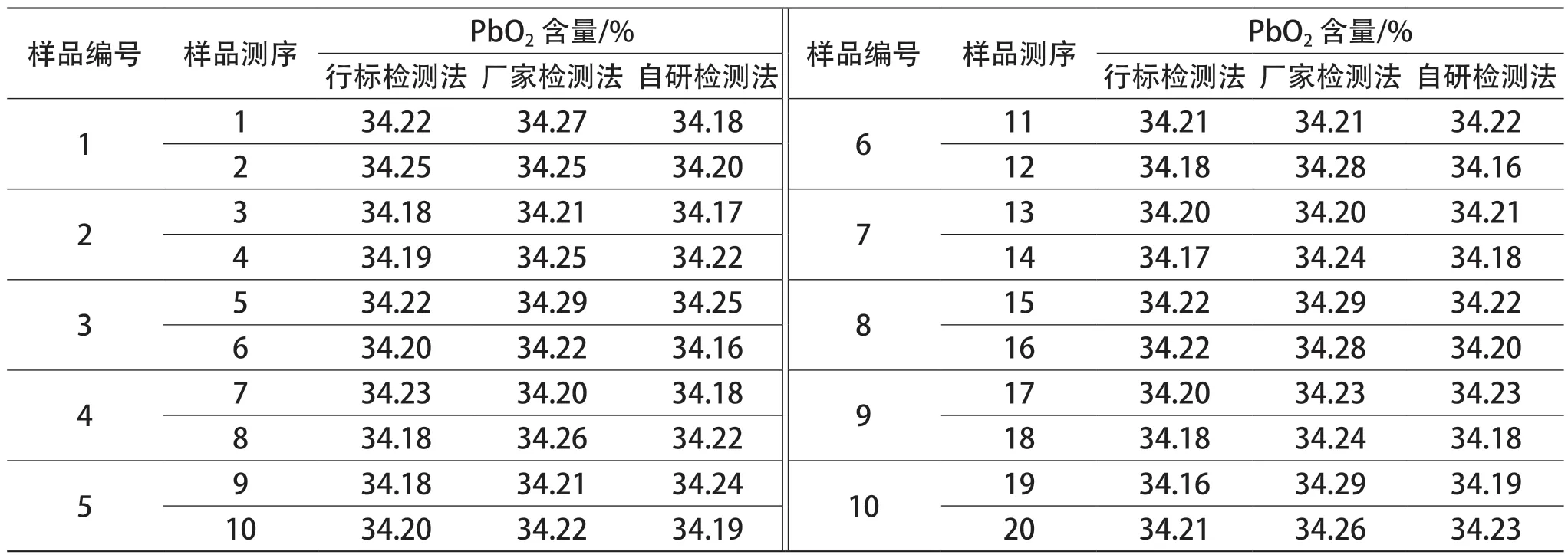
表1 检测数据
实验室分析根据分析任务一般可以分为定性分析、定量分析、结构分析。当选用新的实验方法进行定量测定时,应该提前考察该方法是否存在系统误差。只有确认该方法没有系统误差或者系统误差能被校正才能采用,才能够信任使用该方法检测所得的数据[3]。比对结果判定通常采用经典Z比分数法。公式为:
其中,x为检测值;X为 3 种检测法所得数据均值,经计算X为 34.217 %;S为标准偏差,经计算为 0.029 %。判定依据为:│Z│≤2 表示满意结果;2<│Z│<3 表示有问题;│Z│≥3 表示不满意或离群的结果。现将检测结果列于表2 中。

表2 3 种方法检测结果统计表
5 结束语
因为红丹是铅酸蓄电池正极铅膏的原材料,所以快速准确地检测红丹中 PbO2含量很重要。经过此次比对,由上述 3 种检测方法均能得到满意的结果。但是,不难看出,本实验室自研检测方法所需试剂准备起来更加精简,实验过程的操作更为简便快捷,是检测红丹中 PbO2含量的优选方法。

