从组蛋白精氨酸甲基化过程谈子痫前期的研究现况
王娇,章锦曼
子痫前期(preeclampsia,PE)是妊娠期特发且累及多系统的疾病,其危害大、发病率高,严重威胁母胎健康。敏感且准确的筛查、干预、治疗有利于减少母胎危害。组蛋白精氨酸甲基化是表观遗传学的修饰方式,该过程中底物精氨酸、产物不对称型二甲基精氨酸及二甲基精氨酸二甲基氨水解酶等与PE筛查、发生、发展、治疗及母儿预后关系密切,可为PE的研究提供新的思路。
1 组蛋白精氨酸甲基化的生理过程
1967年,Paik等[1]首先发现小牛胸腺细胞核蛋白组分的精氨酸含有甲基化官能团修饰。组蛋白精氨酸甲基化是指在蛋白精氨酸N-甲基转移酶(protein arginine methyltransferases,PRMTs)作用下将s-腺苷-l-蛋氨酸提供的甲基转移至组蛋白精氨酸胍基氮原子上生成产物不对称型二甲基化精氨酸(asymmetric dimethylarginine,ADMA)等物质的过程[2-3]。ADMA通过二甲基精氨酸二甲氨水解酶(two dimethylarginine dimethylaminohydrolase,DDAH)水解代谢,过程见图1[4]。蛋白质精氨酸甲基化过程与体内L-精氨酸-eNOS-NO通路密切相关,通过激活一氧化氮(nitric oxide,NO)刺激可溶性鸟苷酸环化酶产生环状GMP降低细胞内钙离子水平,降低血管张力,NO还可以清除氧自由基或干扰产生氧自由基酶的活性,保护内皮细胞免受氧化应激损伤[5]。
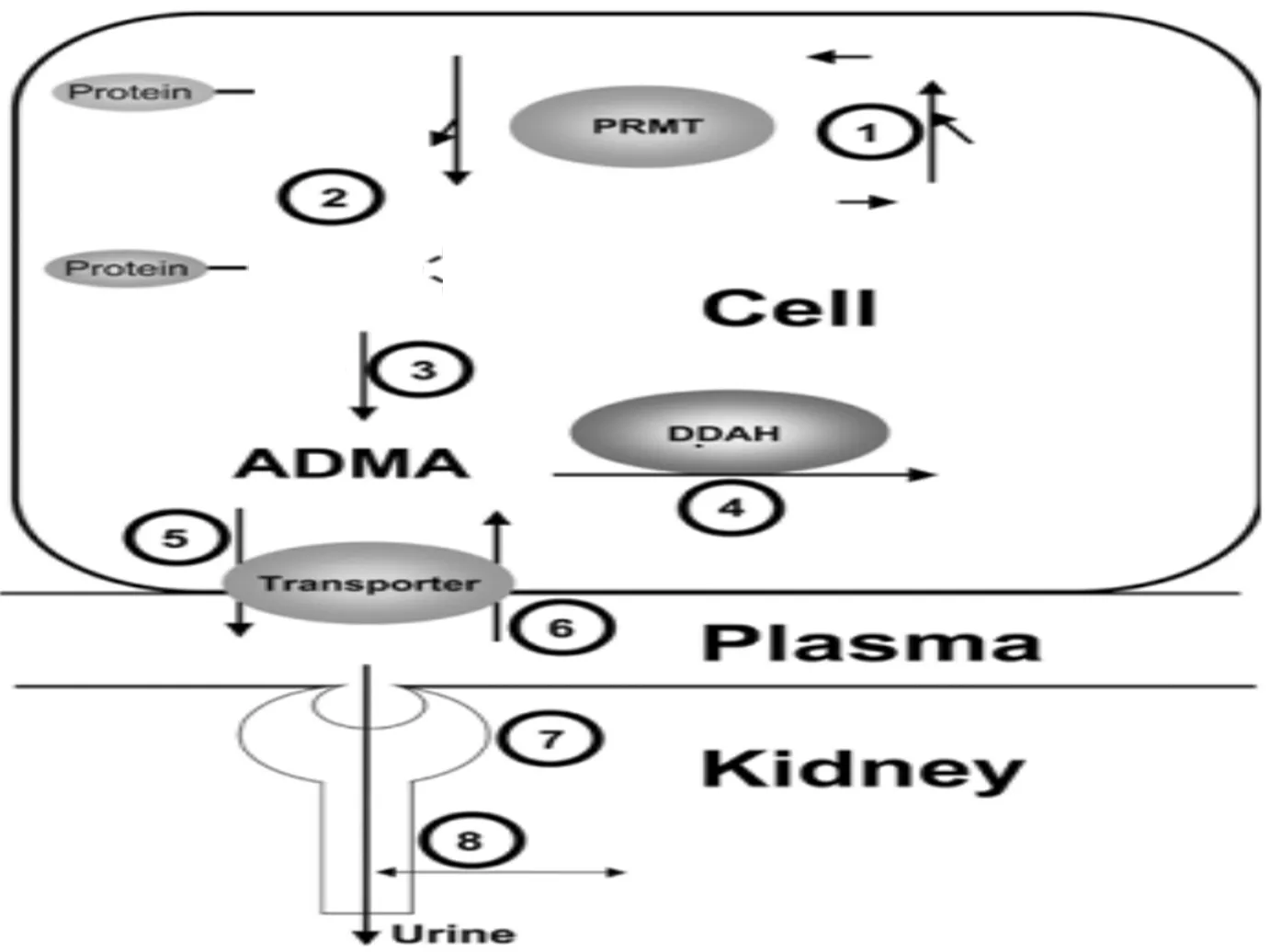
注:① s-腺苷甲硫氨酸供甲基;② PRMT将①中的甲基转移至组蛋白中L-精氨酸残基并进行甲基化;③ 蛋白质精氨酸水解为ADMA;④ DDAH水解ADMA;⑤ 载体介导的ADMA排泄;⑥ 载体介导的ADMA摄取;⑦ ADMA肾滤过;⑧ 载体介导的ADMA分泌和再摄取
2 子痫前期病理过程
PE是妊娠20周后出现血压升高,收缩压≥140 mmHg和(或)舒张压≥90 mmHg,伴蛋白尿,或母体器官功能受损,或胎盘功能受损导致胎儿生长受限等相关损害[6]。临床表现形式复杂且首发症状多样,病因不明,目前研究指出可能与胎盘浅着床、血管内皮损伤、氧化应激、免疫调节及遗传印记有关[7-9]。发展过程倾向两个阶段学说:第一阶段为胎盘浅着床,可能与母胎间的免疫反应、遗传学和环境因素相关,主要影响胎儿生长发育。第二阶段为母体慢性胎盘灌注不足触发生成的多种生物活性因子释放到母体循环,导致内皮功能障碍、血管痉挛等改变,最终导致母体多器官功能损害[10]。血管内皮损伤是公认的最关键的PE发病因素[6]。
3 组蛋白精氨酸甲基化与子痫前期
3.1 底物精氨酸与子痫前期
精氨酸及其代谢物在人体新陈代谢和生理学中起重要作用。精氨酸在内皮型NO合酶(nitric oxide synthase,NOS)的作用下生成NO,即L-精氨酸-eNOS-NO途径。因胎盘血管系统缺乏自主神经支配,在参与胎盘血管反应、胎盘床血管阻力调节中主要依靠NO因子扩血管作用以减少内皮功能受损和子宫动脉血流异常[11]。Arikawe等[12]在高血压妊娠大鼠实验中发现补充L-精氨酸可能通过NO血管舒张作用介导利尿而达到降压作用;接受阿司匹林的患有慢性高血压或既往胎盘血管疾病的孕妇,孕12~14周开始补充L-精氨酸,在妊娠26周时精氨酸补充组较未补充组24 h动态血压明显偏低,且未补充组孕妇胎儿脐动脉搏动指数(umbilical artery pulse index,UA-PI)的中位数值偏高,>95 th[13];一项荟萃分析结果显示,产前口服 L-精氨酸显著降低如胎儿宫内发育迟缓、早产和呼吸窘迫综合征等不良出生结局的风险,延长了孕周,提高妊娠期高血压孕妇出生新生儿Apgar评分[14]。但基于随访5.8年的一项前瞻性研究表明,膳食 L-精氨酸水平可能会增加2型糖尿病(type 2 diabetes melliitus,T2DM)的风险,并且在 T2DM 的发展中具有独立作用[15]。可见精氨酸可通过L-精氨酸-eNOS-NO通路参与调节PE发病过程,在精氨酸缺乏的地区,适量补充精氨酸对降低PE患者血压及胎儿宫内发育迟缓、早产等不良结局发生有积极作用,但较高膳食的精氨酸也可能通过诱导精氨酸酶的活性、阻断L-精氨酸形成瓜氨酸的循环等导致孕妇胰岛素抵抗,增加患T2DM的风险[16]。
3.2 产物ADMA与子痫前期
20世纪90年代Vallance在调查终末期肾病患者时首次提出ADMA抑制NOS活性降低NO浓度致血管内皮损伤[17]。母体血浆中低浓度ADMA有助于胎盘血管高度螺旋化,形成大容量、低阻力血管利于胎盘发育[18-19]。国外人类志愿者输注ADMA的实验证明ADMA损害内皮依赖性血管舒张,血管阻力增加,降低心输出量,是心血管疾病的危险因素[20];Garg等[21]认为ADMA的升高可先于PE临床表现发生,并持续整个妊娠期,推测ADMA可早期预测PE ;一项基于在正常妊娠孕妇与PE、PE伴合并症组(伴子痫、溶血、肝酶高、血小板减少等其中一项)的试验得出PE孕妇比正常妊娠孕妇ADMA、同型半胱氨酸(homocysteine,HCY)增加,NO浓度降低;发现PE合并症组比PE组ADMA升高明显,推测ADMA可能为疾病严重程度的指标[22];相关文献研究还得出以下结论:① ADMA与患和不患PE的妇女在怀孕期间对动脉壁层尺寸和心血管危险因素的不利影响有关[23];② ADMA可通过诱导滋养细胞自噬参与胎儿生长受限的发生[24]。机体ADMA降低时对NOS抑制作用减弱,高浓度NO促进胎盘血管螺旋化、减少血管内皮损伤、血管阻力降低、氧化应激作用减弱等缓解PE表现,并可通过诱导滋养细胞自噬影响胎儿发育。ADMA在PE中升高早,合并症组升高更明显,可以作为PE早筛查、疾病严重程度评估的指标。ADMA是PE的因还是果,需进一步探索。
3.3 水解酶DDAH与子痫前期
DDAH水解体内90%的ADMA,在降低ADMA水平方面发挥着重要的作用,分为DDAH1和DDAH2两种类型。有研究表明,DDAH1基因敲除后DDAH1 (-/-)的小鼠所有被测组织中均未检测到DDAH活性,DDAH1 (-/-)小鼠血浆和组织中ADMA比野生型小鼠高数倍,血压比野生型小鼠高20 mmHg,DDAH1在体内代谢ADMA,而没有检测到DDAH2对降解ADMA发挥作用[25]。 在一项基于早孕期绒毛外滋养层在体外衍生细胞系SGHPL-4 细胞研究抑制DDAH是否会增加滋养层对TRAIL诱导的细胞凋亡试验中发现,抑制DDAH1而不是抑制DDAH2会增加滋养细胞对TRAIL诱导的细胞凋亡的敏感性,推测抑制DDAH1/ADMA 通路可能导致滋养细胞侵袭不良而导致子痫发病[26-28],而有研究发现,降压药物如奈比洛尔可增加DDAH2的表达而降低内皮细胞中的ADMA水平而达到降压作用[29]。PE孕妇胎儿胎盘系统在水解ADMA中,途径DDAH1、DDAH2谁占主导地位,还是两者或多者共同作用,是未来精准化治疗的关键,降低ADMA药物对PE这类特殊患者是否适用,需要进一步研究。除DDAH外,较多研究证明HCY也可抑制DDAH表达,增加ADMA浓度,致血管高阻力影响胎盘胎儿血供[30-31],降低体内HCY,最终降低体内ADMA浓度,促进子宫动脉高度螺旋化,有利于避免胎盘浅着床,对PE有益。
4 小结
综上所述,组蛋白精氨酸甲基化过程中精氨酸、ADMA及DDAH通过影响NO生成,致血管内皮损伤、氧化应激机制增强最终导致PE相关临床表现。对缺乏地区人群适当补充精氨酸制剂、降低HCY促进DDAH表达,减少ADMA生成对促进胎盘着床、减轻氧化应激反应有益。ADMA在PE患者中出现早、持续时间长、合并症组升高更明显,可用于PE早筛查及疾病严重程度判断。PE药物治疗局限,DDAH基因可能存在多样性,基于中国人制定的多中心、多方向、多角度的深入探索是有必要的。

