16q22脆性位点携带者的临床及遗传学分析
傅文婷,江惠华,钟文谣,李铭臻
脆性位点是人类基因组中的特定染色体区域,在缺乏叶酸和胸苷的培养基中易形成如缺失、裂隙和无着丝粒片段等染色体异常。脆性位点根据其在群体中的频率分为罕见型和普通型两大类。罕见型脆性位点在人群中的发生率<5 %[1]。有学者认为脆性位点是染色体正常变异,但有报道认为脆性位点携带者的流产率和后代的染色体异常率增高[2]。在16号染色体上有三类脆性部位,包括对叶酸敏感的FRA16A、可用远霉素A诱导的FRA16B和FRA16E[3],其中FRA16B(16q22.1)最为常见。有研究认为FRA16B与hsa-mir-328、hsa-mir-140 miRNA有关联[4],并与复发性流产和男性不育相关[5]。本文应用染色体G显带技术和基因组拷贝数变异测序,确诊1例男性fra16q22携带患者,现报道如下。
1 病例资料
患者,男,37岁,身高172 cm,体重68 kg,平素体健,无既往病史。2017年结婚,性生活正常,未避孕未育。精子总数417.54百万/mL,精子存活率41%,精子浓度102.2百万/mL,总活力(PR+NP)百分率32.7%,正常形态10个(4.8%),异常形态197个(95.2%),头部缺陷190个(91.8%),颈部和中段缺陷92个(44.4%),主段缺陷45个(21.7%)。临床诊断为不育症和畸形精子症。内分泌激素、Hb电泳、地中海贫血基因和致畸4项结果未见异常。妻子染色体核型、地中海贫血、内分泌激素、抗子宫内膜抗体和抗精子抗体等检查均未见异常。
1.1 检测方法
1.1.1 染色体G显带分析 采用常规染色体G显带核型分析技术,按照《人类细胞基因组学国际命名体系》(ISCN2020)的标准进行核型分析,计数20个分裂相,分析5个核型,如怀疑嵌合体,则加数到100个分裂相。第一次培养分析发现核型异常后,考虑脆性位点易受培养液和实验过程的影响,遂通知患者重新采血,用两个不同厂家的培养液进行第二次常规培养,加大计数到131个分裂相,并分析了13个核型。
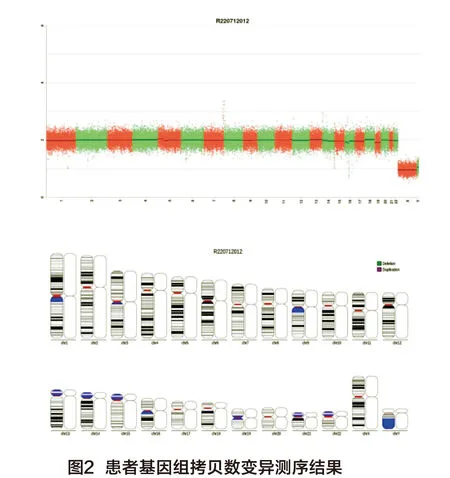
1.1.2 基因组拷贝数变异测序 将患者外周血进行核酸提取和纯化;对血液中提取的人基因组DNA酶切打断,在其两端添加测序接头,再通过磁珠分选富集200~500 bp大小的文库片段,构建好测序文库。利用DNA纳米球技术对测序文库进行扩增,形成测序模板,通过基于联合探针锚定聚合测序技术的基因测序仪进行测序。利用生物信息学软件对测序数据进行分析,得到匹配到每条染色体上的有效序列数量,计算有效序列数量与参考数据库中相应染色体序列数量的比值,判断染色体非整倍体异常。
1.2 结果
(1)染色体核型分析:两次细胞培养,第一次核型结果为mos 46,XY,del(16)(q22)[27]/46,XY,fra(16)(q22)[16]/46,XY[39],第2次分析核型时加数到131个细胞,结果显示mos 46,XY,del(16)(q22)[39]/46,XY,fra(16)(q22)[31]/47,XY,del(16)(q22),+chtb(16)(qter→q22)[18]/46,XY[43](见图1),与第1次结果相比,异常细胞类型多了一种,异常细胞数目略有差别。

注:A:46,XY,del(16)(q22);B:46,XY,fra(16)(q22);C:47,XY,del(16)(q22),+chtb(16)(qter→q22);D:46,XY
(2)基因组拷贝数变异测序:依据ACMG(2019)指南[6]对所有变异进行致病性评级,将所有变异分为5类:致病性、可能致病性、临床意义未明、可能良性和良性。根据指南共识建议进行结果报告,报告标准为染色体非整倍体、100 Kb以上已知明确致病的CNVs以及1 Mb以上的基因组缺失或重复。经分析本例患者结果未见染色体重复和缺失(图2,见彩插2)。
2 讨论
脆性位点是指染色体上一些特殊的部位,和染色体上特定的区带相关,以显性孟德尔方式遗传。根据其在群体中的频率分为罕见型和普通型。罕见型脆性位点可由富含AT的DNA配体或核苷酸类物质诱导,有不稳定的三核苷酸重复序列。普通型可用阿非迪霉素诱导,除了有数目高度可变的(TAA)重复序列外,其端粒侧还有与DNA复制有关的重复Alu序列[7]。虽然脆性位点表达的机制仍未明确,但有研究表明,所有脆性位点都可能会发生延迟复制,从而使具有稳定二级结构的DNA序列在复制过程中受到阻碍,导致基因组未复制的区域在中期出现裂隙和断裂[8]。人群中除了与临床表型明确相关的脆性X综合征外,脆性位点携带者通常认为是正常变异,无临床异常表型和生育影响[9]。但也有学者认为,脆性位点能形成二级结构,这些结构可干扰DNA复制和转录等过程,导致配子或胎儿细胞染色体结构发生断裂或重排,造成流产、死胎等[10]。
16号染色体可不经诱导在常规培养基中产生脆性[11],位于染色体16q22。fra16q22同时具有普通型和罕见型脆性位点的特征[12],可作为脆性位点的研究模型。该脆性位点可能与外界环境如辐射、接触农药等有关,所以当临床遇到此类患者时,应注意:① 首先询问患者的职业,排除接触史;② 重新采血检测,用不同厂家的培养液平行培养,以排除实验过程的因素;③ 再次检测结果仍然异常,则需进行基因层面的检测,以判断16q22断裂点位置是否存在遗传物质的缺失。
本例患者从事财务工作,健康状况良好。外周血淋巴细胞在未经诱导的培养液中常规培养,出现fra1622嵌合型核型,涉及染色体裂隙、断裂、缺失等多种异常,为排除实验因素的影响,和患者沟通后重新抽血,用两种不同品牌的培养液重新培养,并加大了细胞计数。两次核型结果大致相同,异常细胞数目略有差别,第二次培养异常细胞类型多了一种。因患者异常细胞比例超过了39%,考虑其为真性嵌合。临床工作中要重视细胞计数,当遇到可疑脆性位点核型时,为避免漏检,至少需计数100个细胞[13]。由于α-珠蛋白链基因位于16号染色体,为排除α-珠蛋白链异常,同时进行了血红蛋白(Hb)电泳和地中海贫血基因检测,患者结果均未见异常。
在健康人群中,16q22区域的脆性位点普遍认为是正常变异,不与特定的临床病征相关。但有研究者认为,尽管16q22脆性位点没有表型效应,但它可能与不育、自然流产、双侧隐睾症、严重少精子症等有关[14]。本例患者的精子亦存在异常,其精子异常形态197个(95.2%),头部缺陷190个(91.8%),颈部和中段缺陷92个(44.4%),主段缺陷45个(21.7%),临床诊断为畸形精子症。Aswini等[15]报道了1例复发性流产的罕见病例,夫妇双方都是fra16(q22)脆性位点携带者。Martorell等[16]报道了1对不育夫妇,男方外周血存在fra16q22.1,精液FISH(荧光原位杂交)发现98.6%的精子正常,异常包括16p重复(0.19%)、16p(0.39%)和16q(0.59%)的缺失。进一步对患者的胚胎通过胚胎植入前遗传学检测(PGT),发现有2枚胚胎异常,分别为16p部分单体和16q部分三体,提示fra16q22.1的存在可能会增加后代染色体异常和自然流产的风险。
根据患者的检测结果及文献复习,考虑本例患者的不育可能跟16q22脆性位点有关。鉴于患者婚后3年不育,且染色体存在较高比例的fra16q22,较易形成核型异常的胚胎,为降低自然流产和生育异常后代的风险,建议患者行体外受精(IVF)获得胚胎,并进行PGT。越来越多研究表明脆性位点与肿瘤的发生有关[17],故建议患者定期检查健康状况。患者于2021年4月在本地医院行体外受精和PGT,经两次移植顺利妊娠单胎。胎儿孕期检查和羊水染色体核型均正常,足月顺产一男婴。随访至今婴儿发育正常,患者亦无异常表现。
综上所述, fra16q22携带者的临床表型异质性较强,16q22脆性位点的重要性尚未得到充分评估,明确脆性位点不稳定性的机理和基因的表达调控,以及脆性位点与疾病之间的关系,可以为患者后续的精准治疗和产前诊断提供线索,同时可进行优生优育和提高人口素质。
利益冲突所有作者均声明不存在利益冲突。

