辛烯基琥珀酸玉米多孔淀粉的制备及在姜黄素微胶囊壁材的应用
周 洋,彭秀安,郭 祺,王馨悦,郑智元,喻 禧,石 剑*
(1 常州大学石油化工学院 江苏常州 213164 2 常州大学 江苏省绿色催化材料与技术重点实验室 江苏常州 213164)
淀粉为天然高分子多糖聚合物,其致密结晶区使反应物和水等物质难以进入其颗粒内部,且溶解性较差、易回生、黏度较高,限制了其反应效率和产物品质[1-2]。通过探究改善天然淀粉颗粒结构性能来提高其反应活性及品质,具有重要研究意义。辛烯基琥珀酸淀粉酯(Octenyl succinic acid modified starch,OSAS)是以淀粉为原料,辛烯基琥珀酸(Octenyl succinic anhydride,OSA)为酯化剂制备的改性双亲性酯化淀粉,属淀粉糖酯类产品[3]。我国于1988 年审批OSAS 可应用作为食品添加剂,在其使用范围内无用量限制,可按需进行控制添加。因OSA 的引入会使普通亲水性淀粉呈现疏水性,故OSAS 具备亲水亲油的两亲性质,这种优良的理化性质使其具有重要且优异的应用价值和实际意义,可用于微胶囊壁材的制备、食品乳化稳定剂和增稠剂等,应用前景广阔[4]。OSAS 作为微胶囊壁材在食品和医药等领域受到广泛关注,发展十分迅速[5-8]。其制备方法除传统干法、湿法(水相合成法)、有机相法[9-12]外,近年来,还有超声辅助制备法[13]等。OSAS 作为微胶囊壁材,在水油二相的乳浊液体系中,具有独特的乳化稳定作用,可保护被包裹物不受外界干扰而失活和氧化,从而保证内部药物的稳定性和活性,有效控制其扩散和挥发,实现药物的可控释放。姜黄素(Curcumin,Cur)是一种多酚化合物,是从姜科姜黄属植物姜黄根茎中提炼出来的一种天然产物,常温常态下为橙黄色粉末状结晶,不溶于水且易氧化,具有抗纤维化、抗肿瘤、抗氧化、抗炎、抑菌、降血脂和护肝等广泛的药理作用[14-15]。以OSAS 作为微胶囊壁材包裹Cur,利用微胶囊包覆工艺,可将其制成具有水溶性的微胶囊产品[16]。这不仅可改善其水溶性,还增加了其在应用环境下的稳定性,适用范围亦更加广泛,对其研究可为食品级Cur 胶囊的制备提供理论依据[17]。
多孔淀粉(Porous starch,PS)是通过酸、酶等物化手段部分水解获得的一种具有中空孔洞结构的变性淀粉,其颗粒形态充满由表及里的微米级孔道,孔容积约为颗粒体积的40%~60%[18]。这种多孔结构使得它除了具有普通淀粉的性质以外,其比容积、比表面积和吸附能力也远大于普通淀粉,可起到对被吸附物质的保护和在目标环境缓释的作用,在食品工业、农业、药学、生化等领域有着广泛的应用[19-21]。因淀粉颗粒表面存在亲水羟基,故使得其对水溶性物质吸附能力远高于油溶性物质,为提高其亲油性,通常可将其进行酯化改性[22-24]。相对于OSAS,由PS 制备的OSA-PS 应用性质更加优异。本研究制备OSA-PS,并将其作为壁材用于制备Cur 微胶囊,探究其包埋和缓释性能。
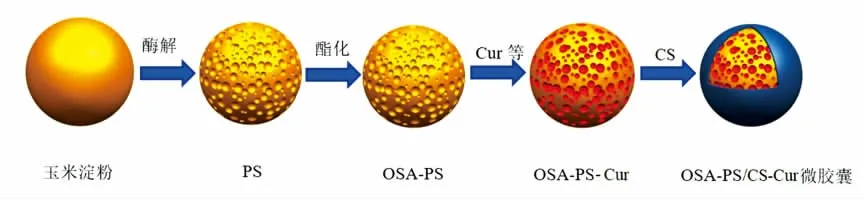
图1 OSA-PS/CS-Cur 微胶囊的制备流程Fig.1 The preparation process of OAS-PS/CS-Cur microcapsule
1 材料与方法
1.1 材料与试剂
玉米淀粉,南京甘汁园糖业有限公司;辛烯基琥珀酸酐(分析纯),上海麦克林生化科技有限公司;壳聚糖(分析纯)、无水乙醇(分析纯)、二水合柠檬酸三钠(分析纯)、姜黄素(分析纯),国药集团化学试剂有限公司;一水合柠檬酸(分析纯),江苏强盛功能化学股份有限公司;硝酸银(分析纯),上海申博化工有限公司;α-淀粉酶(分析纯)、糖化酶(分析纯),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
ZD-85 气裕恒温振荡器,上海香桂化工有限公司;12N/18N LC-10N 冷冻干燥机,浙江力辰仪器科技有限公司;JEM3010 高分辨透射电子显微镜,日本电子株式会社;APEXII 型X 射线衍射光谱,德国布鲁克公司;IS50 傅立叶变换红外光谱,美国赛默飞公司。
1.3 方法
1.3.1 PS 的制备 准确称取玉米淀粉20.00 g(精确至0.01 g),放入烧杯中并加入100 mL 的pH 值为5.4 的缓冲溶液,置于50 ℃水浴锅中恒温预热20 min,加入适量复合酶,并放入50 ℃恒温摇床,120 r/min 反应10 h,反应结束后,加入5 mL 的质量分数4%的NaOH 终止反应。抽滤并用蒸馏水洗涤沉淀,50 ℃烘箱干燥24 h 至恒重,研磨过0.150 mm 筛。通过不同的酶配比(α-淀粉酶∶糖化酶)及反应时间,探究单因素对PS 制备的影响。
1.3.2 PS 吸油率的测定 准确称取2.0000 g 所制得PS(精确至0.0001 g),置于离心管中,加入10.0000 g 大豆油,置于磁力搅拌器上搅拌30 min;接着离心(4 000 r/min,10 min),倒掉上层油直至无油滴滴下,称取离心管的质量。计算吸油率(ω)如式(1):
式中,M1——离心后淀粉、离心管和大豆油的总质量(g);M2——离心管质量(g);M3——PS 的质量(g)。
1.3.3 OSA-PS 的制备 称取制备得到的PS,与蒸馏水混合,制得质量分数30%的淀粉乳液,形成悬浮液,放入50 ℃恒温水浴锅,磁力搅拌20 min,加入质量分数3%的NaOH 溶液直至淀粉乳溶液pH 值为8.5~9.0,缓慢滴加占多孔淀粉质量3%的且经无水乙醇稀释3 倍的OSA,在反应过程中,控制溶液pH 值为8.5 左右,在40 ℃水浴条件下反应4 h。反应结束后抽滤,用3%的HCl 溶液将沉淀洗涤至中性,再用无水乙醇洗涤3 次,经AgNO3检测无Cl 离子,放入50 ℃烘箱中干燥24 h,取出研磨后密封干燥保存。
1.3.4 DS 的测定 参考文献[25]利用的滴定法对OSA-PS 的DS 进行测定,并在此基础上作适当调整。准确称取1.0000 g(精确到小数点后4 位)的OSA-PS 置于锥形瓶中,然后加入60 mL 去离子水,并将其置于95 ℃水浴锅中20 min 搅拌预热。加2~3 滴酚酞作指示剂,并用0.1 mol/L 的NaOH标准溶液滴定,至悬浮液变为粉红色时,终止滴定,表明反应已到达终点。DS 计算如式(2):
式中,162——葡萄糖残基摩尔质量(g/mol);210——OSA 摩尔质量(g/mol);A——NaOH 标准溶液滴定体积(mL);C——NaOH 标准溶液浓度(mol/L);M——所取OSA-PS 样品质量(g)。
1.3.5 电镜分析 使用SEM(冷场)对PS、OSAPS 和原淀粉颗粒的形态进行探究。将样品分别通过导电胶粘贴在样品座上,进行喷金后分别进行电镜分析。
1.3.6 傅里叶红外光谱分析(FT-IR)取适量的PS、OSA-PS 和原玉米淀粉并分别加入质量分数1%的溴化钾,研磨至无颗粒状并用模具分别压片后测定分析,扫描波数为4000~400 cm-1。
1.3.7 X 射线衍射(XRD)的测定 采用X 射线衍射仪分析测定PS、OSA-PS 和原淀粉的晶体颗粒构造。测试条件:扫描方式为连续,扫描范围5~35;扫描步长为0.05;扫描速度3°/min。
1.3.8 OSA-PS-Cur 微球的制备 参考Li 等[26]的方法并稍作修改(Cur 以5 mg/mL 的质量浓度溶解在无水乙醇中,过0.4 μm 过滤器除去未溶解晶体;OSA-PS 以10 mg/mL 的质量浓度溶解在蒸馏水中,超声处理使其体系分布稳定;在持续搅拌过程中将Cur-乙醇溶液缓慢滴入OSA-PS 溶液中,制备成OSA-PS-Cur 复合样品。适当加热除去乙醇,超声处理后用冻干机干燥(真空度0.07 mbar,抽真空18 h,持续干燥时间约为30 h),制得具有Cur 的特征黄色样品,在-20 ℃保存备用。
1.3.9 OSA-PS-CS-Cur 微胶囊的制备 取OSAPS-Cur 微球2 g,加入质量分数5%的吐温80 溶液1 mL,再加入质量分数3%的壳聚糖(CS)溶液10 mL,于35 ℃恒温水浴搅拌均匀,并采用乳化高速匀浆处理器处理5 min,重复乳化均质3 次即得微胶囊乳液。经预冷(-30 ℃,2.5 h)处理后,冷冻干燥(冷冻温度-68.2 ℃,压强0.01 kPa,冷冻干燥时间24 h),将所得产品取出研磨,于干燥阴凉处保存。
1.3.10 微胶囊包埋率的测定 以包埋率为指标,对目标物微胶囊化的效果进行评价:即微胶囊产品中已被包覆的目标芯材质量与微胶囊产品中总芯材质量之比[27],如式(3):
其中,微胶囊表面Cur 质量的测定方法为:精确称量制备所得微胶囊产物1.00 g,以1∶30 的比例加入无水乙醇充分振荡,离心(1 400 r/min,10 min),取1 mL 上清液,添加无水乙醇至棕色容量瓶中定容到10 mL,在波长425 nm 处测定其吸光度,将吸光值代入Cur 紫外吸收标准曲线,计算可得微胶囊产品表面Cur 质量。
产品中总Cur 的质量测定方法为:精确称量制备所得微胶囊产物1.00 g,以1∶30 的比例加入无水乙醇充分振荡,经超声(45 ℃,30 min),离心(1 400 r/min,10 min)后,取上清液1 mL,添加无水乙醇在棕色容量瓶中定容至20 mL,在波长425 nm 处对吸光度进行测定,并代入Cur 紫外吸收标准曲线进行计算。
此外,可据此测定微胶囊产品的总Cur 得率如下:移取1 mL 待测样品溶液,加入10 mL 棕色容量瓶中定容,用紫外分光计测定其吸光度,计算Cur 微胶囊总Cur 含量。并利用Cur 标准曲线回归方程求得相应Cur 浓度,总Cur 得率计算如式(4):
式中,Y——总Cur 得率(%);C——所得待测液Cur 质量浓度(g/L);V——待测液体积(L);N——溶液的稀释倍数;m——Cur 样品质量(g)。
1.3.11 Cur 微胶囊缓释性能测试 参考Paramera等[28]和Pereira 等[29]试验方法略作修改。称取2.0 g氯化钠(NaCl),7.0 mL HCl(质量分数36%)和1.0 g 吐温80 溶解在1 L 蒸馏水中,制备模拟胃酸溶液,并将溶液pH 值调至1.2。称取约50.0 mg Cur微胶囊样品至1 000 mL 的烧杯中,向其中加入配制好的800 mL 的模拟胃酸溶液,于37 ℃水浴锅中恒温加热。设定紫外分光光度计波长为425 nm,观察24 h 内Cur 微胶囊释放Cur 的质量,分别选取2,4,6,12,24 h 共5 个时间节点测定Cur的释放质量。Cur 的释放质量(RC%)计算如式(5):
式中,m1——释放到模拟胃酸溶液中Cur 的含量(μg/mL);m2——微胶囊中总的Cur 的含量(μg/mL)。
2 结果与分析
2.1 PS 制备的工艺选择
通过单因素实验方法,考察复合酶配比、反应时间、反应温度、复合酶用量以及反应pH 值对PS吸油率的影响,结果如图2 所示。
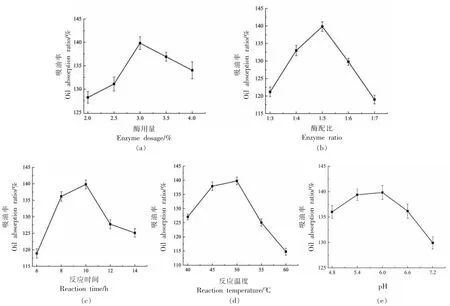
图2 不同反应条件对PS 吸油率的影响Fig.2 Effect of different reaction conditions on oil absorption ratio of PS
由图2 可知,随着复合酶用量增长,PS 吸油率随之呈先升后降的趋势,当复合酶用量为3.0%时,在试验范围内PS 吸油率达到最高。因复合酶添加量过低时,酶与淀粉不易发生充分反应,故此时淀粉水解未能完全进行;而酶添加量过高亦会导致淀粉在一定程度上过分水解,其颗粒坍缩而使内部无法形成稳定的多孔结构,致使PS 吸油率下降。
在酶配比方面,酶配比为1∶5 时吸油率最高。因为α-淀粉酶有助于糖化酶的水解。糖化酶占比太低,会造成淀粉非结晶区水解反应不充分,而糖化酶占比过高亦会使淀粉过分水解而无法形成稳定多孔结构,从而导致其颗粒坍缩、裂解,使PS 结构遭到破坏,致使吸油率下降。因此,选择α-淀粉酶与糖化酶的最佳酶配比为1∶5。
在反应时间方面,随着反应时间延长,试验范围内PS 吸油率随之大致呈先上升后下降至平稳的趋势,吸油率在10 h 时最高。若酶解时间较短,酶与淀粉无法充分发生作用,部分淀粉颗粒未被水解;若酶解时间较长,淀粉颗粒易被过度水解而垮塌裂解,从而破坏其整体有序的多孔架构,无法形成颗粒完整的中空孔隙结构,以致其吸油率下降。
同时,试验范围内反应温度对PS 吸油率的影响随之呈先升后降的趋势,在反应温度为50 ℃时,PS 吸油率达最高。当酶解温度较低时,酶活性较低,酶解反应不活跃;而酶解温度较高时,淀粉颗粒吸水膨胀,接近糊化温度[30],使得淀粉束松散,对酶的敏感性增强,而被过度水解导致淀粉颗粒坍塌,吸油率下降。
由于酶解反应是在偏酸性条件下进行,其中α-淀粉酶的最适pH 范围为4.5~6.5,糖化酶的最适pH 范围为4.0~4.5[31],因此两种酶在制备中复合使用pH 值为5.4~6.0 时,活性最高,酶解效果最好。故当体系pH 值为6.0 时,PS 的吸油率最高。因此,单因素制备的PS 最佳工艺条件为:酶用量3%,酶配比1∶5,反应时间10 h,反应温度50℃,反应pH 值6.0,此时PS 的吸油率为139.37%。
2.2 OSA-PS 制备的工艺选择
以所制得PS 为原料,考察底物质量浓度、pH值、OSA 添加量、反应温度和反应时间对PS 酯化产物DS 的影响,从而确定OSA-PS 的最佳制备工艺条件。结果如图3 所示。

图3 不同酯化反应条件对产物性能的影响Fig.3 Effects of different esterification reaction conditions on product properties
相比于PS,酯化改性后的产物吸油率略有降低。虽然改性过程中引入疏水基团有利于增加产物的吸油性能,但反应过程中PS 颗粒会在一定程度上的再吸水溶胀,导致颗粒孔隙内部出现不同程度的裂解和塌陷,从而降低了产物的吸油率。由图3 可知,底物质量浓度对OSA-PS 的DS 影响较小,呈先增大后降低的趋势。在PS 的酯化反应中,若底物质量浓度过小,反应不充分,而底物质量浓度太高则导致体系黏度增大,致使OSA 分散程度受限,进而引起DS 的降低;为了保证淀粉羟基基团的反应活性,PS 酯化反应须在弱碱性条件下进行,当pH 值为8.5 时,DS 最高,而当体系pH 值过高时,溶液中NaOH 易与OSA 反应生成副产物羧酸氢钠和不参与反应的羧酸二钠,从而影响PS 的酯化效果,降低其酯化效率。在试验范围内,酯化PS 产物的DS 会随着酸酐添加量的增加而逐渐上升,至3.5%时趋于平稳,这是由于反应过程中PS与OSA 的接触概率亦随酸酐添加量的增加而升高,以致产物DS 也随之升高。然而当酸酐添加量达到一定时,一方面随着酸酐添加量的增加,为维持反应体系pH 恒定,所需的NaOH 量亦随之增加,以致淀粉更容易糊化,另一方面,由于反应空间位阻的作用导致无法提供更多反应点,对反应的进行造成不利影响;一定程度上,反应时间的延长有助于反应物间的接触,进而提升PS 酯化产品的DS,若反应时间过长,则OSA 与NaOH 直接作用和酯化产物的水解等副反应逐渐占据主导地位,从而导致DS 略有降低。因此单因素实验考察得到OSA-PS 的最佳合成工艺条件为:底物质量浓度25%,pH 值8.5,OSA 添加量3.5%,反应时间4 h,反应温度40 ℃。此条件下OSA-PS 的DS 为0.02026,吸油率为120.05%。
2.3 SEM 分析
从图4 可得,原玉米淀粉颗粒表面相对连续平滑,多呈圆形和多面体,且上无孔洞。PS 和OSA-PS 表面存在不同深度的细小孔洞,总体上看,淀粉颗粒形状未发生较大变化,而OSA-PS 产物颗粒出现了一定的破碎情况,表明在酯化反应过程中会出现一定程度的孔道破坏和坍塌,这也证明了酯化产物吸油率较低的原因。

图4 不同样品的SEM 图Fig.4 SEM images of different samples
2.4 FT-IR 分析
测定的3 个样品在红外光谱图区域中,3 416~3 360 cm-1之间均存在O-H 伸缩振峰。2 927 cm-1附近吸收峰是C-H 伸缩振动。1 640,1 155,1 080,1 021,930 cm-1表示C-O 伸缩振动。从图5 可以看出,玉米淀粉与PS 的红外光谱相似,经酶解反应的PS 并未产生新的特征峰,这表明酶解反应过程中未生成新的官能团结构。而OSA-PS 在1 750 cm-1附出现了一个吸收峰,此吸收峰是由C=O 双键伸缩振动产生,表明有羰基存在,证明发生了酯化反应。红外光谱分析显示已成功制备出了OSA-PS。
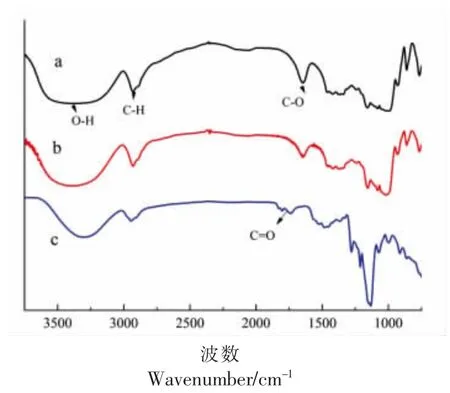
图5 不同样品的红外光谱图Fig.5 FT-IR spectra of different samples
2.5 XRD 分析
由图6 可知,3 种样品的XRD 谱图基本相同,表明淀粉经酶解及酯化改性后产物的晶型结构并未发生改变,说明反应在淀粉非结晶区进行,而这主要是由淀粉本身的物化性质所决定的。因淀粉本身具有亲水性,其非结晶区在反应体系的水相中发生了一定程度的吸水膨胀,然而由于反应过程均在淀粉糊化温度以下进行,因此对淀粉分子内和分子间的氢键力形成的高度有序晶体结构未产生影响。

图6 不同样品的XRD 谱图Fig.6 XRD spectra of different samples
2.6 微胶囊包埋率分析
参照1.3.8 和1.3.9 节制备了原淀粉、PS 和不同DS 的OSA-PS 制备复合壁材式微胶囊,参照1.3.10 节测试了不同样品对Cur 的包埋率,结果如图7 所示。
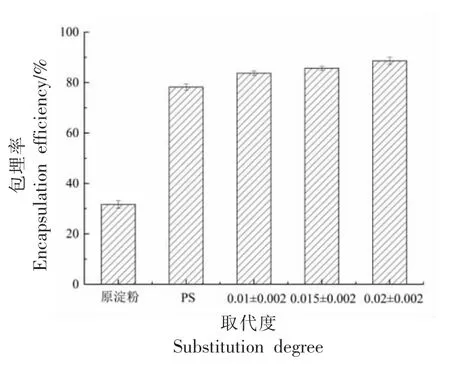
图7 原淀粉、PS 及不同DS 的OSA-PS 对包埋率的影响Fig.7 Effects of the original starch,PS and OSA-PS of different DS on encapsulation efficiency
淀粉及其反应产物对Cur 的吸附作用主要分为物理吸附和化学吸附。相比于原淀粉,PS 因其酶解过程产生的孔道结构,增强了对Cur 的物理吸附作用。而OSA-PS 引入了疏水性结构,加强了对Cur 的氢键缔合作用,随着DS 的增加,其对于Cur 的吸附能力增强,当DS 为0.02 时,Cur 的包埋率可达到88.62%。结果表明,采用OSA-PS 和CS 作为复合壁材对Cur 具有较强的包埋性能。
2.7 微胶囊缓释性能分析
Cur 主要吸收位置位于肠道中,为了能够最大限度地利用Cur,制备出的Cur 微胶囊应当保证壁材物质在胃中可以具备一定的抵抗胃酸降解能力[28]。测试原淀粉/CS-Cur、PS/CS-Cur 和OSA-PS/CS-Cur 复合微胶囊在模拟胃液中24 h 的缓释性能。结果如图8 所示。
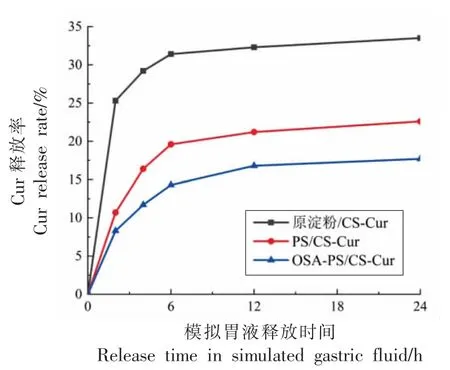
图8 不同样品在模拟胃液下的缓释性能Fig.8 Sustained-release performance of different samples under simulated gastric juice
在未考虑胃蛋白酶和胃内部微生物对样品缓释性能的影响,复合壁材式微胶囊的缓释能力主要体现在两个方面,一方面最外层的CS 可以在酸性溶液下缓慢溶解,从而暴露出附着在淀粉基表面的Cur;另一方面,淀粉在酸性溶液下发生水解,淀粉孔道坍塌,被吸附在淀粉内部的Cur 逐渐释放出来。结果表明,原淀粉中Cur 主要附着在淀粉表面,当CS 溶解后,表面Cur 逐渐释放。OSA-PS/CS-Cur 复合微胶囊芯材吸附在淀粉孔道内部并与淀粉疏水基团结合更紧密,则表现出了良好的抗胃酸降解性能,可使得大部分Cur 保存进入到肠道中。
3 结论
将玉米淀粉经酶解,OSA 改性的方法制备了OSA-PS,从而提高了产品的吸油率和疏水性。最优工艺条件下产物的吸油率和DS 分别为120.05%和0.02026,以此作为微胶囊壁材制备的复合型Cur 微胶囊,其包埋率可达到88.62%,并且在模拟胃液下具有良好的抗水解和缓释性能。

