板栗壳色素通过AMPK 信号通路改善肥胖小鼠的脂代谢紊乱
张晓云,梅晓宏*
(1 中国农业大学食品科学与营养工程学院 北京 100083 2 农业农村部农业转基因生物安全评价(食用)重点实验室 北京 100083)
目前肥胖已成为全球公共健康问题[1]。2016年,超过19 亿18 岁及以上的成年人患有肥胖症[2]。据估计,到2025 年,世界范围内的肥胖人口将增加50%以上,中国将会有46%的成年人和15%的儿童超重或肥胖[3]。而肥胖又是多种疾病的主要诱因,如心血管疾病、糖尿病、高血脂、高血压、脂肪肝等[4]。快节奏的生活方式使得通过运动来预防肥胖并非易事,而长期使用减肥药物会对人体产生毒副作用,因此,人们更偏向于从植物性食物或药物中提取对人体无害的天然活性成分,通过食用这些天然的产物来达到预防肥胖或减肥的目的。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种AMP 依赖性蛋白激酶,是生物能量代谢调节的关键分子,参与肥胖、脂代谢异常、糖尿病、肿瘤、炎症以及阿尔茨海默病等多种疾病的发生[5],因此近年来逐渐成为研究代谢相关疾病的核心。激活AMPK 可增强组织对胰岛素、葡萄糖摄取和脂肪酸氧化的敏感性,抑制糖异生、胆固醇和甘油三酯的产生,在能量代谢调节方面起到关键性作用[6]。一些天然的活性成分通过激活AMPK 来达到调节机体代谢的作用,如米糠酚提取物能通过激活肝脏中AMPK,进而促进ACC 磷酸化和抑制HMGCR 蛋白表达来改善高脂饲料喂养的小鼠脂代谢受损[7]。富含原儿茶酸、咖啡酸和鞣花酸等酚类化合物的莲子酚提取物能显著降低3T3-L1 细胞内脂质积累,抑制HFD 饲养小鼠体质量的增加,改善血脂水平,增加AMPK 的磷酸化,同时下调脂肪合成相关基因SREBP-1c、ACC1、FAS等的表达,上调脂肪分解相关基因PGC-1α、Sirt1、CPT1α 和脂联素的表达,表明莲子结合酚类物质可能通过调节AMPK 信号通路来减轻肥胖[8]。紫玉米花青素可以下调SREBP-1c基因表达,上调PPARα、PGC1α 等基因的表达,促进肝脏AMPK 活性,抑制脂质合成关键酶ACC 活性,具有预防肥胖的潜力[9]。
据美国粮食及农业组织报道,2017 年中国的板栗产量占全球的83%以上,是全球最大的板栗生产国[10]。板栗加工过程中产生了大量的废料,包括内壳和外壳,约占整个板栗质量的15%~20%[11]。板栗壳色素(Cheatnut shells pigment,CSP)是从板栗壳提取的一种天然棕色素,富含酚类和黄酮类物质,具有抗氧化、抗菌、抗高血糖以及癌症等多种生物活性[12-15],然而目前对CSP 的研究仅局限于体外生物活性,对其体内生理活性功能的研究报道较少。
本实验通过饲喂高脂饲料构建C57BL/6J 小鼠肥胖模型,研究CSP 对肥胖小鼠的脂代谢紊乱的改善作用,并探究CSP 对AMPK 及其相关通路的调控机制。本研究旨在为进一步扩大板栗壳废弃物的应用领域提供理论基础,同时为肥胖和脂代谢紊乱的预防和治疗提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 板栗壳色素 本实验室前期成功提取、分离、纯化得到板栗壳色素冻干粉,并鉴定出13 种酚类物质,分别为儿茶素、原花青素B2、p-羟基苯甲酸、花青素、槲皮素-3-O-葡萄糖苷、表儿茶素没食子酸酯、花旗松素、异鼠李素-3-O-半乳糖苷、橙皮苷、棕矢车菊素、黄芩素4'-甲基醚、异鼠李素、百里香酚-β-D-葡萄糖苷,此外,还鉴定出2种生物碱(千里光碱、辛可宁碱)和1 种萜类化合物(积雪草酸)。
1.1.2 实验动物 50 只4 周龄SPF 级雄性C57BL/6J 小鼠,北京市维通利华有限公司(许可证号:SCXK(京)2021-0006)。
1.1.3 试剂 没食子酸标品(HPLC≥98%)、儿茶素(≥98%),索莱宝公司;甘油三酯(Total triglycerides,TG)、总胆固醇(Total cholesterol,TC)、低密度脂蛋白-胆固醇(Low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白-胆固醇(High-density lipoprotein cholesterol,HDL-C)、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)试剂盒,深圳雷杜生命科学股份有限公司;腺苷酸活化蛋白激酶(AMPK)、磷酸化腺苷酸活化蛋白激酶(p-AMPK(Thr172))、乙酰辅酶A 羧化酶(ACC)、磷酸化乙酰辅酶A 羧化酶(p-ACC(Ser79))、过氧化物酶体增殖物激活受体-α(PPARα)、甲基戊二酰辅酶A 还原酶(HMGCR)、固醇调节元件结合蛋白-1c(SREBP-1c)一抗抗体,Cell Signaling Technology 有限公司;内参β-Tubulin 和二抗抗体,碧云天生物技术有限公司。小鼠基础饲料(3.40 kcal/g,脂肪供能占比12%)、60%高脂饲料(5.24 kcal/g,脂肪供能占比60%),北京科澳协力饲料有限公司。
1.2 设备与仪器
Centrisart D-16C 高速离心机,德国Eppendorf 公司;DM2500 显微镜,德国Laica 公司;KZ-II高速组织研磨仪,Servicebio 公司;FA1004B 分析天平,上海越平科学仪器有限公司;UNIQUE-R20纯水仪,厦门锐思捷生命科学有限公司;-80 ℃超低温冰箱,日本SANYO 公司;TU-1901 紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 CSP 多酚含量的测定 采用福林酚测定总酚含量[16]。取10 μL 1 mg/mL 的CSP 水溶液,加入一定量超纯水进行稀释,然后依次加入1 mL 福林酚试剂和1 mL 10%Na2CO3溶液,超纯水定容至4 mL。在50 ℃下避光反应5 min,于波长765 nm 处测吸光度。以没食子酸作为标准品,计算CSP 中总酚含量。
1.3.2 动物实验 小鼠饲养在SPF 级动物房中,每笼4 只,12 h 黑夜,12 h 光照,温度20~25 ℃,湿度45%~65%,适应性喂养1 周后开始实验。小鼠随机分成5 组,每组10 只。对照组(N 组)饲喂基础饲料,其它组饲喂60%高脂饲料(High fat diet,HFD),分别为高脂饮食对照组(HFD 组)、高脂饮食+低剂量组(HFD-L 组)、高脂饮食+高剂量组(HFD-H 组)和高脂饮食+儿茶素组(HFD-C 组),HFD-L、HFD-H 和FHD-C 组在饲喂高脂饲料基础上每日灌胃剂量分别为20,50 mg CSP/kg 和20 mg 儿茶素/kg,N 组和HFD 组灌胃等体积的超纯水。实验期间,每周称量记录小鼠体质量和饮食量。CSP 处理14 周后,小鼠禁食1 夜,并从眶静脉采集血样,将全血置于4 ℃静置2 h,1 000×g 条件下离心15 min,分离血清备用。取肝和附睾脂肪(Epididymal fat,EP),用生理盐水冲洗、称重,部分肝脏和EP 用于制作病理组织切片,另外一部分肝脏在-80 ℃冷冻备用。所有实验程序均由中国农业大学实验动物福利和动物实验伦理委员会批准(批准编号AW72101202-4-5)。
1.3.3 血清生化指标测定 根据试剂盒说明,测定血清样品中的TG、TC、LDL-C、HDL-C、ALT、AST 含量,以及肝组织中TG 含量。
比较不同服药模式的两组患者所取得的治疗效果,可见中西药结合的治疗方式,能够取得更显著的治疗效果,两组患者治疗效果对比,差异有统计学意义(P<0.05),西药治疗组21例,十分有效8,基本有效5,无效8,总体有效率61.90%;中西药结合治疗组21例,十分有效12,基本有效7,无效2,总体有效率90.48%。
1.3.4 病理组织切片分析 为更方便观察组织细胞的形态学变化,采用苏木精-伊红(H&E)染色法对组织进行染色观察:取小鼠肝脏和附睾脂肪组织,用10%福尔马林固定液固定后,乙醇脱水,石蜡包埋,切片(5~10 μm 厚),苏木精伊红染色。染色切片在光学显微镜下放大200 倍,进行细胞形态观察和图像分析。
1.3.5 蛋白质印迹(Western blots,WB)实验 称取一定量的小鼠肝组织,按1∶10 的比例加入RIPA 裂解液和蛋白酶-磷酸酶抑制剂混合物(50:1)。冰浴研磨,4 ℃、15 000×g 离心10 min,吸取上清液。用BCA 蛋白试剂盒测定蛋白浓度,牛血清白蛋白(Bovine serum albumin,BSA)作为标品。
用SDS-PAGE 凝胶分离含有负载上样缓冲液的蛋白样品,将分离好的蛋白条带转移到聚偏氟乙烯(PVDF)膜上,用5%的牛奶封闭2~4 h,并在4 ℃下用孵育一抗过夜,AMPK、p-AMPK(Thr172)、ACC、p-ACC(Ser79)、PPARα、HMGCR、SREBP-1c 的抗体稀释1∶1 000 使用。然后,用TBS-Tween 20 缓冲液洗涤4 次,每次5 min;室温下孵育二抗(1∶1 000)1 h,然后用TBS-Tween 20缓冲液洗涤4 次,每次5 min 后,用增强化学发光(ECL)底物显示蛋白条带,采用Odyssey 成像系统扫描并通过图像分析软件进行分析,并对抗原-抗体复合物的光密度进行量化,β-Tubulin 作为内参。
1.4 数据分析
实验结果采用SPSS Statistics 17.0 软件进行统计分析,数据用“平均值±标准误差()”表示,采用单因素方差分析(One-way analysis of variance,ANOVA)中的Duncan 多重比较分析组间差异性。
2 结果与分析
2.1 CSP 的多酚含量
没食子酸标准曲线的回归方程为y=12.605x-0.1111,回归系数R2为0.9992,表明回归方程具有可靠性。通过计算得到CSP 粉末中总酚含量为75.92%±1.40%。
2.2 CSP 对肥胖小鼠体质量、脂肪组织质量及组织切片的影响
如图1a 所示,小鼠适应性喂养1 周后,平均体质量为19.8 g,在喂养高脂饲料2 周后,小鼠体质量开始增加,第5 周时,与N 组比较,HFD 组小鼠体质量显著升高(P<0.05),显示肥胖模型造模成功。实验结束时与N 组小鼠体质量增加量【(6.98±0.79)g】 相比,HFD 组小鼠的体质量增加量【(12.87±0.54)g】显著升高(P<0.001)。与HFD组相比,HFD-L 组(9.18±1.12)g、HFD-H 组(7.83±0.81)g 和HFD-C 组(10.4±0.43)g 小鼠体质量增加量均显著降低,且HFD-H 组比HFD-L 组效果更好,说明CSP 降低体质量具有剂量依赖性,在合理给药浓度范围内,剂量越高降低体质量的效果越好。
肥胖通常伴随着白色脂肪质量的增加,而EP是典型的白色脂肪。由图1d 可以看出,与N 组相比,HFD 组小鼠的EP 质量显著升高(P<0.001)。与HFD 组相比,HFD-L、HFD-H 和HFD-C 组EP 质量均显著降低(P<0.05),这与减轻小鼠体质量增长结果相一致。
与此同时,儿茶素(20 mg/kg)也体现出减肥的作用,这与前人的报道相一致[18],而CSP 中也富含儿茶素,因此,儿茶素可能是CSP 抑制高脂饲料喂养小鼠体质量增长的有效成分之一。然而,等剂量儿茶素的作用效果比等剂量的CSP 稍差,可能原因是CSP 提取物含有多种有效活性成分,由于物质之间的降脂具有协同作用,其效果比单一的儿茶素作用效果更好。
2.3 CSP 对肥胖小鼠饮食量和能量摄入的影响
摄食量会严重影响体重的增减,因此控制饮食量,抑制食欲是减肥的重要举措。本实验通过检测小鼠的日常摄食量和能量摄入,探究CSP 对肥胖小鼠减肥作用是否与抑制其食欲有关。如图2所示,N 组小鼠的每日摄食量最大,为(2.13±0.11)g,而总能量的摄入却最少,为(4.58±0.15)kcal。HFD 组饲养高脂饲料,小鼠每日摄食量降低至(1.18+0.07)g 且与N 组相比具有显著性差异(P<0.05),而能量摄入却最高,为(6.19±0.24)kcal,主要是因为与维持饲料相比,高脂饲料的能量大大增加,较少量的高脂饲料就能满足小鼠每日所需,饱腹感较强,故摄入量较少而摄入能量增加;HFD-L、HFD-H 和HFD-C 组小鼠的日常摄食量与HFD 组相比,虽略有降低,但不具有显著性差异(P>0.05),表明CSP 可以在一定程度上起到抑制肥胖小鼠食欲的作用。从能量摄入的角度看,只有HFD-H 组能显著抑制肥胖小鼠的能量摄入(P<0.05)。以上结果表明CSP 可以减少肥胖小鼠的膳食和能量摄入,从而起到减肥的作用。
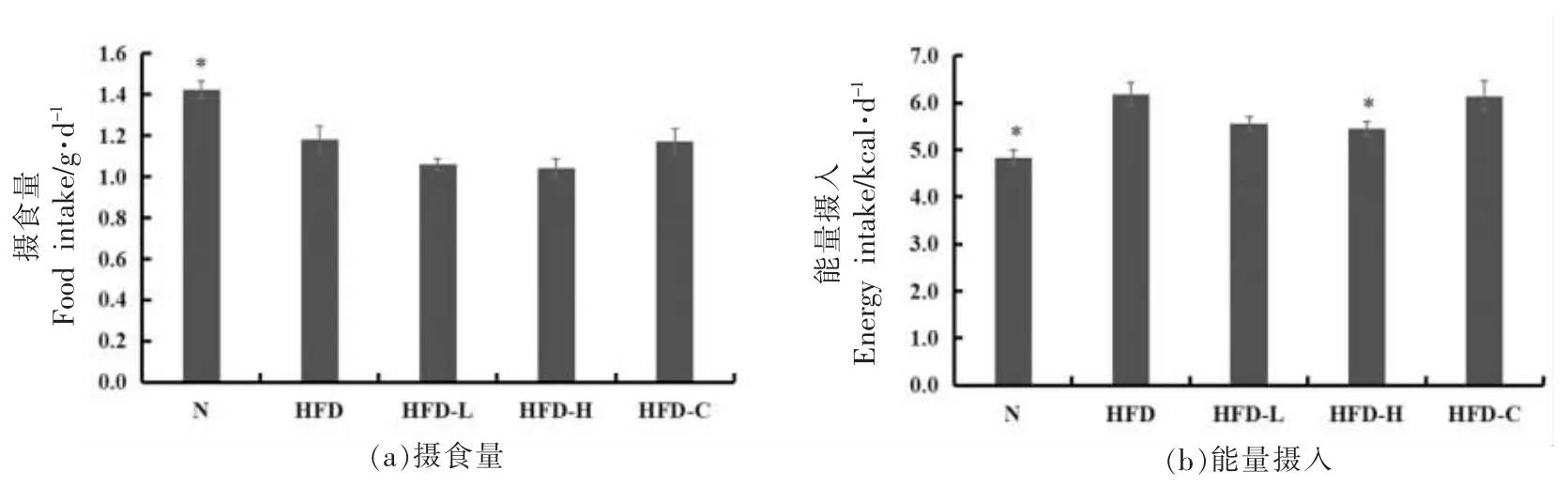
图2 CSP 对肥胖小鼠饮食量和能量摄入的影响Fig.2 Effects of CSP on food intake and energy intake of obese mice
2.4 CSP 对肥胖小鼠血脂的影响
有研究表明,肥胖会导致血清中TG、TC、LDL-C 含量升高,HDL-C 含量降低[19],而血脂 代谢紊乱是高脂饮食诱导的肥胖小鼠的显著特征。如表1 所示,与N 组比较,HFD 组小鼠血清TC、TG、LDL-C 水平极显著升高(P<0.01),HDL-C 水平显著降低(P<0.05),表明肥胖小鼠的血脂代谢发生紊乱。与HFD 组相比,HFD-L 组肥胖小鼠血清的LDL-C 水平显著降低(P<0.05),然而对其它血脂指标没有显著性的影响(P>0.05);提高CSP灌胃剂量(50 mg/kg),可显著降低TC、TG、LDL-C水平,升高HDL-C 水平;而儿茶素的处理能显著降低TC 和LDL-C 水平,升高HDL-C 水平,然而对TG 的降低程度不具有显著性差异(P>0.05)。

表1 CSP 对肥胖小鼠血脂的影响Table 1 Effect of CSP on lipid of obese mice
2.5 CSP 对肥胖小鼠肝功能的影响
肥胖会导致肝脏脂代谢发生紊乱,主要表现为肝脏因脂肪的堆积而肿大。与N 组相比,HFD组小鼠肝脏质量极显著增加(P<0.01),表明高脂饮食会诱导肝脏脂肪的积累,导致肝损伤。对肝脏中的TG 进行定量测定,发现HFD 组小鼠肝脏TG含量与N 组相比显著升高,CSP 和儿茶素均能显著降低TG 的含量。与HFD 组相比,HFD-L(P<0.05)、HFD-H(P<0.01)和HFD-C(P<0.05)组均能降低肝脏质量和TG 含量。ALT 和AST 是检验肝脏功能的重要指标。肝功能受损时,细胞膜通透性下降,分布于细胞胞浆中的ALT 和线粒体中的AST 会发生异常外流[20]。由表2 可以看出,高脂饲养会使血清中ALT 显著增加(P<0.01),然而AST不会升高,表明14 周的高脂饮食处理,不足以损伤肝细胞中的线粒体,使得AST 外流。与HFD 组相比,HFD-L 和HFD-H 组会修复损伤的肝细胞,显著减少ALT(P<0.05)外流。

表2 CSP 对肥胖小鼠肝功能的影响Table 2 Effects of CSP on liver function of obese mice
2.6 肝脏切片病理观察
在肥胖的发展过程中,过多的脂肪热量超过脂肪组织储存的缓冲能力和效率,导致在肝脏等其它组织沉积,形成脂肪空泡。如图3 所示,N 组小鼠肝细胞肝索排列规则,肝细胞胞浆均匀,几乎无空泡样变性和炎症细胞。HFD 组小鼠肝脏脂肪变性明显,有较多的空泡样变性,而3 个处理组均能有效减少脂肪空泡情况。
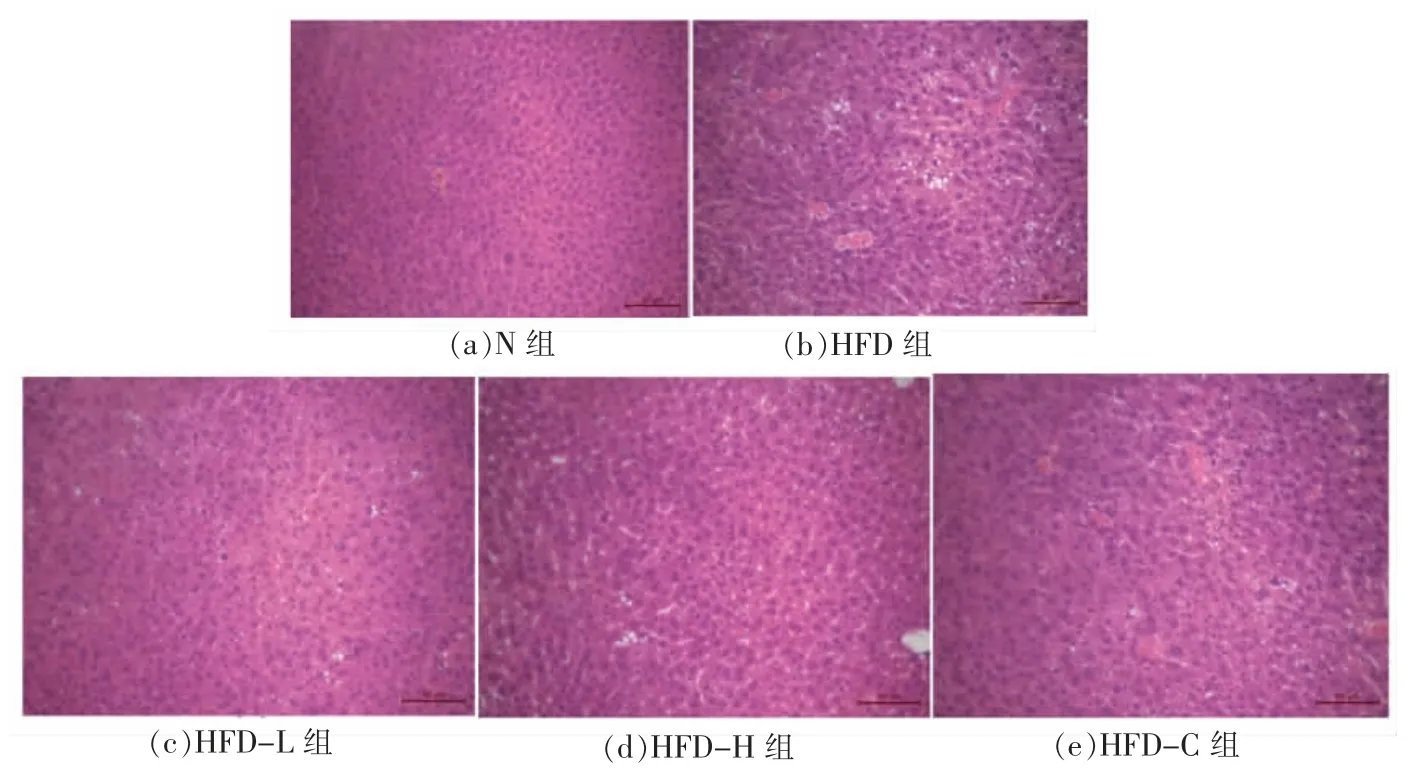
图3 肝脏H&E 染色Fig.3 H&E staining of liver
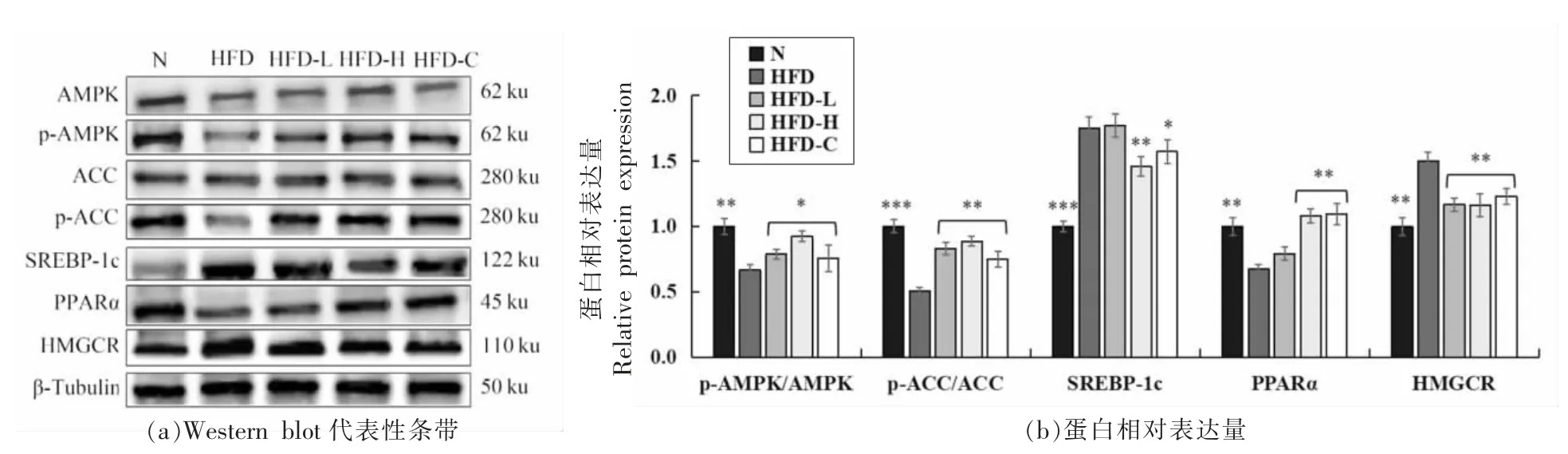
图4 CSP 对肝脏AMPK 通路的影响Fig.4 Effect of CSP on AMPK pathway in the liver
2.7 CSP 对小鼠肝组织AMPK 信号通路蛋白表达量的影响
AMPK 作为一种重要的脂质代谢调节因子,是预防或治疗肥胖的潜在靶点[9]。因此,对肝脏中AMPK、p-AMPK、ACC、p-ACC、SREBP-1c、PPARα、HMGCR 的表达量进行检测。Western blot 结果表明,与N 组相比,长期高脂饲料饲喂使小鼠肝脏p-AMPK/AMPK 水平极显著降低(P<0.01),同时p-ACC/ACC 蛋白表达极显著下降(P<0.001),PPARα 极显著降低(P<0.01),而SREBP-1c(P<0.001)和HMGCR(P<0.01)表达量显著升高。CSP干预后,与HFD 相比,HFD-H 组小鼠肝脏组织中p-AMPK/AMPK(P<0.05)、p-ACC/ACC(P<0.01)、PPARα(P<0.01)的表达均显著上调,SREBP-1c 和HMGCR 的表达均显著降低(P<0.01)。由此可见,CSP 可能通过调控肝脏AMPK 信号通路来改善脂代谢紊乱。
3 讨论与结论
肥胖的特点是脂肪组织在体内过度积累,可导致机体患慢性疾病的风险增加,而植物多酚已被证明可以发挥抗肥胖作用,然而,富含酚类物质的CSP 对脂肪合成和代谢的作用尚未见报道。本实验发现CSP 饮食干预,可以抑制高脂饮食诱导的小鼠体质量、脂肪组织质量的增加,改善了因高脂饮食造成的脂肪细胞肥大及血脂异常,此外,还可以通过促进AMPK 磷酸化,抑制脂肪酸合成,促进脂肪酸氧化,改善肝脏能量代谢从而改善机体肥胖和脂代谢紊乱。
据报道,植物源的儿茶素和原花青素均具有减肥、降脂的功效,如儿茶素被人体摄入后,能抑制胰、胃脂肪酶,降低脂肪乳化从而起到降脂的作用[21],并且茶叶中的儿茶素能通过激活AMPK,调控葡萄糖生成与分解、脂肪酸合成与分解代谢[22]。杨梅原花青素也可以通过激活AMPK 信号通路来调节HepG2 细胞脂质代谢紊乱[23]。因此,CSP 能改善肥胖小鼠的脂代谢紊乱,可能因为CSP 富含儿茶素、原花青素等生物活性成分,从而起到很好的减肥降脂效果。肝脏是人体主要的代谢器官,HFD诱导的肥胖与白色脂肪细胞中脂滴的积累有关[24],甚至在肝细胞中积累脂滴,这可能会导致肝脏脂肪变性,影响肝脏正常的脂代谢功能。本研究发现高脂饮食会导致小鼠肝脏中TG 含量显著升高,这与肝脏H&E 染色的结果相一致,结合肝脏ALT 和AST 指标,表明高脂饮食会导致一定程度的肝损伤,而CSP 能显著修复高脂饮食导致的肝损伤。
腺苷酸活化蛋白激酶(AMPK)被称为“细胞能量调节器”,是细胞一级能量平衡的主传感器和调节因子[6]。多项研究表明,肥胖小鼠肝脏中AMPK活性会被抑制[25]。本实验中,高脂饮食会显著抑制肝脏AMPK 活性,这与之前的报道相一致,而CSP可通过促进AMPK 在Thr172 位点的磷酸化而逆转抑制作用,使得p-AMPK/AMPK 的比值升高,促进能量的分解代谢抑制合成代谢。ACC 能催化乙酰CoA 羧化成丙二酰CoA,被认为是脂肪酸合成过程中的限速酶[26]。AMPK 通过调节下游ACC 的磷酸化,在脂肪酸合成和氧化过程中起重要作用。由ACC 催化生成的丙二酰辅酶A 不仅可作为脂肪酸合成的前体,也是线粒体脂肪酸摄取关键酶CPT-1 的内源性抑制剂[27-28]。CSP 能磷酸化AMPK使其活化,然后能激活ACC 第79 位上的丝氨酸磷酸化位点使其失去活性,进而使体内丙二酰辅酶A 合成减少,不仅降低了脂肪的合成也激活CPT-1,增强了脂肪酸β-氧化作用[29-30],进而改善脂质代谢。此外,AMPK 还能通过介导SREBP-1c调节脂肪酸合成和脂肪酸氧化[31-32]。AMPK 活化后能抑制SREBP-1c 的表达,被抑制的SREBP-1 又进一步降低ACC 的表达,进而抑制脂肪酸的合成。AMPK 也可以调节胆固醇稳态。HMGCR 是胆固醇从头合成的限速酶,可以被AMPK 磷酸化所抑制[33]。CSP 能显著抑制HFD 诱导小鼠HMGCR的蛋白表达,这与降低血清中TC 的结果保持一致。PPARα 通过调节脂肪酸转运和β-氧化以及以脂肪酸和各种脂肪酸衍生物作为内源性配体保持血浆脂质谱来控制肝脏中的脂质通量[26],本研究发现,CSP 能上调PPARα,从而增强脂质氧化,降低血浆中TG、TC、LDL-C 水平,升高HDL-C 水平,改善肝脏脂肪的积累导致的损伤。
如图5 所示,推测CSP 可以靶向作用于AMPK,从而调节肝脏脂质代谢。基于此,研究认为CSP 具有预防肥胖的潜力。同时,CSP 是从农业废弃的板栗壳中提取的天然色素,本研究的结果提供了一种有效的食物辅助预防高脂饮食肥胖的方法,为通过膳食补充来维持代谢综合征患者体内能量平衡提供可能性。
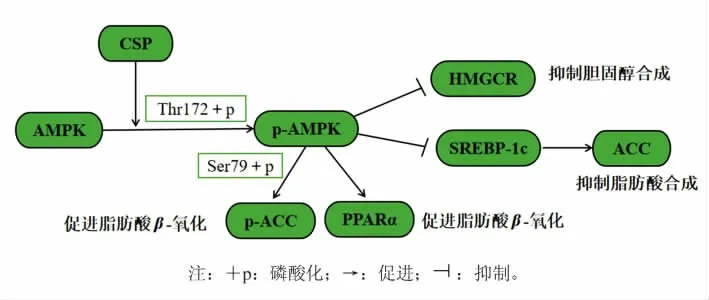
图5 CSP 通过AMPK 信号通路调控HFD 小鼠脂代谢紊乱Fig.5 CSP regulated lipid metabolism disorders in HFD mice through AMPK signaling pathway

