菌剂PA9 降解农田土壤残留氧化乐果研究
陈 锐,瞿 佳,孙晓宇,门 欣,邓 媛,赵玲侠
(1.陕西省微生物研究所,陕西 西安 710043;2.陕西省科学院秦岭天然产物工程中心,陕西 西安 710043)
【研究意义】商品化的有机磷杀虫剂(Organophosphorus pesticide,OPs)有150 余种,常见的有敌敌畏、敌百虫、乐果、氧化乐果和杀螟硫磷等[1]。该类农药主要通过抑制乙酰胆碱酯酶(AChE)发挥毒性作用[2]。过量使用有机磷农药会导致农药大部分残留于土壤或水体中[3-4],给生态带来一定威胁[5]。残留于环境的农药可通过一定途径进入生物体,有报道认为,有机磷农药具有神经毒性,慢性摄入也会导致心血管和肺功能受损以及其他神经系统疾病[6],具有生殖毒性,导致生育能力下降[7],与精神抑郁相关[8],增加癌症发生风险[9]。因此科学的使用有机磷农药并及时去除残留于土壤中的农药对生态环境及人类健康都有一定的必要性。【前人研究进展】喷洒的农药除少数被农作物吸收和作用于靶向生物外,80%~90%通过土壤吸附、大气挥发、降水淋溶以及生物富集等途径积累在土壤环境中[10]。减少土壤中残留的化学物质可采用物理、化学及生物学方法[11]。利用磷酸水解酶、木霉属、假单胞菌属、芽孢杆菌属等微生物对有机磷进行水解、共代谢的生物修复技术,应用生物刺激、化学氧化、光催化等化学修复技术,以及联合修复方法为当前有机磷污染土壤的主要修复方法[12]。生物学方法具有处理成本低、施工简单、无二次污染、对环境影响小等优点。已有研究表明,微生物菌株可有效降解有机磷农药[13],目前已分离出可有效降解马拉硫磷的阴沟肠杆菌(Enterobacter cloacae)和产气肠杆菌(Enterobacter amnigenus)[14]、降解毒死婢和二嗪农的土壤链霉菌(Streptomycessp.)[15]、降解对硫磷的白腐真菌(Phanerochaete chrysosporium)[16]、降解氧化乐果及三唑磷的千叶假单胞菌(Pseudomonas kilonensis)[17-18]等微生物菌株。【本研究切入点】我们前期自周至枣园土壤中 分离筛选获得1株可降解氧化乐果的 嗜松香假单胞(Pseudomonas abietaniphila)菌株ZZY-C13-1-9,在含氧化乐果400 mg/L 发酵培养基中,经30 ℃、180 r/min摇瓶培养240 h,对氧化乐果的降解率达92.3 %[19]。经摇瓶、无菌土壤及室内盆栽实验验证该菌可有效降解氧化乐果。【拟解决的关键问题】为验证该菌株在土壤修复中的实际效果,将该菌制备成菌剂PA9,进行棚室田间土壤试验,评价其对氧化乐果的降解效果,对作物、土壤理化性质、微生物多样性产生的影响做评估。
1 材料与方法
1.1 试验材料
嗜松香假单胞菌ZZY-C13-1-9 制备的微生物菌剂PA9,其16S rDNA序列Genebank登录号为:MN709129。
1.2 试验方法
1.2.1田间试验 试验在陕西省西安植物园实验棚内进行(34°12'53"N、109°2'16"E),试验期限2022 年9 月10 日至10 月30 日,共计50 d。实验地面积80 m2,等分为4 组(每组长5 m、宽4 m),每组再分成3 块,为平行试验。4 组分别设置如下:PA9(菌剂PA9 用量为150 g/m2)、氧化乐果加菌剂处理:PA9-OM(菌剂PA9 用量为150 g/m2,40%氧化乐果乳油2 250 mL,终浓度约100 mg/kg)、氧化乐果对照(OM,40%氧化乐果乳油,氧化乐果农药终浓度约100 mg/kg)及空白对照(CK,图1)。农药及菌剂同时施用,翻耕深度约25 cm。
1.2.2菌剂制备 嗜松香假单胞ZZY-C13-1-9斜面菌株(酵母粉1%,蛋白胨1%,甘油1%,NaCl 0.5%,琼 脂1.8%,pH 自 然,121 ℃,20 min)平板划线活化3 次,选取单菌落,接入液体种子摇瓶,180 r/min,28℃,振荡培养24 h。再将种子液以1%接种量接种至发酵液体摇瓶,28℃、180 r/min 振荡培养60 h,使菌体生物量达峰值。然后4 000 r/min,离心脱水15 min 获得湿菌体。湿菌泥∶甘油∶活性炭∶高岭土按2∶1∶3∶3比例复配成粉状菌剂PA9,其 菌剂中有效微生物达1×109CFU/g,4 ℃保存。
1.2.3土样采集 菌剂施用当天开始土壤监测,每隔10 d 取土样1 次,共取样6 次。利用5 点采样法每组采样1.5 kg,取土深度5~20 cm,3 次重复,共获得土壤样本72 个。每组取样后混合均匀,取1 kg 用于测定土壤理化指标;取2 g 用于测定土壤微生物多样性。余下土样用于测定土壤中农药含量。
1.3 测定指标及方法
1.3.1土壤中氧化乐果残留量测定 称取土壤20 g,加无水硫酸钠研磨至干粉状,移至300 mL具塞锥形瓶中,添加50 mL 二氯甲烷浸泡4 h,过滤取上清,萃取3 次,合并滤液,50 ℃真空旋转蒸发至干,用乙酸乙酯溶解定容至20 mL。残留氧化乐果含量测定采用HPLC uv 检测器,检测波长220 nm,C18 柱,水∶甲醇=4∶1,柱温40℃,流速1.0 mL/min,进样量10 μL[20]。取平均值±标准差,统计学分析采用配对T 检验的方法。
1.3.2功能菌株在土壤中的定殖监测 为验证功能微生物在土壤中稳定存活及增殖能力,分别称取0~50 d 的PA9-OM、PA9 及OM 土壤样本5 g加入45 mL 无菌生理盐水中梯度稀释,将10-4、10-5、10-6的稀释液涂布于含200 mg/L 氧化乐果的营养琼脂固体平板,28℃培养48 h,观察平板上菌落生长情况。各平板随机选取5 个菌落扩培,取菌体进行基因组提取和16S rDNA 序列扩增测序。
1.3.3土壤细菌多样性监测 将处理0~40 d 的各土壤样本干冰寄送至联川生物进行土壤细菌高通量16S V3-4 区测序,分析土壤细菌多样性变化。测序注释后获得OUT 指数;
Shannon 指数=-ΣPilnPi;
聚类分析采用UPGMA(Unweighted Pair Group Method with Arithmetic Mean)方法。
1.3.4土壤理化指标测定 取各土壤样本委托中科院水土保持研究所进行土壤含水量(烘干法)、pH(玻璃电极法)、NPOC(重铬酸钾容量法-外加热法)、微生物碳(氯仿熏蒸浸提法)、全氮(凯式定氮法)、硝态氮(流动分析法)、铵态氮(流动分析法)、微生物氮(氯仿熏蒸浸提法)、全磷(钼锑抗比色法)、速效磷(NaHCO3浸提钼锑抗比色法)、速效钾(NH4OAc 浸提,火焰光度法)含量测定。5 次重复,取平均值±标准差。统计学分析采用配对T 检验方法。
1.3.5番茄生长指标测定 施用菌剂6 d 后按每组实验田6 行、每行14 株移苗栽种番茄苗(金鹏1 号)。移栽后第2 天记录番茄苗株高及叶片大小。每10 d 测定1 次,50 d 后测量结束。随机选取每组5 株测量株高,叶片中段分支5 个,测量第1叶片大小,同时记录叶片上是否有病变。5 次重复,取平均值±标准差,统计学分析采用配对T检验的方法。
2 结果与分析
2.1 土壤中氧化乐果残留量
如图2 所示,修复0、10 d 时,PA9-OM 处理与OM 土壤中的氧化乐果残留量差异不显著。修复30 d 时,PA9-OM 处理的氧化乐果残留量开始显著下降,修复40 d 时氧化乐果降至5.3 mg/kg,降解率达96%,OM 中氧化乐果残留量为48.79 mg/kg,降解率为59%,具有极显著差异。表明菌剂的加入使土壤中的氧化乐果含量显著降低,证实菌剂PA9 在棚室土壤中可加速氧化乐果的降解。

图2 不同修复处理及时间对土壤氧化乐果残留的影响Fig.2 Effects of different remediation treatments and days on omethoate residues in soil
2.2 功能菌株在土壤中的定殖监测
如图3 所示,PA9-OM 处理及PA9 处理土壤样本经稀释涂布后,在选择性平板上有菌落生长,而OM 仅在修复20 d 的土壤样本上有数个菌落生长。在有菌落生长的平板上任意选取5 个菌落扩培,16S rDNA 测序结果如表1 所示,PA9-OM 及PA9 均可检出嗜松香假单胞菌,OM 在修复20 d土壤样本平板上所生长的菌落经鉴定不是嗜松香假单胞,表明菌剂PA9 功能菌株嗜松香假单胞菌可在土壤中定殖。

表1 培养平板上5 个菌落测序鉴定为嗜松香假单胞菌的数量Table 1 Identified number of P.abietaniphila by sequencing from 5 colonies in culture plate

图3 不同修复处理及时间对土壤中嗜松香假单胞菌分离的影响Fig.3 Effects of different remediation treatments and days on isolation of P.abietaniphila from soil sample
2.3 菌剂PA9 对土壤细菌多样性影响
2.3.1假单胞菌属在土壤中变化 如图4 所示,在属水平上,PA9-OM 处理与PA9 的假单胞菌属于优势菌群,PA9-OM 处理的假单胞菌属出现先增长后逐渐下降的趋势,PA9 逐渐下降,OM 的假单胞菌属在较低水平上先增长后降低。空白对照的假单胞菌属则一直处于较低状态。土壤中有残留氧化乐果时,可利用氧化乐果作为碳源的假单孢菌属具生存优势,在土壤微生物菌群中的比例有所增加,当土壤氧化乐果的含量降低时,假单胞菌属失去生存优势,在土壤微生物菌群中的比例降低。

图4 假单孢菌属在不同修复处理及时间中的相对丰度Fig.4 Relative abundance of Pseudomonas in different remediation treatments and days
2.3.2土壤细菌α 多样性变化 细菌微生物组的α 多样性通过Chao1、Shannon、Simpson、Goods coverage 及Otus 等反映。如图5 所示,修复0 d 时,PA9-OM、PA9、OM 与CK 在Chao1、Shannon、Simpson 及Otus 指数上差异显著,PA9-OM 处理的土壤细菌微生物多样性无论从丰富度到均一度均显著低于空白对照,随着修复天数的增加其微生物多样性逐渐恢复。

图5 不同修复处理及时间对土壤细菌α-多样性指数的影响Fig.5 Effects of different remediation treatments and days on α-diversity index of soil bacterial
2.3.3土壤细菌群落β 多样性的变化 对细菌菌群进行属水平的群落聚类分析,结果如图6 所示,所有样本可聚为3 组,修复0、10、20 d 的PA9-OM 与PA9 聚为一簇(A),修复30、40 d 的PA9-OM 与PA9 聚为一簇(C),OM 与CK 聚为一簇(B)。菌剂施用对土壤微生物多样性的影响显著,氧化乐果对微生物菌群影响较低,菌剂对土壤微生物的影响随着修复天数的增长逐渐减弱。将修复0 d 与40 d 的土壤样本进行微生物多样性的主成分分析(PCA)发现,组间差异显著(图7)。在修复40 d 时PA9-OM 处理在微生物多样性组成上比0 d 时更接近CK。说明随着修复时间延长,引入的菌剂对土壤多样性带来的影响逐渐降低。如图8 所示,在门水平上,微生物菌群受菌剂引入的影响显著降低的是绿弯菌门、己科河菌门、浮霉菌门、硝化螺旋菌门、疣微菌门、匿杆菌门、装甲菌门、酸杆菌门、芽单胞菌门的微生物,显著增加的是变形菌门、蓝细菌、厚壁菌门。
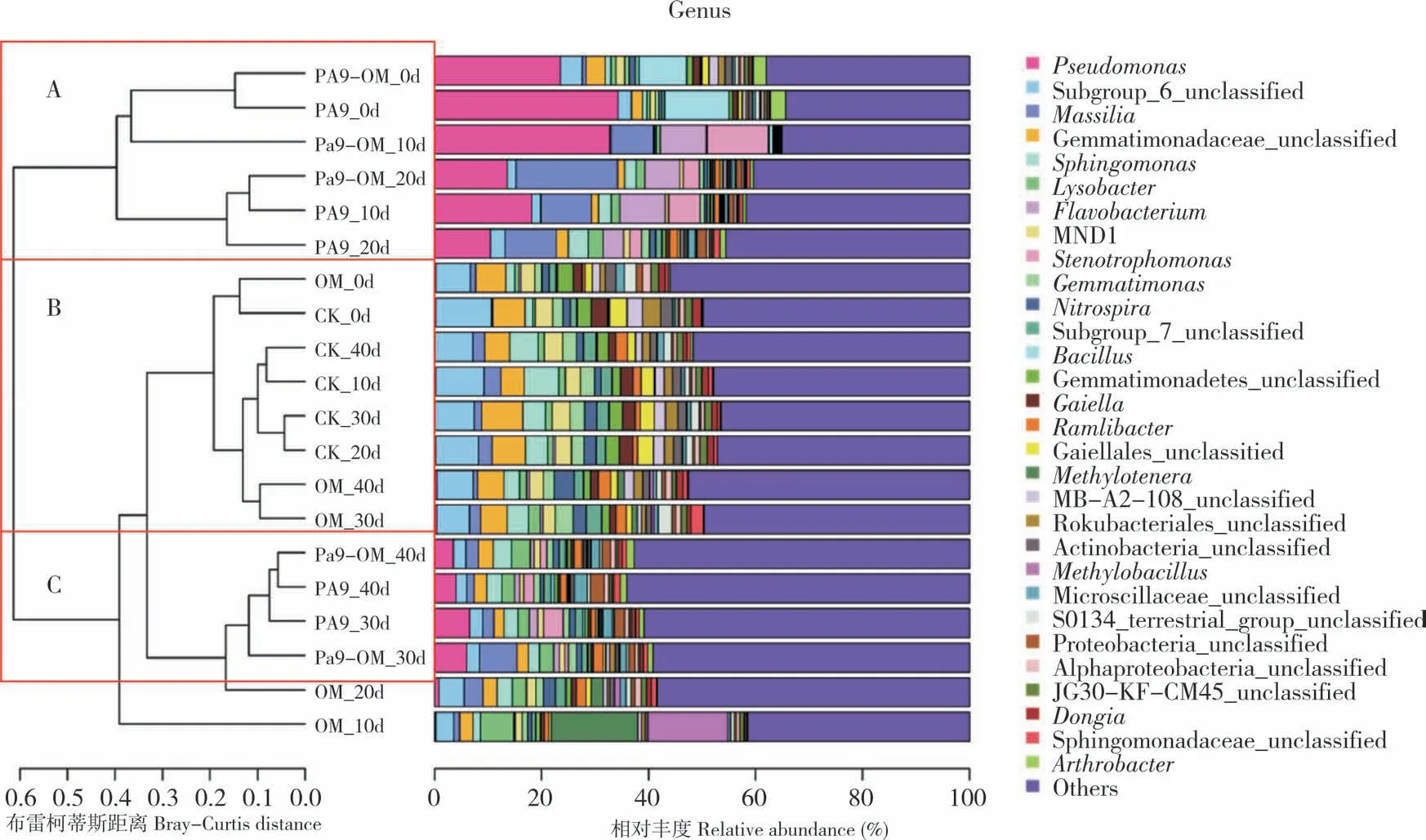
图6 属水平土壤细菌群落聚类Fig.6 Soil bacterial community clustering at genus level

图7 修复0 d 与修复40 d 土壤微生物多样性的主成分分析Fig.7 Principal component analysis(PCA) of soil microbial diversity at 0 d and 40 d after remediation
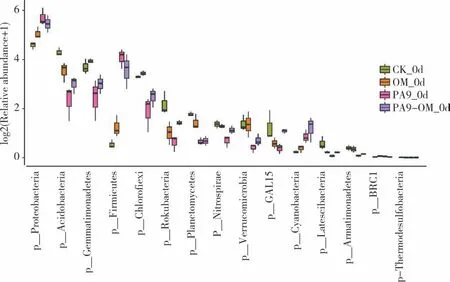
图8 修复0 d 时土壤微生物多样性门水平上的差异Fig.8 Differences in soil microbial diversity at phylum level at 0 d after remediation
2.4 土壤理化指标
从表2 可以看出,PA9-OM 处理的土壤有机质增幅没有空白对照显著,但有机碳及土壤微生物碳含量显著增长。PA9-OM 处理的土壤 全氮、微生物氮、速效磷及土壤团聚体GMD 较空白对照显著增长。微生物碳是活性有机碳,微生物氮是可被作物吸收利用的有效组分,其对于土壤环境的变化比有机碳、有机氮更加敏感。微生物碳、微生物氮的增加说明菌剂组分对土壤微生物碳、氮有所促进。

2.5 番茄生长指标
从图9 可以看出,PA9 处理仅在土壤修复50 d 时与CK 的番茄株高及叶片大小略有差异,PA9-OM 处理与CK 在叶片大小略有差异,叶面未观察到病变。后期挂果及产果观察也证明PA9-OM、PA9、OM 及CK 没有显著差异。可认为PA9菌剂中功能微生物不会造成细菌性病害,菌剂其他组分不会对番茄生长产生不良影响。

图9 不同修复处理及时间对番茄生长的影响Fig9 Effects of different remediation treatments and days on tomato growth
3 讨论
有机磷化合物被公认为是使用最广泛的农药,这些高毒性化学物质的残留物通过渗入地下对生物层构成威胁[21]。调查表明,温室中农药的大量使用和特殊的栽培方式造成土壤严重污染和土壤质量下降。温室土壤中有机氯农药类和邻苯二甲酸酯类的平均浓度均比露地土壤高约100%[22]。残留有机磷对土壤微生物产生不利影响,影响土壤肥力[23],降低土壤酶活及土壤蚯蚓的数量[24],诱导害虫产生抗性[25]。有机磷的慢性中毒亦会导致神经毒性损害,诱导氧化应激,干扰线粒体的功能和微粒体代谢紊乱,导致多种神经性发育障碍[26-28]。
利用微生物学方法可将有机磷农药矿化为完全无害的无机物,且处理成本低、无二次污染,不会影响正常的农业生产,被认为是最具前景的有机物污染修复方式[29]。研究初期,我们已在实验室中证实嗜松香假单胞菌株ZZY-C13-1-9对氧化乐果的降解率达92.3%[19]。以往报道中,许多微生物菌株在有机质降解过程中的表现不佳[30-31],一方面归因于降解微生物无法在土壤环境定殖[32],另一方面复杂的微生物菌群环境可能抑制其功能发挥[33]。因此本研究将ZZY-C13-1-9 制备成菌剂PA9,进行棚室田间土壤试验,验证其在土壤中对氧化乐果的降解效果。一种外源微生物的引入是否会对土壤性质、土壤理化及土壤微生物多样性产生影响[34-36],同时是否导致棚室作物发生微生物病害,引发农药对应病害产生抗性[37],这些问题在本研究中也得到部分解答。目前有观点认为,有机质污染的生物修复效果受限于微生物降解相关酶类。能够降解农药的微生物,主要来自伯克霍尔德菌、假单胞菌和红球菌属的细菌菌株[31],土壤微生物代谢有机磷的可能途径及其相关基因目前也已阐明[38]。通过基因组学、生物信息学、基因编辑等方法对有机磷降解基因和酶进行基因工程改造,强化有机质降解基因及其相关通路,增强其降解效率[39],或直接使用酶类将这些有机污染物水解为无害化学物质进行生物修复是未来污染物处置的新策略[40-42]。这也为我们未来的有机磷污染物降解研究提出新的思路。
下一步我们将对嗜松香假单胞菌株ZZYC13-1-9 降解氧化乐果机制展开研究,前期研究结果表明,PA9 菌株不仅对氧化乐果具有较好的降解效果,对敌百虫及敌敌畏也有较强的耐受性,这一菌株是否对其他类型的有机磷农药也有较好的降解能力有待进一步研究。
4 结论
本研究结果表明,人工添加氧化乐果使土壤中氧化乐果初始含量约为100 mg/kg,再施用0.1%菌剂PA9 进行修复,40 d 后,土壤的氧化乐果含量下降至5.3 mg/kg,对照中则为48.79 mg/kg,差异极显著。微生物菌株ZZY-C13-1-9 可在含有氧化乐果的土壤中有效定殖。土壤细菌菌群多样性得到恢复,土壤全氮、微生物氮、速效磷及土壤团聚体GMD 较对照有显著增长。菌剂PA9 对土壤性质及理化无不良影响,对番茄的叶片大小、株高未产生影响,未产生病害。嗜松香假单胞菌ZZY-C13-1-9 可在土壤中定殖并发挥加速降解氧化乐果的作用,且对土壤及作物无危害。

