乳酸菌表层蛋白功能研究进展
王晓萌,韩张鹏,李佳乐,付梦琪,桑亚新,高 洁
(河北农业大学食品科技学院 河北保定 071000)
表层蛋白(Surface layer protein,SLP)是一种由蛋白质或糖蛋白亚基组成的(糖)蛋白包膜,亚基自组装形成二维晶格,覆盖在不同种类的细菌和古细菌的表面[1]。SLP 晶格类型的示意图见图1,晶格显示为斜(p1,p2)、方(p4)或六边形(p3,p6)对称的规则阵列,形态单元的中心到中心间距约为3 nm 到35 nm,其中六方晶格对称性在古生菌中占主导地位,详见图1[2]。研究发现SLP 广泛存在于古细菌、真细菌和某些革兰氏阳性乳酸菌中[3]。乳酸菌的SLP 具有高度保守性、组成性表达和表面定位特性[4],这些特性在许多领域中得到广泛应用,如精确的分子筛,超滤膜,自组装系统,表面识别,生物传感器,免疫测定等。随着相关研究的不断增多,近年来乳酸菌SLP 生物技术功能被学术界广泛研究发掘:SLP 可以维持细胞形态,为菌体提供保护层的功能;SLP 可以识别并介导混菌体系菌相共生,介导对肠道的黏附能力,在菌间起"桥梁"作用;SLP 的免疫调节应用在疫苗中,以及佐剂的辅助作用;SLP 的高效表达和分泌应用于表达载体和工程菌的构建;SLP 应用在纳米技术诸多领域。通过对知网、Web of Science 和Science Direct 等数据库的检索发现,在SLP 的功能研究中,识别黏附能力以及免疫调节作用为主要研究热点。基于已有研究,本文综述乳酸菌SLP主要功能的研究进展,并从作用途径或物质基础的角度归纳总结,较为系统地阐释乳酸菌SLP 的功能活性、可能的作用机制以及可能的应用领域。
1 SLP 对菌体细胞的支撑和保护作用
维持细胞形态并为菌体提供保护层是乳酸菌SLP 的基本功能。SLP 的厚度为5~25 nm,为维持细菌细胞形态提供胶囊状保护[6],微生物通过最外层的SLP 与环境直接接触,并能够完全覆盖微生物在其生长的所有阶段[7],SLP 可以保护细菌细胞免受环境有害因素的影响,包括环境pH 值的变化、机械和渗透胁迫[8],抗菌肽或溶菌酶、辐射、噬菌体和其它微生物捕食者[7],Satio 等[9]认为在低pH值(pH<4)条件下,短乳酸菌(Lactobacillus brevis)最外层的SLP 减少可能是因为酸性环境触发了SLP 与细胞表面的部分分离,失去SLP 的保护作用会使短乳酸菌形态发生变化,引起短乳酸菌自聚集。SLP 已被证明对测定或维持细胞形状和作为分子筛的功能至关重要,Klotz 等[4]研究发现删除SLP 基因的嗜酸乳杆菌 NCK2532 突变体(Lactobacillus acidophilus NCK2532)经电穿孔试验后细胞表面损坏程度明显大于未删除SLP 基因的菌体,并认为这种差异是由于SLP 对菌体的维持和保护作用带来的,还发现SLP 基因的删除可能严重降低菌体细胞的黏附能力并改变其免疫原性。此外,S 层还可以作为辅助蛋白和糖蛋白的外部展示支架以维持细胞的形态。
2 SLP 在菌间互作的“桥梁”作用
益生菌的固有黏附性能有利于它们的驻留和定植于表面结构。SLP 可能是细菌和宿主免疫系统之间的关键中介,有助于形成对病原微生物、共生微生物和益生菌的驻留、定植和免疫调节[10-11],SLP 在乳酸菌的识别和黏附作用中有着重要的“桥梁”作用。
2.1 SLP 的识别黏附能力介导混菌体系菌相共生
SLP 的保守区域、结构功能甚至表达与否都具有菌株特异性,因此,在不同菌相间的识别机制不同[12],由乳酸菌与酵母菌相互作用构成的混菌发酵体系十分常见,引起了学术界的广泛关注。
甘露聚糖覆盖在酵母菌表面,对酵母菌与外界环境的识别和交互作用具有重要意义,识别甘露聚糖残基是乳酸菌实现黏附的重要途径[13],乳酸菌SLP 与酵母菌甘露聚糖的黏附机制见图2。Pretzer 等[14]测定了14 株副干酪乳杆菌(Lactobacillus paracasei)以甘露聚糖特异性黏附素(mannose-specific adhesin,Msa)凝聚酿酒酵母(Saccharomyces cerevisiae)的能力,通过对Msa 蛋白的结构域同源性分析,鉴定出了已知基因序列lp_1229 的糖结合域,进一步支持其作为甘露糖黏附素的作用,此外,Pretzer 还发现Msa 参与了植物乳杆菌(Lactobacillus plantarum)对酿酒酵母的聚集能力以及与其宿主在肠道的上皮细胞的特异黏附作用。Yamasaki-yashiki 等[15]发现植物乳杆菌ATCC 334 与酿酒酵母IFO0216 的共培养诱导了在纯培养中观察不到的特异性聚集反应,SLP 通过特异性识别酵母甘露聚糖与酿酒酵母接触后,可以诱导植物乳杆菌转运蛋白基因表达,即乳酸菌和酵母的直接接触能够上调SLP 及转运蛋白基因表达水平。Marina 等[16]探究发现甘露聚糖在酵母细胞表面形成一个胶囊状结构,细菌可能通过SLP 的凝集素样活性与囊内的甘露聚糖结合。凝集样活性是细菌产生的拮抗化合物来限制微生物竞争对手的生长的物质,其包括分泌的抗菌肽、蛋白质和多蛋白复合物[17]。外源甘露聚糖的加入会与酵母菌表面甘露聚糖竞争SLP 结合位点,而使凝集反应受到抑制,表明细菌SLP 在这种相互作用中发挥了重要作用,由此推断高加索乳杆菌(Lactobacillus kefiri)和解脂假丝酵母(Saccharomyces lipolytica)混菌体系之间通过SLP 和甘露聚糖相互识别并作用。
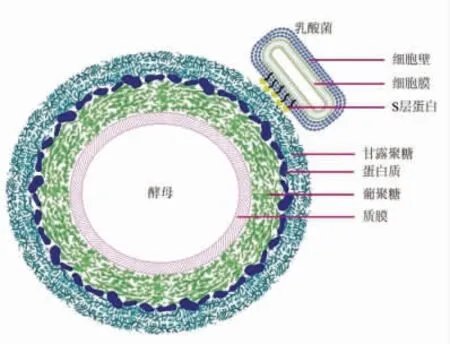
图2 乳酸菌与酵母菌的黏附共生机制Fig.2 The symbiosis mechanism of adhesion in Lactobacillus and Saccharomyces
2.2 SLP 识别黏附能力介导菌体与宿主细胞的相互作用
乳酸菌SLP 最主要的功能是介导菌体与不同表面黏附,如菌株间的自聚集、不同菌株间的共聚集、对肠上皮细胞的黏附等[18]。不仅如此,其所介导的黏附还能够发挥双向调节作用,既能促进肠道定殖发挥有益作用,也能参与抑制致病菌的附着。
2.2.1 SLP 对肠道黏附发挥有益作用 S 层最重要的功能之一是调节细菌对各种靶点的黏附,利用上皮细胞、胶原蛋白和纤维连接蛋白能够筛选具有高黏附能力的益生菌[19]。Zhilan 等[20]研究发现卷曲乳杆菌K313(Lactobacillus crispatus K313)SlpB 的非翻译前导序列(UTLS)作为黏附结构域参与该菌株对人肠道细胞系HT-29 的黏附。Feng等[21]对清酒乳杆菌PO11(Lactobacillus sakei PO11)和植物乳杆菌PO23(Lactobacillus plantarum PO23)的黏附能力进行了研究,经LiCl 处理去除SLP 后,清酒乳杆菌PO11 和植物乳杆菌PO23 对肠上皮细胞的黏附均显著降低,此外,扁口鱼经口服益生菌处理后,植物乳杆菌PO23 定殖率约为未益生菌处理水平的548 倍,因此植物乳杆菌 PO23 被认为是潜在的乳酸菌益生菌,对肠道黏附发挥有益作用。表明高黏性乳酸菌和SLP 在黏附定殖同样起重要作用。
2.2.2 SLP 黏附能力对致病菌抑制作用 乳酸菌SLP 形成细菌的最外层,通过黏附作用可能有助于抑制致病微生物对宿主的附着,表达SLP 的菌株可以更有效的竞争排除病原体,这种竞争排斥是免疫调节的重要途径之一[22]。Wenming 等[22]从卷曲乳杆菌ZJ001(L.crispatus ZJ001)或瑞士乳杆菌(Lactobacillus helveticusc)中提取的SLP 可以抑制鼠伤寒沙门氏菌(Salmonella typhimurium)和大肠杆菌O157:H7(Escherichia coli O157:H7)的黏附[23],此外Zhang 研究发现相较于未去除SLP的乳酸菌,由5 M LiCl 处理去除SLP 的乳酸菌对致病菌的抑制程度显著降低,其中罗氏乳杆菌ZJ617(Lactobacillus reuteri ZJ617)在其研究的5种乳酸菌中对大肠杆菌 k88 的黏附抑制率最有效,可高达为33%,并发现乳酸菌黏附能力与对病原菌的抑制程度成正比。Li 等[24]对嗜酸乳杆菌ATCC4356SLP 的抑菌活性进行了研究,SLP 可直接与Caco-2 细胞系结合或与鼠伤寒沙门氏菌表面结合,从而阻断沙门氏菌附着,能够降低二者之间69%~88%的关联性。Prado Acosta 等[25]认为乳酸菌的SLP 可以通过阻断树突状细胞表面黏附因子3 结合非整合素分子(DC-SIGN)细胞受体,从而抑制细菌感染,嗜酸乳杆菌使用DC-SIGN 作为一种黏附因子,可以与肠道中某些杆菌的SLP 脂多糖组分结合,嗜酸乳杆菌的S 层被证明与DCSIGN[26]受体结合,这种相互作用启动抗原呈递和随后的免疫应答[27]。用SLP 处理表达DC-SIGN 的细胞后,能够在革兰氏阴性和分枝杆菌模型中减少高达79%的细菌感染。SLP 的这种新特性可能有助于解释这些乳杆益生菌株的病原体排除活性,也可作为一种新型的酶抗菌剂来抑制细菌感染和进入宿主细胞。
3 SLP 的免疫调节作用
乳酸菌作为益生菌可以调节和刺激免疫反应,对健康有益[28],乳酸菌SLP 可能是其发挥免疫调节作用的物质基础之一[29]。一些乳酸菌SLP 初级结构是可变的并参与免疫调节[30],通过调节细胞因子水平来调控免疫应答是SLP 免疫调控的重要途径。此外,SLP 具有的佐剂能力和抗原表位呈递功能,能够为疫苗的开发提供理论基础。
3.1 SLP 对细胞因子的调控作用
乳酸菌SLP 可以通过调节细胞因子水平实现免疫调节,Abramov 等[31]以弯曲乳杆菌2029(Lactobacillus crispatus 2029)为试验菌株,以同源基因中的Slp2 为主要研究对象经ELISA 法定量测定细胞因子的产生,研究发现Slp2 蛋白和弯曲乳杆菌2029 细胞均可诱导Caco-2 和HT-29 细胞中的NF-kB 信号通路的激活,并能够抑制巨噬细胞产生的IL-8 和增加抗炎细胞因子IL-6、CXCL1和RANTES 的产生。不仅如此,它们还参与诱导肠道上皮细胞中caspase 9 和caspase 3 的激活和凋亡的发生,从而保护上皮细胞单层免受食源性病原体的直接作用。Ksenijia 等[32]发现含有SLP 的短乳酸杆菌与树突状细胞(moDC)作用后,moDC 的白细胞介素的产生保持不变,TNF-α 的产生受到诱导。尽管属于TNF-α 超家族的细胞因子与炎症性疾病的发生有关,但短暂的炎症状态有助于宿主防御,它们的诱导有益于免疫细胞间的相互作用,而且不会引起疾病或有害影响[33]。Johnson 等[34]通过体外嗜酸乳杆菌NCFM 与小鼠树突状细胞(DC)共孵育试验来评估△prtX 株相对于野生株的免疫调节潜能。PrtX 是一个S 层特定的丝氨酸蛋白酶同源物,嗜酸乳杆菌NCFM(Lactobacillus acidophilus NCFM)染色体中prtX 的缺失使抗炎细胞因子IL-10 在体外小鼠树突状细胞中的表达提高两倍,而虽然促炎细胞因子IL-12 维持不变,但△prtX 组相较于野生组IL-10/IL-12 的比值显著升高,其中抗炎细胞因子占据主导地位,表明SLP 的免疫调节作用显著。
3.2 SLP 在疫苗研发中的作用
SLP 能介导菌体与宿主细胞的免疫增强和抗原呈递作用,结合其自组装特性及独特的物理化学性质可用于疫苗研发。疫苗包含部分致病因子、免疫增强剂或佐剂[35],在SLP 疫苗中,SLP 作为一个有吸附力的工具充当抗原或半抗原载体,可成为辅助疫苗接种的一部分[36],因此SLP 的佐剂能力以及抗原表位呈递作用使其在疫苗研发中具有非凡潜力。
3.2.1 SLP 具有的佐剂能力 SLP 能与免疫细胞相互作用是其充当新佐剂的重要原因之一[36]。Luo等[6]选择制备以花生为主要过敏原的多肽的载体疫苗,并以布氏乳杆菌CD034(Lactobacillus buchneri CD034)SLP 作为佐剂,用于治疗由IgE引起的超敏反应,采用10 份成人血清预孵育后IgE 的平均抑制率为(19.3±11.53)%,高于疫苗lgE平均抑制率,说明SLP 在细胞免疫作为佐剂的效果显著。目前,疫苗佐剂发挥体液或抗体介导的保护机制为主,然而,许多困扰人类和动物的疾病,如结核病和疟疾,都需要细胞介导的免疫才能提供足够的保护[35],因此,作为细胞免疫佐剂,SLP 可以发挥其最大助力作用。
3.2.2 SLP 的抗原表位呈递作用 SLP 作为“桥”是具有良好生物稳定性的包覆体,这归因于“配体-受体相互作用” 效应,SLP 包覆体极有可能成为药物传递和生物医学用途的理想平台。乳酸菌SLP 因其易获得、安全性高等特性,是疫苗开发中作为抗原表位载体的极佳候选材料[37]。Julia 等[37]制备了布氏乳杆菌CD034 的融合蛋白SlpBAH3a42,该肽由免疫显性的B 细胞表位和一个T细胞表位组成,检测花生过敏患者血清中抗SlpBAH3a42 或Ara h2 特异性IgG 兔抗体对IgE 结合的抑制能力,血清中有69%检测到SlpB-AH3a42融合蛋白特异性IgE,这种新方法开发为SLP 呈递抗原表位的新型疫苗的可行性提供了依据。Knobloch 等[38]利用含有重组蛋白的干酪乳杆菌(Lactobacillus casei)、短乳酸杆菌等乳酸菌进行免疫标记试验,认为上述乳酸菌可以异源表达和高效分泌来自巴氏芽孢八叠球菌(Sporosarcina ureae ATCC 13881)的血细胞凝集素表位标记型表层蛋白SslA,构建了3 个嵌合蛋白,包括人流感血凝素表位标记的表层蛋白SslA 的前体、C 末端残基和N 端、C 末端残基形式,分离出的SLP 是含有融合血细胞凝集素标记的高度有序结构,能够在体外结晶、可被抗体识别。由此可见,细菌或细胞表面的SLP 能够高密度、精确定位的呈现功能表位。
4 SLP 在工程菌的构建中高效表达和分泌作用
工程菌的构建在蛋白质的研究中发挥巨大作用,然而基因表达系统往往产生低水平的重组蛋白,高效分泌表达成为迫切需求[39]。SLP 通过各种机制固定在细胞壁上或释放分泌到周围的介质中[40],乳酸菌SLP 基因存在多启动子结构,具有高效表达的特性。不仅如此,乳酸菌SLP 基因转录产物的稳定性也有助于SLP 的高水平翻译[41]。
4.1 SLP 高效表达在工程菌株构建中的作用
Kahala 等[42]以短乳酸杆菌SlpA 基因的表达信号为基础,利用β-葡萄糖苷酶(gusA)、荧光素酶(luc)和氨肽酶N(pepN)3 个报告基因导入低拷贝数载体pKTH2095,构建表达载体并研究SlpA启动子在乳球菌、植物乳杆菌和加氏乳杆菌中生产报告基因相应蛋白的效率,短乳酸杆菌的SlpA基因的表达信号起着非常强的启动子的作用,最终的蛋白质产量高达细胞内总蛋白的50%,比常规乳酸菌表达高35%~40%[20]。外源蛋白在细菌中成功表达的关键因素之一是高效启动子的选择,Lizier 等[43]研究了3 种不同乳酸菌的启动子在乳酸乳球菌(Lactobacillus lactis)中驱动增强型绿色荧光蛋白(EGFP)表达的能力大小,3 种启动子中罗伊氏乳杆菌来源的启动子GFP 表达量最高,带有slp-GFP 载体的乳酸乳球菌的GFP 表达量明显高于未带有SLP 的载体,选择有效启动子和SLP 的辅助作用均可以得到高效表达目的基因的乳酸菌类工程菌。
4.2 SLP 的高效分泌在基因表达载体构建中的作用
乳酸菌的胞外蛋白主要由SLP 和释放到胞外的胞内分泌蛋白组成[44]。细菌会将过量产生的SLP储存在肽聚糖层或分泌到环境中,SLP 的分泌能力与其N 端信号肽密切相关。Lin 等[39]以来自乳酸乳球菌的β-1,4-甘露聚糖酶(ManB)基因作为报告基因,构建了包含SlpA 蛋白和信号肽(SPSlpA)的载体,研究对载体驱动ManB 基因在乳酸乳球菌中的表达能力进行了评估,结果表明SPSlpA不仅被乳酸乳球菌分泌机制功能性识别和加工,而且SPSlpA分泌的ManB 的效率高达80%,SPSlpA可以同时输出分泌的和锚定的ManB,表明SPSlpA和全长的SlpA 可能是一个很好的输出信号或细胞表面的候选。Axel 等[45]将编码短乳酸杆菌表层蛋白(SlpA)的ORF 克隆到乳酸乳球菌中,发现SlpA蛋白的相对含量与生长期有关,诱导22 h 后(稳生期)SlpA 表达水平最高,分泌量增加到初始水平的8 倍以上,SlpA 的高效表达极大程度的增加构建表达载体的成功率和目标基因的表达量,短乳酸杆菌的高效生产和分离SLP 在生物技术上也有着广泛应用,它为生产S 层稳定脂质体提供药物传递和定点肽表位固定化等方面开辟了新的可能性。
5 SLP 在纳米技术中的应用
乳酸菌SLP 的结构和物理化学重复性、均匀性均达到亚纳米尺度,现如今已经应用在生物技术和仿生学中[46-47]。乳酸菌SLP 的织物/纤维及其独特结构的研发,为乳酸菌SLP 的仿生能力应用在纺织品中提供了黄金机遇,Asadi 等[48]利用嗜酸乳杆菌ATCC 4356 细菌的SLP 在纺织品表面成功重结晶,发现在30 min、pH 值为5 时聚丙烯织物具有最佳复合性能。目前S 层通过模仿古生菌或病毒的超分子表面结构也被用于支持脂膜或脂质体,脂膜和脂质体是具有双分子层结构的与皮肤细胞膜结构相同的人工膜,是SLP 制备超分子结构是纳米技术领域的一个新进展[7]。SLP 具有重复的空间结构,可以作为模板用于制备稀有金属纳米颗粒催化剂,Bolla 等[49]以两株高加索乳杆菌SLP 为模板,在Pt/CBS8348 和Pt/CBS83111 催化剂中观察到纳米和亚纳米Pt 团簇,成功获得了铂质生物催化剂并实现了重复使用性,且催化转化率在75%~90%之间,具有较高的催化活性。由此可见,乳酸菌的SLP 在仿生、催化、传感器和生物医学[50-51]等纳米级系统领域都有广泛前景。
6 结论与展望
本文综述了乳酸菌SLP 的支撑保护、识别黏附、疫苗研发、免疫调节、仿生能力等功能,表明了SLP 作为生物大分子物质,在工业、医药等领域的巨大开发潜力。乳酸菌SLP 被认为是地球上最丰富的生物聚合物之一,不仅具有来源丰富、容易提取的优点,还具有良好的安全性,在蛋白质资源开发利用中具有广阔的前景。

