牡丹籽中苦味成分的分离与鉴定
曹康宁,彭帮柱
(华中农业大学食品科学技术学院 武汉 430070)
牡丹作为中国传统的“药食两用”植物,其花和根具有清热解毒、活血化瘀等功效,是药用主体。牡丹籽是药用植物牡丹花的种子,一直作为中药材丹皮的副产物被丢弃,尚未得到合理的利用。近年来,有学者的研究表明,牡丹籽中营养成分较高,含有丰富的不饱和脂肪酸资源,其中α-亚麻酸的含量高达43%,约是橄榄油的80 倍、菜籽油的5 倍[1],具有抗衰老、抗真菌、抗发炎及预防心血管疾病的作用[2-5]。此外,牡丹籽中还含有萜类[6-7]、芪类[8-9]、黄酮类[9]等成分,具有巨大的开发潜力。
自2011 年牡丹籽油被列为新资源食品后,牡丹籽的开发利用受到广泛关注。目前市场上牡丹籽的产品仍以籽油为主,其它相关食品未见报道。原因可能是牡丹籽具有苦味,易引起牡丹籽油及其产品的苦涩味,因此限制了其加工利用。至今,对牡丹籽的研究主要集中于牡丹籽中营养成分及生理功能研究,对其苦味物质研究较少。鉴于此,本研究采用有机溶剂萃取与感官评价相结合的方法,利用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UPLC-HRMS)对牡丹籽中的苦味物质进行分离与鉴定,以期为牡丹籽苦味成分解析和脱苦机制研究与开发利用提供技术参考。
1 材料与方法
1.1 材料与试剂
油用牡丹籽,在2020 年10 月上旬采摘于湖北省宜昌市某产业园区,颗粒饱满,成熟充分。
分析级氢氧化钠、正己烷、正丁醇、乙醇、盐酸奎宁,购买于国药集团化学试剂有限公司;色谱级甲酸、乙腈,购于武汉弗顿科技有限公司;食品级柠檬酸,购于商丘耕道电子商务有限公司;AB-8大孔吸附树脂,购于源叶生物有限公司。
1.2 仪器与设备
SB-400 DTY 超声清洗机,购于宁波新芝生物科技股份有限公司;LGJ-10 真空冷冻干燥机,购于北京松源华兴科技发展有限公司;RE-52AA旋转蒸发仪,购于上海亚荣生化仪器厂;电热鼓风干燥箱,购于上海一恒科学仪器有限公司;Thermo QE PLUS 四极杆/静电场轨道阱高分辨质谱、Ulti-Mate 3000 高效液相色谱仪,购于美国Thermo Fisher 公司。
1.3 方法
1.3.1 牡丹籽前处理 将脱壳后的牡丹籽按料液比1∶5(m/V)置于质量浓度为0.004 g/mL、温度为100 ℃NaOH 溶液中,热烫处理3 min,玻璃棒搅拌去皮后用清水洗净。将去皮牡丹籽置于60 ℃热风干燥至恒重,粉碎后备用。
1.3.2 正己烷和水溶液浸提 称取处理好的牡丹籽粉末50 g,用250 mL 正己烷室温浸提4 次。每次浸提12 h,合并滤液后真空旋转蒸发获得组分F-Ⅰ,残渣放于60 ℃热风干燥12 h。
将残渣按照料液比为1∶20(m/V)置于50 ℃、pH 值为4 的柠檬酸水溶液中,超声处理6 h,功率为350 W,频率为40 kHz。将脱苦处理的上清液真空旋转蒸发浓缩,冷冻干燥后获得组分F-Ⅱ;超声处理后残渣经60 ℃热风干燥12 h,获得组分F-Ⅲ。
1.3.3 正丁醇萃取 将组分F-Ⅱ用蒸馏水溶解至100 mL 后,用100 mL 饱和正丁醇溶液萃取3次,合并正丁醇萃取部分,70 ℃真空旋转蒸发浓缩后冷冻干燥,获得F-Ⅱ-1 组分;水相部分70 ℃真空旋转蒸发浓缩后冷冻干燥,获得组分F-Ⅱ-2。
1.3.4 大孔树脂纯化 AB-8 大孔树脂经预处理[10]后,采用湿法装柱填充到层析柱(30 mm×200 mm)中,填充量为50 mL。将F-Ⅱ-1 组分溶解于10 mL 蒸馏水并上样至AB-8 大孔树脂层析柱中,依次用蒸馏水、30%乙醇、50%乙醇、75%乙醇、100%乙醇进行梯度洗脱,洗脱速度为4 mL/min,洗脱体积为10 倍柱体积(500 mL)。收集洗脱液,真空旋转蒸发浓缩后冷冻干燥,获得组分F-Ⅱ-1-MR1、F-Ⅱ-1-MR2、F-Ⅱ-1-MR3、F-Ⅱ-1-MR4 和F-Ⅱ-1-MR5。
1.3.5 感官评价方法 筛选7 位(4 女3 男)经苦味感官训练的人员进行评价,年龄在20~35 岁之间。以盐酸奎宁溶液为参考评估苦味强度(表1),将1 mL 不同浓度的盐酸奎宁溶液呈现给带鼻夹的感官小组成员,并要求在口中短暂旋转样品,然后将其吐出,用蒸馏水漱口。
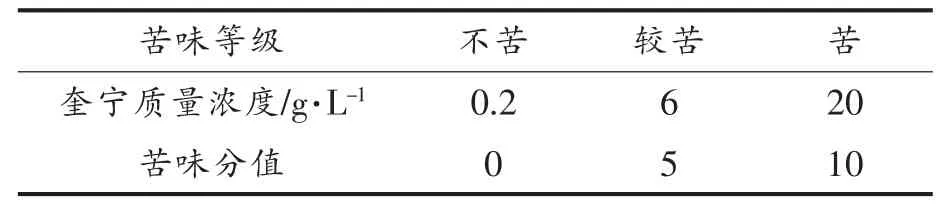
表1 苦味评分等级及分值Table 1 Grade and scores of bitter
组分F-Ⅰ和F-Ⅲ直接感官评定外,其余组分用4%的乙醇溶液溶解并定容至200 mL,然后用于感官评价。感官小组成员以盐酸奎宁溶液为参照,在0~10 之间评价苦味[11]。本次感官分析采用的溶剂水均为蒸馏水,采用3 位数随机标注样品编号,试验样品感官评定重复3 次,每次间隔10 min。
1.3.6 苦味得率的计算 苦味组分得率按照公式(1)进行计算。
式中:X——苦味组分质量,g;X0——牡丹籽粉末质量,g。
1.3.7 液相色谱-质谱分析
1.3.7.1 液相色谱分析条件 将苦味组分F-Ⅱ-1-MR2 和F-Ⅱ-1-MR3 分别用超纯水和50%乙醇溶解,过0.22 μm 滤膜,备用。采用Agilent Eclipse Plus C18 色谱柱(2.1 nm×100 nm,1.8 μm);流动相:0.1%甲酸水溶液(A)和乙腈(B);流速0.3 mL/min;进样量1 μL;柱温30 ℃;洗脱梯度:0~5 min,5%~10%(B);5~25 min,10%~45%(B);25~30 min,45%~75%(B);30~35 min,75%~95%(B);35~36 min,95%~5%(B);36~40 min,5%(B)。
1.3.7.2 质谱分析条件 采用电喷雾离子源(ES I);扫描模式:负离子模式;扫描范围:m/z 80~1 200;毛细管电压:2 500 V;锥孔电压:440 V;干燥气温度:350 ℃;干燥气流速:600 L/h;碎裂电压:30 和50 eV。
1.3.8 数据处理 试验结果用平均值±标准差表示,重复3 次。用Origin 2018 软件对数据进行处理绘图。
2 结果与分析
2.1 感官评价及苦味得率结果
各组分物质的苦味分值及得率见表2。
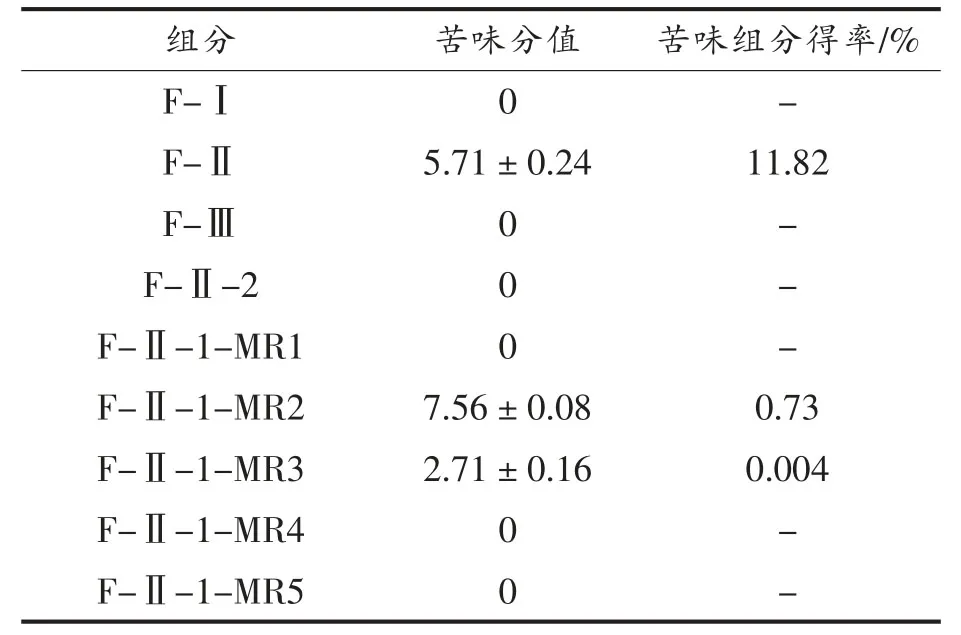
表2 感官评价结果及苦味组分得率Table 2 Sensory evaluation results and the yield of bitter components
正己烷提取组分F-Ⅰ为油状层,除去挥发溶剂后经感官品尝无苦味,该提取物为牡丹籽油。正己烷残渣经水提获得的组分F-Ⅱ苦味加重,而水提残渣F-Ⅲ无明显苦味,说明pH=4 的水溶液能够有效提取牡丹籽中的苦味物质。用饱和正丁醇进一步萃取组分F-Ⅱ,获得正丁醇组分F-Ⅱ-1 和水层组分F-Ⅱ-2,且组分F-Ⅱ-2 显示出甜味,说明牡丹籽苦味物质聚集在正丁醇层F-Ⅱ-1中。通过AB-8 大孔树脂对正丁醇组分F-Ⅱ-1 进一步分离纯化,获得5 个组分。组分F-Ⅱ-1-MR1具有轻微甜味,未显示明显苦味;组分F-Ⅱ-1-MR2 是一种白色粉末状物质,得率最高,苦味程度最高;组分F-Ⅱ-1-MR3 是一种褐色粉末状物质,也具有苦味;F-Ⅱ-1-MR4 和F-Ⅱ-1-MR5 所得冻干量很少,经感官评价未显示出明显苦味。
经感官评价及得率可见,牡丹籽中的苦味物质主要集中在30%和50%乙醇洗脱液中,即组分F-Ⅱ-1-MR2 和组分F-Ⅱ-1-MR3 中,该方法实现了对牡丹籽中苦味组分的有效分离,获得了较高纯度的牡丹籽苦味组分,有利于下一步的分析与鉴定。
2.2 苦味组分鉴定
2.2.1 组分F-Ⅱ-1-MR2 鉴定 F-Ⅱ-1-MR2 为白色粉末,是苦味物质提取率最高的组分。采用UPLC-HRMS 对其进行分析,共鉴定出7 个化合物,其中化合物C1-C6 均为单萜类化合物,见表3。
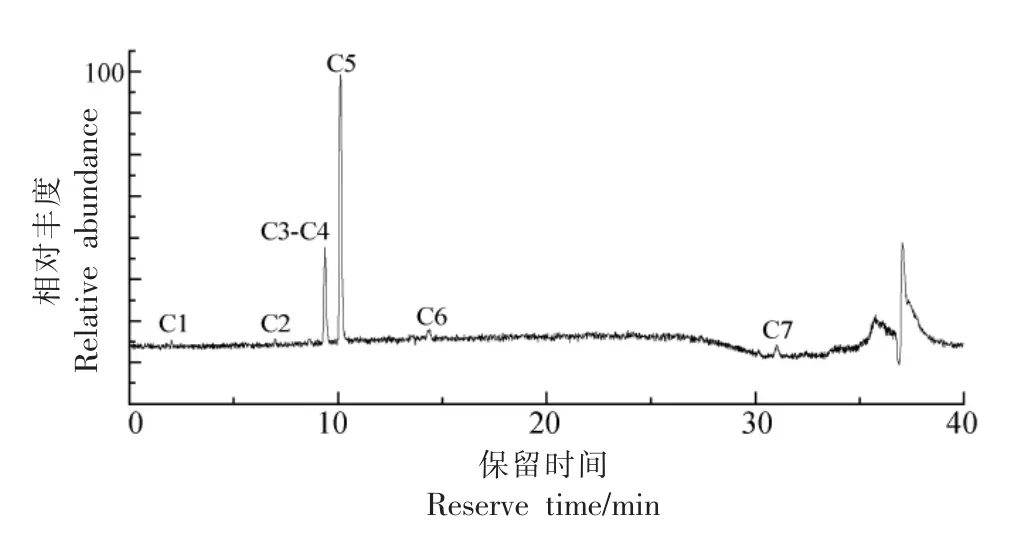
图1 组分F-Ⅱ-1-MR2 的总离子图Fig.1 Total ion current chromatograms of F-Ⅱ-1-MR2
化合物C1,保留时间为1.94 min,在m/z 405.1396[M-H]-处产生分子离子峰,根据元素组成计算其分子式为C16H24O9,在m/z 359,197,178 处存在3 个二级质谱碎片。其中,分子离子m/z 405.1396[M-H]-脱去一分子甲酸(46 u)得到m/z 359[M-H-HCOO-]-,碎片m/z 197.08 [M-H-HCOOGlu]-为去甲酸后再断裂失去1 分子葡萄糖基获得,碎片m/z 179 [M-H-HCOO-Glu-H2O]-对应失去1 分子水。经过对比保留时间和文献碎片[12-13],初步断定化合物C1 为牡丹酮1-O-β-D-葡萄糖苷。
化合物C2,保留时间为7.06 min,MS 图显示该物质在m/z 495.1505 [M-H]-处有分子离子峰,并在MS2 质谱上存在碎 片m/z 495,465,281,165,137,推测其分子式为C23H28O12。碎片m/z 465[M-H-CH2O-]-与分子离子差30 u,由分子脱去葡萄糖基上的甲氧基(30 u)获得,m/z 333[M-HGlu-]-与分子离子脱去一分子葡萄糖基有关,在m/z 165 处的碎片被鉴定为芍药苷类特征碎片——蒎烷基本骨架,m/z 137 对应断裂后所剩的对羟基苯甲酸结构,与文献[14],[15]所述氧化芍药苷二级质谱碎片一致,结构式见图3a,故鉴定化合物C2为氧化芍药苷。
化合物C3、C5 和C6 的出峰时间分别在9.25,10.16 和14.45 min,在ESI(-)模式下,出现强度不同的甲酸加和离子峰m/z 525.1607 [M+HCOO]-,即均存在m/z 479[M-H]-分子离子峰,推测为芍药苷及其异构体。其中,化合物C5 的MS2质谱碎片分别 为m/z 449,327,165,121(见 图2a),碎片m/z 449[M-H-CH2O]-由去甲酸分子m/z 479[M-H]-失去葡萄糖基中的甲氧基(30 u)形成,继而失去1 个苯甲酸(122 u)形成特征碎片m/z 327[M-H-CH2O-C7H6O2-]-;m/z 327[M-H]-丢失1分子葡萄糖基获得蒎烷基本骨架结构的碎片(m/z 165)[15],最后蒎烷基本骨架断裂,脱去1 个苯甲酰取代基,产生m/z 121 [M-H]-离子碎片,与文献[16-17]所述芍药苷质谱裂解规律一致,结构式见图3b,确定化合物C5 为芍药苷。根据出峰时间顺序,推断化合物C3 可能为芍药内酯苷(离子碎片见图2b,结构式见图3c),化合物C6 为牡丹皮苷I。
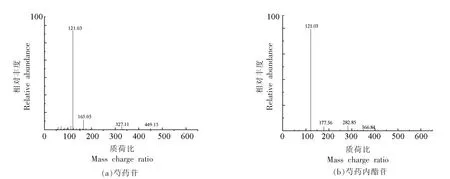
图2 组分F-Ⅱ-1-MR2 部分化合物的二级质谱图Fig.2 MS2 spectra generated from some bitter compounds of F-Ⅱ-1-MR2
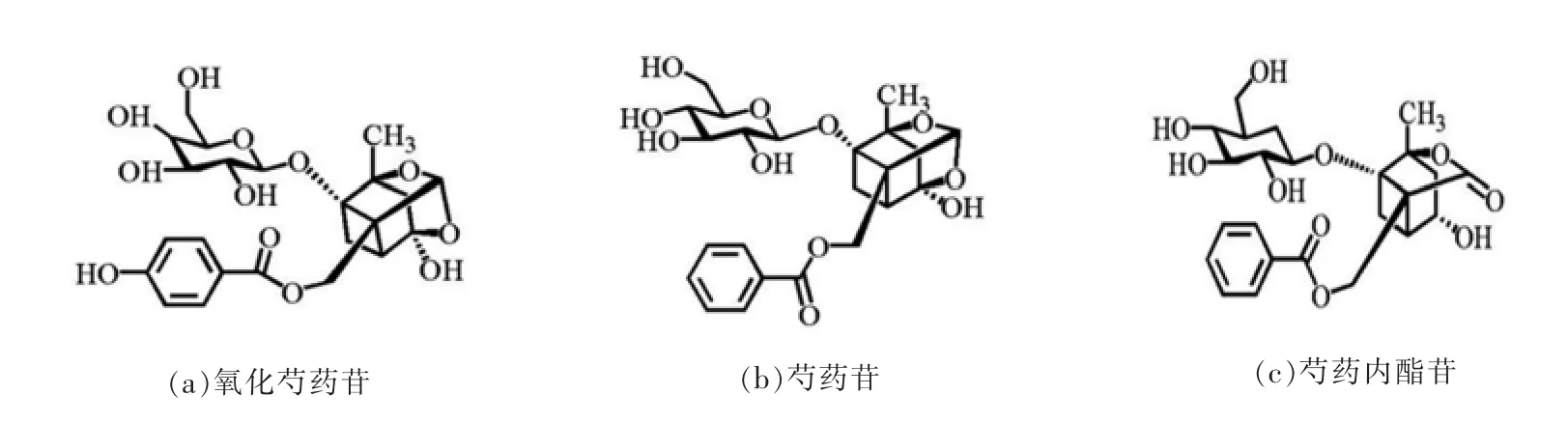
图3 组分F-Ⅱ-1-MR2 部分单萜苷类化合物的结构式Fig.3 Structure of some monoterpene glycosides in F-Ⅱ-1-MR2
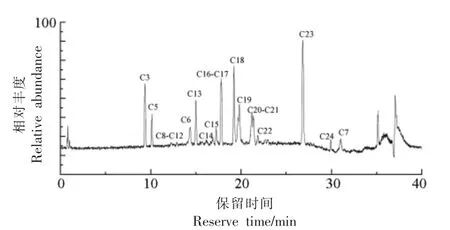
图4 组分F-Ⅱ-1-MR3 的总离子图Fig.4 Total ion current chromatograms of F-Ⅱ-1-MR3
化合物C4,保留时间为9.47 min,MS 图显示该物质具有m/z 687.2128 [M-H]-离子碎片,MS2图中含有特征碎片m/z 593,471,323,165,121,与分子式C30H40O18相对应。该物质具有单萜蒎烷骨架特征碎片m/z 165,推测其为芍药苷类物质。经与文献[18-19]碎片对比,初步断定为异麦芽芍药苷(isomaltopaeoniflorin)。
化合物C7,保留时间为31.04 min,MS 质谱图显示高丰度的碎片m/z 265.16[M-H]-,含有N 元素,经Xcalibur 软件计算该物质分子式为C5H17O3N10。具体结构待进一步确定。
萜类化合物中具有内脂、内缩醛、糖苷键等可以形成螯合物而具有苦味。曹煌[20]通过电子舌仿生技术对白芍药材样品和不同浓度芍药苷单体进行识别,结果显示其滋味均显示苦味,该结果与Zhang 等[21]报道一致。组分F-Ⅱ-1-MR2 得率最高,鉴定出的化合物中以芍药苷类为主,推测芍药苷类化合物是牡丹籽的主要苦味成分。
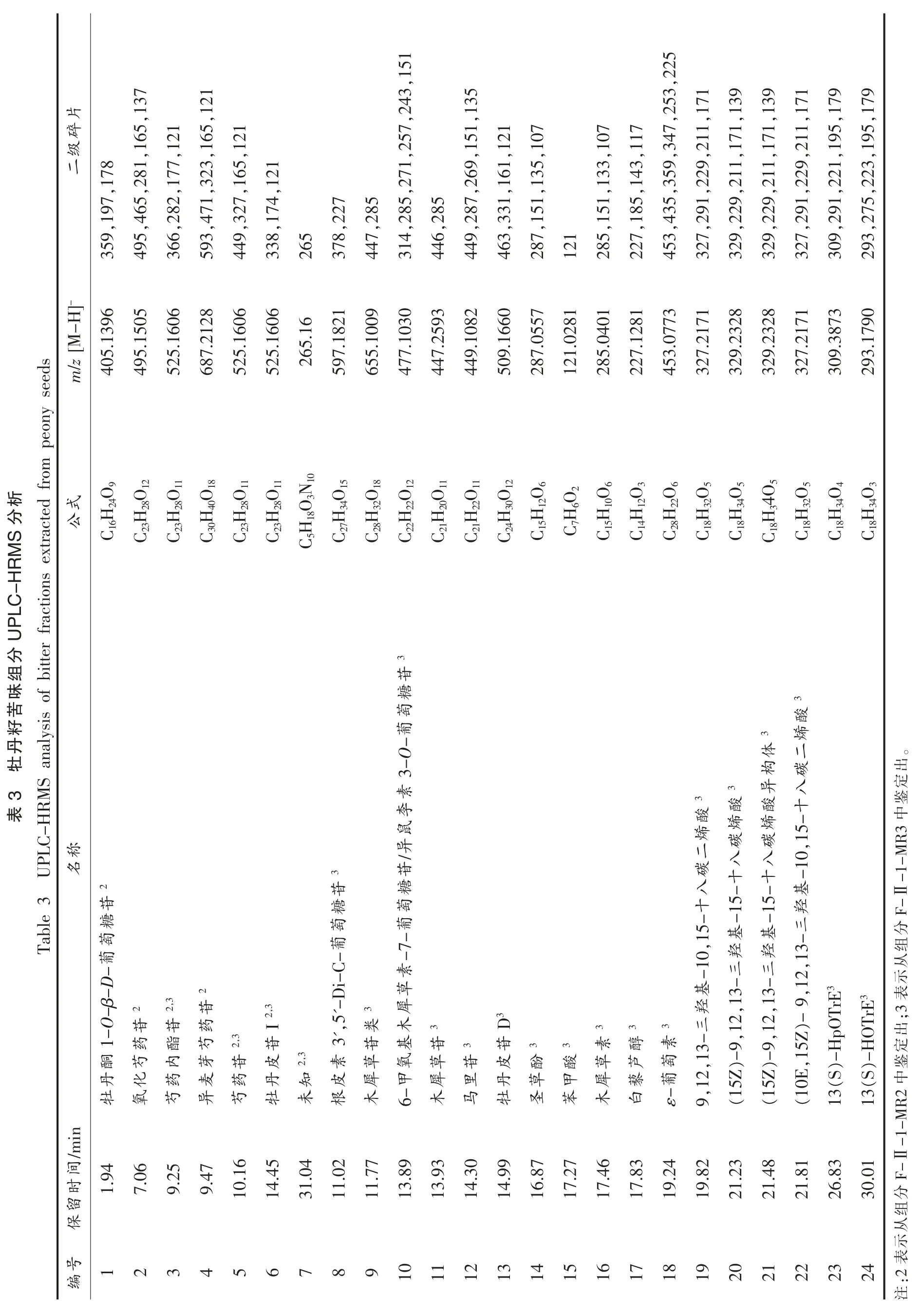
2.2.2 组分F-Ⅱ-1-MR3 鉴定 从组分F-Ⅱ-1-MR3 共鉴定出21 种化合物,化合物C3、C5、C6 和C7 也存在于F-Ⅱ-1-MR2 组分中,化合物中C13属于单萜类化合物,C15 为有机酸类,C17、C18 为芪类化合物,C19-C24 为三羟基脂肪酸类化合物,其余均为黄酮类化合物,见表3。
化合物C8,保留时间为11.02 min,MS 图显示该物质具有m/z 597.1821 [M-H]-离子碎片,推测分子式为C27H34O15,根据ChemSpider 数据库匹配,推测该物质为根皮素3',5'-Di-葡萄糖苷。
化合物C9-C11 的分子质量和保留时间均不同,但它们都具有木犀草素类特征碎片m/z 285,因此被鉴定为木犀草素糖苷类化合物。化合物C9的保留时间为11.77 min,MS 图中存在高丰度碎片m/z 655.1009 [M-H]-,为该物质准分子峰,确定分子式为C28H32O18。MS2图中含有特征碎片m/z 447,285,151,133,推测其为木犀草苷类化合物。化合物C10,保留时间为13.89 min,在m/z 477.1030 [M-H]-存在分子离子峰,与分子式C22H22O12对应。基于其它离子片段m/z 314,285,271,257,243,151,与ChemSpider 数据库进行比对,鉴定其为6-甲氧基木犀草素-7-葡萄糖苷或异鼠李素3-O-葡萄糖苷[22]。其中m/z 285 为苷元离子峰,比分子离子m/z 477.1030 [M-H]-少192 u,表明丢失1 分子葡萄糖和1 分子甲氧基。化合物C11 保留时间为13.93 min,于m/z 447.2593[M-H]-处存在主离子峰,经计算其分子式为C21H20O11。其二级质谱出现质荷比为285 苷元离子碎片,由m/z 447[M-H-Glu]-失去1 个葡萄糖基得到,鉴定化合物C11 为木犀草苷[23]。
化合物C12,保留时间为14.30 min,在ESI(-)模式下,其MS 图中产生了一个m/z 449.1082[M-H]-的离子碎片,对其二级质谱图下进行分析,得到质荷比为449,287,269,151,135 等碎片。其中,碎片m/z 449 脱去1 分子葡萄糖基得到m/z 287.06 [M-H-Glu]-,再脱去1 分子水得到m/z 269.05 [M-H]-,通过RDA 裂解,得到碎片m/z 151.00[M-H-Glu-H2O-C8H6O]-和碎片m/z 135.04[M-H-Glu-H2O-C8H6O-O]-。通过对比文献[24]和Pubchem 数据库,初步鉴定为黄酮类物质马里苷(marein)。
化合物C13,保留时间为14.99 min,MS 图显示该物质在m/z 509.1660 [M-H]-处产生主离子峰,推测分子式为C24H30O12,存在MS2质谱碎片m/z 463,331,161,121。通过查阅文献[18],推测其为牡丹皮苷D。
化合物C14,保留时间为16.87 min,分子式为C15H12O6,在ESI(-)模式下,在m/z 287.0557 [MH]-产生分子离子片段,MS2 质谱图中存在m/z 287,151,135,107 等离子碎片(见图5a),碎片m/z 287[M-H]-脱去1 分子水,再经RDA 裂解,产生碎片m/z 151 [M-H-H2O-C8H6O]-,m/z 135 由m/z 151 脱去1 分子氧所得。向进乐等[25]研究表明牡丹中存在圣草酚类化合物,因此鉴定化合物C14 为圣草酚。
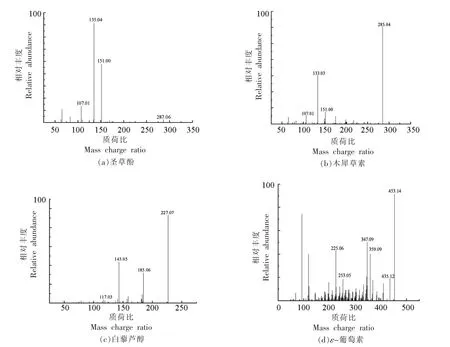
图5 组分F-Ⅱ-1-MR3 部分化合物的二级质谱图Fig.5 MS2 spectra generated from some bitter compounds of F-Ⅱ-1-MR3
化合物C15,保留时间为17.27 min,MS 质谱图显示该物质于m/z 121.0281[M-H]-处存在准分子离子峰,鉴定为苯甲酸。
化合物C16,保留时间为17.46 min,MS 图中于m/z 285.0401 [M-H]-存在分子离子,与分子式C15H10O6匹配,MS2 质谱图存在m/z 285,151,133,107 等离子碎片(见图5b),其中碎片m/z 151 [M-H-C8H6O2]-是黄酮母核在A1,3与B1,3处经RDA 裂解所得,m/z 151 失去1 分子水得到m/z 133 [M-H-H2O]-,与文献所报道一致[24],初步鉴定为木犀草素。
化合物C17,保留时间为17.83 min,MS 图显示该物质存在m/z 227.1281 [M-H]-分子离子峰,与分子式C15H10O6对应,在MS2质谱图中产生m/z 227,185,143,117 等离子碎片(见图5c),其中m/z 143 为苯环裂解重排后的特征离子碎片,初步鉴定为白藜芦醇[26]。
化合物C18,保留时间19.24 min,存在m/z 453.0773 [M-H]-分子离子碎片,推测其分子式为C28H22O6,含有二级质谱碎片m/z 453,435,359,347,253,225 等(见图5d),通过与Pubchem 信息库进行比对,初步鉴定为ε-葡萄素。
化合物C19,保留时间为19.82 min,MS 图显示该物质于m/z 327.2171 [M-H]-存在分子离子峰,MS2 图产生m/z 327,291,229,211,171 等特征离子碎片,与分子式C18H32O5对应。结合参考文献[27]和ChemSpider 数据库对比,初步断定为9,12,13-三羟基-10,15-十八碳二烯酸。化合物C22(保留时间为21.81 min)的分子离子峰和二级质谱碎片均与化合物C19 相同,推测为其同分异构体——(10E,15Z)-9,12,13-三羟基-10,15-十八碳二烯酸。
化合物C20,保留时间为21.23 min,于m/z 329.2328 [M-H]-处存在分子离子峰,基于二级质谱碎片m/z 329,229,211,171,139,推测分子式为C18H34O5。结合参考文献[27]和ChemSpider 数据库对比,初步断定为该化合物为(15Z)-9,12,13-三羟基-15-十八碳烯酸。化合物C21(保留时间为21.48 min)具有相同的准分子离子峰,推测其为(15Z)-9,12,13-三羟基-15-十八碳烯酸同分异构体。
化合物C23,保留时间为26.83 min,MS 图中存在m/z 309.3873 [M-H]-分子离子峰,MS2质谱图含有特征碎片m/z 309,291,221,195,179,与分子式C18H34O4相对应。经Pubchem 和ChemSpider 数据库对比,鉴定为13(S)-HpOTrE。
化合物C24,保留时间为30.01 min,MS 质谱图具有m/z 293.1790 [M-H]-分子离子碎片,MS2质谱图含有特征碎片m/z 293,275,223,195,179,根据元素组成确定分子式为C18H34O3。经Pubchem 和ChemSpider 数据库对比,鉴定为13(S)-HOTrE。
黄酮类物质是植物苦涩味的重要来源,组分F-Ⅱ-1-MR3 含有木犀草素及其糖苷类、圣草酚、根皮素、马里苷等,因此黄酮类物质也是牡丹籽苦味物质成分。此外,组分F-Ⅱ-1-MR3 还含有三羟基脂肪酸类物质,有研究发现9,12,13-三羟基-10,15-十八碳二烯酸是全麦面包屑的苦味成分[28],主要是由亚油酸氧化而来。据报道,由亚油酸与大豆制剂孵育产生的9,10,13-和9,12,13-三羟基十八烯酸的混合物可引出苦味[29]。Hamberg 等[30]认为,三羟基酸异构体味觉阈值可能大不相同,推测啤酒中9,10,13 和9,12,13-三羟基十八烯酸的异构体可能是导致啤酒苦味的原因,特别是9(s),12(s),13(s)-三羟基-10(E)-十八烯酸等主要三羟基酸异构体。赵腾飞等[31]鉴定出化合物9,10,13-三羟基-11(E)-十八烯酸和9,12,13-三羟基-(E)-十八烯酸是白酒中呈苦味特征的化合物。因此推测三羟基脂肪酸也可能是牡丹籽的苦味来源之一。
3 结论
本研究通过有机溶剂萃取结合大孔树脂纯化,分离和制备了牡丹籽苦味组分,感官评价结果表明牡丹籽苦味成分主要富集在30%和50%乙醇洗脱液中,且30%乙醇洗脱组分是牡丹籽苦味主要成分的所在相。经UPLC-HRMS 分析与鉴定,30%乙醇洗脱液中以芍药苷类化合物为主,包括芍药苷、芍药内酯苷、氧化芍药苷、异麦芽芍药苷等组分,芍药苷类化合物是牡丹籽中的主要苦味物质。此外,木犀草素及其糖苷、白藜芦醇、三羟基脂肪酸等也导致了牡丹籽苦味的产生。该研究可为牡丹籽苦味成分解析和脱苦机制研究奠定了物质基础,也可为牡丹籽的进一步开发利用提供技术支持。

