膳食纤维和阿魏酸对面团醒发过程中麦谷蛋白大聚体聚集态的影响及其分子间相互作用
冯钰琳,张慧娟,王 静
(北京工商大学食品与健康学院 中国-加拿大食品营养与健康联合实验室(北京)国家市场监管食品特殊监管技术重点实验室 北京 100048)
近年来,全谷物食品逐渐受到消费者的喜爱。全麦食品是全谷物食品的种类之一,通常由全麦面粉,即白面粉中加入小麦麸皮粉加工制作而成,通常具有较差的口感和风味[1]。
膳食纤维(Dietary fiber,DF)是麦麸中的主要物质[2]。有研究表明,麦麸中的膳食纤维对面团结构产生的不良影响主要是膳食纤维对面筋蛋白的稀释作用与水分竞争效应,并对气泡的扩展产生限制作用,降低面团的持气性[3-5]。另外,在麦麸粉碎的过程中释放出的阿魏酸(Ferulic acid,FA)等酚酸类物质可能会影响面筋网络中巯基/二硫键的交换反应,减少面筋网络中的二硫键含量[6]。
麦谷蛋白大聚体(gluten macropolyer,GMP)是一种不溶于十二烷基硫酸钠(SDS)的谷蛋白聚合体,是构成麦谷蛋白骨架的大分子蛋白质,与小麦面团的流变学特性呈正相关[7-8]。面团的混合搅拌和静置醒发等加工过程会影响麦谷蛋白网络的形成和GMP 的聚合。在制备面团搅拌的过程中,GMP 结构被破坏,发生解聚,使得SDS 提取液中蛋白的浓度增大;而在面团醒发时,这些可提取的聚合物会重新聚合,从而增加GMP 的含量[9]。然而,目前关于全麦体系中膳食纤维与阿魏酸以及两者的共同作用如何影响面团醒发过程GMP 分子聚集的报道甚少,有待研究。
本文通过向高筋面粉中分别添加DF、FA 以及复合添加DF+FA,在面团的不同醒发时间提取其中的GMP,对其粒径与分子质量分布、内源性色氨酸荧光光谱与紫外光谱、游离氨基与水解氨基酸进行测定,从而对DF 与FA 影响GMP 面团醒发过程中分子聚集行为与相互作用机理进行解析,为全谷物食品的生产提供技术参考。
1 材料与方法
1.1 材料与试剂
高筋小麦粉,河北金沙河集团;膳食纤维,Interfiber 公司;阿魏酸、十二烷基硫酸钠、丝氨酸、盐酸,上海麦克林生化科技有限公司;双色预染宽分子量蛋白Mark、4x Laemmli Sample Buffer(含β-巯基乙醇)、氢氧化钠,北京索莱宝科技有限公司;2,4,6-三硝基苯磺酸(TNBS),美国Sigma-Aldrich公司;苯酚、2,4-二硝基氟苯、醋酸铵,福晨(天津)化学试剂有限公司;乙腈,美国MREDA 公司。
1.2 仪器与设备
JA5003 电子天平,上海精密科学仪器有限公司;CR22N 高速离心机,日本日立公司;FW-100高速万能粉碎机,北京中兴伟业仪器有限公司;79600-70 真空冷冻干燥机,美国LABCONCO 公司;Cary 100 紫外分光光度计,安捷伦科技(中国)有限公司;SC-05 荧光分光光度计,英国爱丁堡仪器公司;SALD-2300N 激光粒度分析仪、DGU-20A高效液相色谱仪,日本岛津公司;凝胶成像系统,美国Bio-Red 公司;小型垂直电泳系统,美国Hoefer 公司;多用途恒温超声波提取仪,上海比朗仪器制造有限公司。
1.3 试验方法
1.3.1 DF、FA 及DF+FA 混合粉的配制与面团的制备 将未添加任何物质的纯高筋小麦粉设置为Flour 组。分别在高筋小麦粉中添加质量分数12%的DF[2,10],0.15%的FA[10-11],充分混匀,制备成DF混合粉与FA 混合粉;另外将质量分数12%的DF与0.15%的FA 复配添加到高筋小麦面粉中,制备成DF+FA 混合粉。
分别将高筋小麦粉与上述3 种混合粉各100 g 置于和面机中,水量根据Mixolab 试验测定的吸水率结果添加,在25 ℃环境中混合搅拌5 min 后形成光滑完整的面团,30 ℃条件下分别静置醒发0,30,60,90 min(分别设置为R0 组、R30 组、R60组与R90 组),其余面团于-80 ℃下冷冻12 h 后,冷冻干燥后磨粉,过筛备用。
1.3.2 GMP 的提取 将1.3.1 节制得的面粉用正己烷脱脂后,根据Don 等[12]描述的方法提取面团中的GMP。将1.4 g 冻干面粉样品置于离心管中,加入28 mL 15 g/L 的SDS 溶液混匀,待面粉充分在溶液中分散均匀后离心(25 ℃,15 000 r/min,30 min),沉淀上层的蛋白质凝胶即为GMP。部分新鲜GMP 凝胶用于测定GMP 的粒径分布,其余GMP 于冷冻干燥后磨粉过筛备用。
1.3.3 GMP 粒径分布的测定 根据Yan 等[13]的方法测定GMP 的粒径分布。将约1 g 新鲜制备的GMP 样品置于15 mL 离心管中,加入15 g/L SDS溶液10 mL。低速磁力搅拌2 h 后使GMP 均匀地悬浮在溶液中,GMP 的粒径分布使用激光粒度分析仪测定。
1.3.4 GMP 分子质量分布的测定 SDS-PAGE:依照Wang 等[14]描述的方法,进行轻微调整。采用5%的浓缩胶(pH 6.8)和12%的分离胶(pH 8.8)对GMP 分子质量分布进行分析。使用提取液(0.5 mL 0.01 mol/L Tris-HCl,pH 6.8;含体积分数10% β-巯基乙醇的4x Laemmli Sample Buffer)对GMP 蛋白粉末进行提取后,取10 μL 上清液上样进行电泳试验。用凝胶成像系统对染色、脱色后的凝胶进行观察拍照。
SEC-HPLC:参照Morel 等[15]与Larroque 等[16]的方法稍作修改。准确称取10 mg 冷冻干燥的GMP,加入提取液(0.05 mol/L PBS,pH 6.9,含2 mol/L 尿素,15 g/L SDS),漩涡振荡混匀后使用超声波提取仪进行GMP 提取(功率30%,3 min)。之后20 ℃,17 000×g 离心15 min。使用0.22 μm 滤膜过滤上清液,取50 μL 提取液进样至高效液相色谱仪。选用Shodex Protein KW-804 色谱柱,色谱条件为:流动相为乙腈与水1∶1(含0.05% 三氟乙酸),流动相流速1 mL/min,柱温30 ℃,检测波长214 nm。
1.3.5 HMW/LMW 比值的测定 根据Wieser 等[17]的方法,采用反相高效液相色谱法(RP-HPLC)测定GMP 的HMW/LMW 比值。使用C8 键合相色谱柱,通过高效液相色谱仪测定。冷冻干燥的GMP粉末(100 mg)加入1 mL 提取液[体积分数50%异丙醇,2 mol/L 尿素,10 g/L 二硫苏糖醇,0.05 mol/L的Tis-HCl(pH 7.5)],在氮气环境下60 ℃振荡加热20 min 进行提取。离心后(6 000×g,4 ℃,20 min)重复提取3 次,合并上清液。流动相A 为含体积分数0.1%三氟乙酸的超纯水,流动相B 为含有体积分数0.1%三氟乙酸的乙腈(色谱级)。取100 μL 提取液进样,柱温50 ℃。洗脱流速为1 mL/min,B 相从28%到56%进行梯度洗脱。
1.3.6 GMP 内源性色氨酸荧光光谱的测定 参照Han 等[18]的方法,将GMP 蛋白粉末500 mg 于烧杯中,加入20 mL 磷酸缓冲溶液(0.01 mol/L,pH 7.0 制得蛋白质溶液。取3 mL 置于四面透光的荧光石英比色皿内,荧光分光光度计设置参数:激发波长290 nm,波长扫描范围300~400 nm,狭缝宽度5 min,扫描GMP 的内源性色氨酸荧光光谱图。
1.3.7 GMP 紫外光谱分析 参照岳鑫等[19]的方法,取1.3.6 节中的蛋白溶液3 mL 于石英比色皿中,使用紫外分光光度计在250~350 nm 范围内测定GMP 蛋白的紫外光谱。
1.3.8 GMP 游离氨基的测定 参照Swieca 等[20]的方法测定GMP 中的游离氨基。将1.3.6 节中制得的蛋白质的溶液取1 mL 加入100 μL 1 g/L 的TNBS 水溶液,50 ℃条件下避光反应60 min 后,加入1 mL 标准酸(0.1 mol/L),室温避光孵育30 min后测定420 nm 处的吸光度。使用不同浓度的丝氨酸进行上述操作步骤,以丝氨酸浓度-吸光度为标准曲线,对GMP 中的游离氨基进行定量计算。
2 结果与分析
2.1 DF 与FA 对面团醒发过程GMP 粒径分布的影响
按照不同的粒径范围,将GMP 的粒径分布分为小粒径<11 μm、中粒径11~50 μm 和大粒径>50 μm 3 个范围,各粒径范围GMP 的体积分数如表1 所示。由表可知,在0~60 min 醒发时间的范围内,各组别小粒径GMP 的体积分数随醒发时间的延长而降低,而大粒径GMP 的体积分数随醒发时间的延长而增加,如醒发60 min 时Flour 组大粒径(粒径>50 μm)GMP 体积分数比醒发0 min 时增加了6.1%。Don 等[21]认为,在面团醒发过程中,部分面团中由于前期搅拌过程中机械力而发生解聚的GMP 会由小粒径重新聚合逐渐变为大粒径,与本部分的试验结果相似。在Han 等[18]的研究中,发现添加DF 会使面筋蛋白的粒径分布发生明显的变化,面筋聚集也会由于DF 的添加发生改变。而FA 与蛋白之间存在的疏水作用力与氢键[22]可能会导致添加FA 后GMP 的粒径分布发生变化。这可能是本试验中FA 组小粒径GMP 所占的比例相比于Flour 组显著增加,大粒径GMP 的体积分数显著降低的原因。当同时添加DF 与FA 时,GMP 粒径的变化介于单独添加DF 与FA 之间,大粒径GMP 含量降低程度小于单独添加FA 的组别,这说明添加DF+FA 会降低单独添加DF 或FA对GMP 粒径分布的影响。
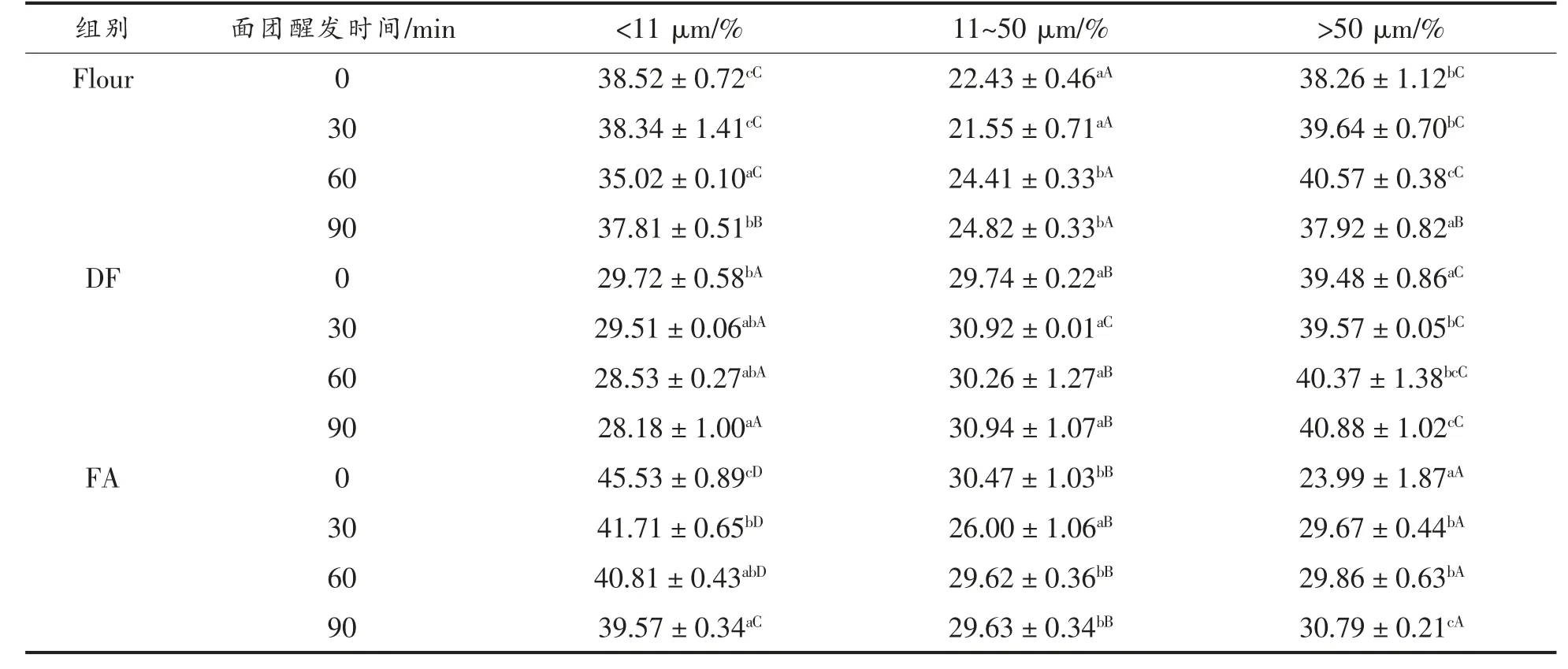
表1 添加DF、FA 及DF+FA 对面团醒发过程中GMP 粒径分布的影响Table 1 Effects of DF,FA and FA+DF on the particle size distribution of GMP during resting process
当面团醒发时间达到90 min 时,Flour 组小粒径GMP 的体积分数有所升高,大粒径GMP 的体积分数发生下降,但是添加了DF 与FA 的组别的小粒径GMP 依然呈现下降的趋势,大粒径GMP的体积分数呈现上升的趋势,说明添加DF 与FA同样会影响醒发过程中GMP 粒径分布的动态变化趋势。
2.2 DF 与FA 对面团醒发过程GMP 分子质量分布的影响
图1 为GMP 的凝胶电泳成像图。由图可知,GMP 的分子质量较大,主要分布在35~135 ku 的范围内。DF 组与Flour 组相比分子质量条带分布没有明显的变化,表明添加DF 不会对GMP 的分子质量分布造成较大的影响。FA 组与DF+FA 组在75~100 ku 的范围内条带由原来的2 个条带变为3 个条带,说明FA 的加入会对较高分子质量的蛋白亚基产生影响。结合110 ku 处条带强度变小且向低分子质量处方向偏移,推测出现的新条带可能是由该条带解聚产生的。说明FA 的加入会导致GMP 蛋白的高分子质量亚基发生解聚。添加DF+FA 的组别同样也在该区域出现了新条带,但110 ku 处与泳道整体的蛋白强度与FA 组相比有所增强,说明DF 能够平衡FA 对GMP 蛋白分子质量分布的影响。在Wang 等[14]的研究中发现蛋白质的解聚与亚基的变化可能与GMP 粒径变化有关。在2.1 节中我们发现添加FA 会使大粒径GMP 体积分数减小,DF+FA 会降低单独添加DF或FA 对GMP 粒径分布影响,与电泳试验的结果相似,印证了Wang 等[14]的观点。
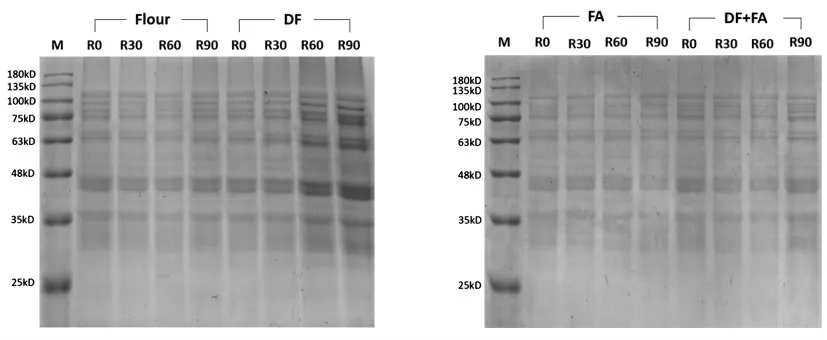
图1 GMP 的SDS-PAGE 图Fig.1 The SDS-PAGE analysis of GMP
各组GMP 的SEC-HPLC 图如图2 所示。各组样品的色谱图按照分子质量的大小主要可以分为3 个峰区,分别为谷蛋白聚合体(F1,Mw≈91 000~688 000 ku)、单体谷蛋白(F2,Mw≈16 000~91 000 ku)与清蛋白、球蛋白、肽链及氨基酸(F3,Mw<10 000 ku)[23]。由于GMP 是麦谷蛋白中的高分子聚合体,因此其主要的峰响应集中在F1 区。而F2区及F3 区主要是一些与聚合体结合较紧密而未被分离的单体蛋白与氨基酸等。由图可知,DF 组的色谱图与Flour 组相比没有明显的区别,说明添加DF 不会对GMP 的分子质量分布产生显著影响。FA 组在保留时间为8.744 min 峰响应有所降低,且在该峰的右侧,即保留时间为11~14 min 的范围内出现了响应,说明FA 的加入会使部分高分子质量亚基解聚,导致分子质量分布向低分子质量的方向偏移,这与SDS-PAGE 中FA 导致GMP高分子质量亚基发生解聚的结果是一致的。当同时添加DF 与FA 时,随着醒发时间的延长,F1 区的峰值逐渐升高伴随着其右侧的响应值逐渐降低,直至醒发90 min 时,GMP 的谱图与Flour 组相比已无明显差异,说明在醒发的过程中,DF 与FA的共同作用可以逐渐平衡单独添加FA 对GMP的解聚作用,减轻对GMP 分子质量分布的影响,这与SDS-PAGE 的结果也是一致的。
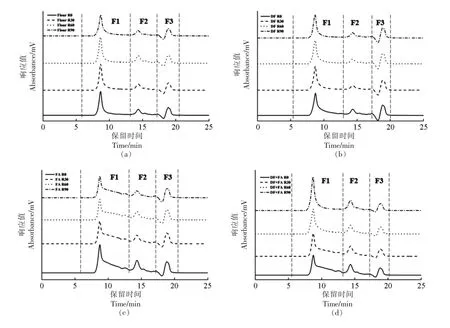
图2 GMP 的SEC-HPLC 图Fig.2 The SEC-HPLC analysis of GMP
2.3 DF 与FA 对面团醒发过程GMP 亚基比值的影响
各组别GMP 亚基比值如图3 所示。由图可知,Flour 组与FA 组在面团醒发过程中亚基比值没有发生显著的变化。在Aussena 等[24]探究面团加工过程GMP 亚基比值变化的试验中,也发现醒发过程GMP 亚基比值略有上升但总体变化不大,与本试验的结果相似。但DF、DF+FA 的组别随醒发时间的延长亚基比值发生了显著的增加(P<0.05),这可能是由于DF 的加入影响了醒发过程中面粉中蛋白的可萃取率,随着醒发时间的延长,不可萃取的麦谷蛋白大聚体中的HMW-GS 含量增加,导致亚基比值的升高[25]。另外在相同醒发时间下,添加DF、FA 均会使GMP 的亚基比值下降,与醒发90min 的Flour 组亚基比值相比,DF 组下降了7.4%,FA 组下降了18.5%,DF+FA 组下降了7.5%,DF与FA 的相互作用可以保持GMP 中HMW 与LMW 的相对含量。前人的研究中提出谷蛋白聚合物具有层次结构,在面团加工的过程中麦谷蛋白亚基是以非随机顺序释放的[3]。因此推断DF 与FA 的加入会与GMP 分子中的不同亚基间产生相互作用,导致HMW-GS 释放,由聚合体蛋白转化为单体蛋白,更容易在提取面团中的GMP 过程中被SDS 提取溶液萃取,从GMP 中脱离出来,导致HMW/LMW-GS 发生降低的现象。同时推测,由于这两种物质与GMP 的作用方式不同,所释放的HMW-GS 的种类和数量之间的差异引起了添加DF 与FA 亚基比值降低程度的不同。
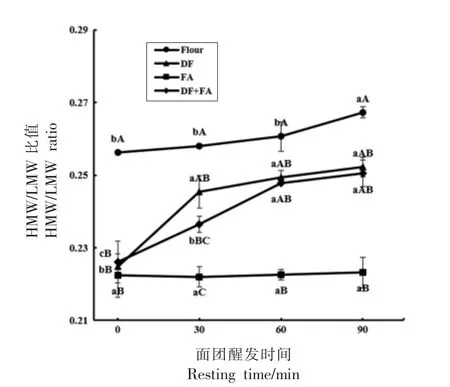
图3 添加DF、FA 及DF+FA 对面团醒发过程中GMP 亚基比值的影响Fig.3 Effects of DF,FA and DF+FA on the HMW/LMW ratio of GMP during resting process
2.4 DF 与FA 对面团醒发过程GMP 内源性色氨酸荧光光谱的影响
各组GMP 的内源性色氨酸荧光扫描光谱图如图4 所示。由图可知,对于添加同种物质的组别,各组在醒发过程中出峰位置与峰高都较为集中,没有表现出明显的差异,这说明在醒发过程中色氨酸暴露的数量与程度、色氨酸周围极性微环境没有出现明显的变化。
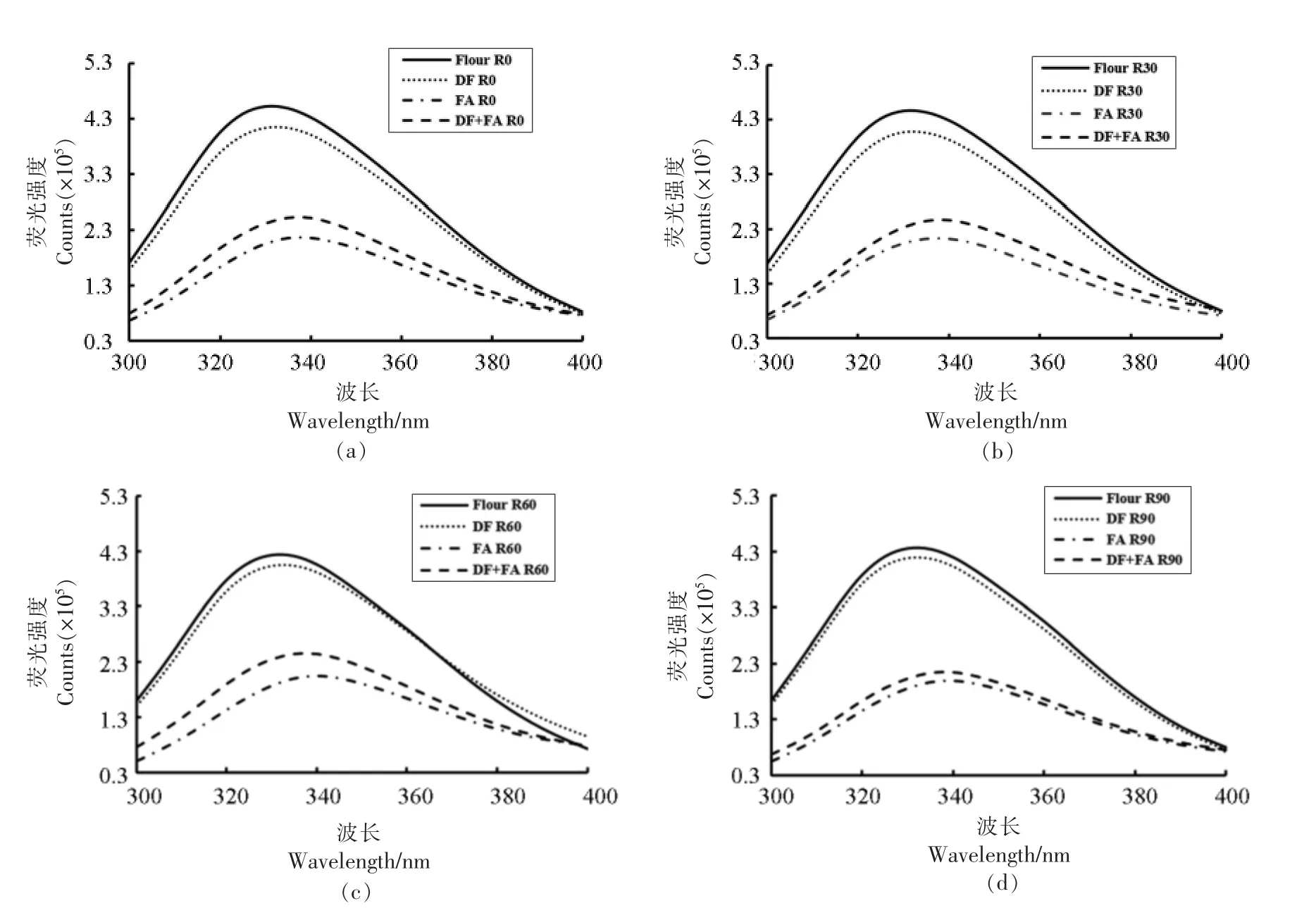
图4 添加DF、FA 及DF+FA 对面团醒发过程中GMP 色氨酸荧光光谱的影响Fig.4 Effects of DF,FA and DF+FA on the fluorescence characteristic of GMP during resting process
与Flour 组相比,添加了DF 或FA 后的色氨酸荧光谱带强度都有所降低,但色氨酸荧光强度DF 组大于FA 组,这说明DF 组蛋白中色氨酸残基的暴露程度要高于FA 组。这可能是由于色氨酸也是疏水性氨基酸之一,会与酚酸中的疏水性基团产生疏水相互作用,使得蛋白分子含有色氨酸残基部分的结构发生变化,使色氨酸残基的暴露程度降低,导致蛋白质发生荧光淬灭,荧光带强度降低;另外FA 等酚酸具有酚羟基等结构会与蛋白含有色氨酸残基的结构发生共价结合,使色氨酸的数目减少,使得色氨酸的荧光强度降低[26-28]。也有研究报道了植物酚酸的添加所产生的酚酸-蛋白质共价交联作用会导致蛋白质三级结构的改变[29]。而同时添加DF 与FA的组别的色氨酸荧光强度介于单独添加DF 与FA之间,这说明当DF 与FA 共同作用时,它们对含有色氨酸残基的蛋白结构产生了中和的效果,使这部分蛋白构象的变化程度降低。
从图中还可以看出,含有FA 组别的最高峰位置向长波方向移动,即发生了红移现象。这说明在添加了FA 后色氨酸周围的极性微环境发生了变化。相比于其它组别,色氨酸暴露在了极性更强的微环境中。
2.5 DF 与FA 对面团醒发过程GMP 紫外吸收光谱的影响
图5 为各组GMP 蛋白质的紫外吸收光谱。由图可知,添加同种物质组别的出峰位置与峰高都较为集中,没有表现出明显的差异,这说明在醒发的过程中色氨酸与酪氨酸的暴露程度与数量、周围极性微环境没有出现明显的变化。
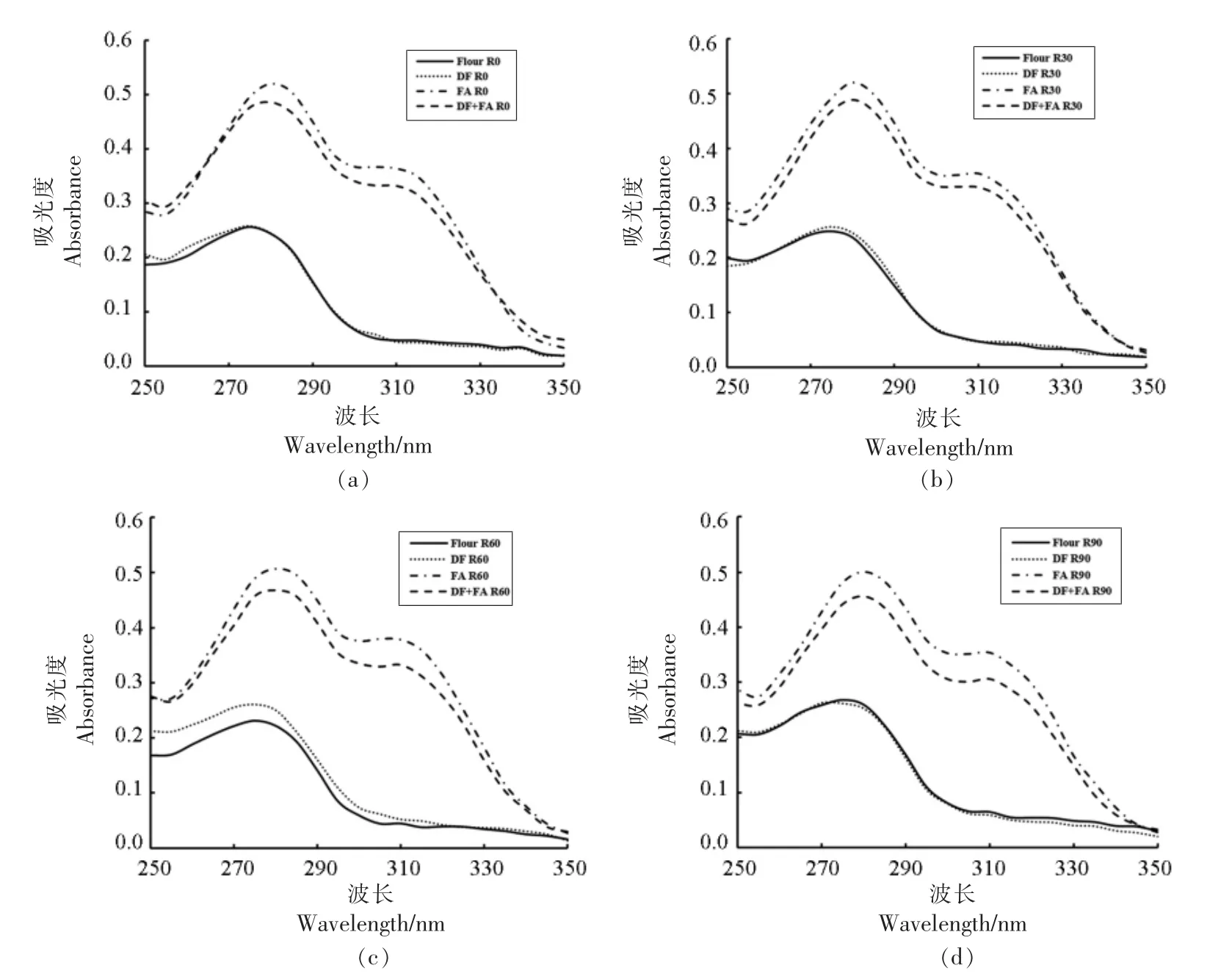
图5 添加DF、FA 及DF+FA 对面团醒发过程中GMP 紫外吸收光谱的影响Fig.5 Effects of DF,FA and DF+FA on the ultraviolet absorption spectrum of GMP during resting process
DF 组与Flour 组相比紫外吸收峰强度与峰位置没有明显的区别,说明DF 的加入没有导致含有酪氨酸残基的结构发生显著的变化。添加FA对GMP 紫外吸收光谱的强度的影响较大,说明FA 作为配体分子与蛋白质相关氨基酸残基之间的相互作用更为强烈,它可能与蛋白质分子之间通过共价作用形成了蛋白质-酚酸复合物,对GMP 的蛋白结构产生了影响,肽链的骨架结构发生改变,使得蛋白质分子中含有酪氨酸残基结构的暴露程度增加。而这种构象的变化有利于蛋白质分子中色氨酸残基和酪氨酸残基中芳香环的π-π*跃迁,表现为紫外光谱的吸光度增强[30]。DF+FA 组的紫外吸收强度相比于单独添加FA 的组别有所降低,这说明当DF 与FA 共同作用时,它们对含有色氨酸、酪氨酸残基的蛋白结构产生了中和的效果,使蛋白构象的变化程度降低。
从图中还可以看出,含有FA 的组别在310 nm 附近出现了新的吸收峰,这是由于阿魏酸其自身酚酸的结构引起的。同时发现,含有FA 组别的最高峰位置向长波方向移动,即发生了红移现象。这说明FA 作为配体分子与蛋白质结合后使色氨酸与酪氨酸周围的极性微环境发生了变化。相比于其它组别,色氨酸与酪氨酸暴露在了极性更强的水相环境中,引起两种方式电子轨道跃迁能量减小,表现为吸收峰的红移。
2.6 DF 与FA 对面团醒发过程GMP 游离氨基的影响
图6 为各组GMP 中游离氨基含量变化。由图可知,添加DF、FA 均会使GMP 中的游离氨基含量下降。面团醒发90 min 时,DF 与FA 使GMP 蛋白质分子中游离氨基含量分别显著下降(P<0.05)22.48%与17.38%。FA 作为一种具有酚羟基结构的物质,其所含有的酚羟基具有较高的交联活性,易与肽链上具有游离氨基侧链的氨基酸残基发生相互交联,导致GMP 中的游离氨基含量下降。Zhang 等[31]的研究发现单宁酸的酚羟基与面筋蛋白中的游离氨基之间可能形成了非二硫键的其它化学键,单宁酸作用于蛋白质时所发生的相互作用引起了面筋蛋白中游离氨基含量的降低。DF 由于含有半缩醛羟基,也会与GMP 分子中的游离氨基发生相互作用,导致了游离氨基含量的下降。同时,可以发现Flour 组在醒发的过程中游离氨基含量没有显著性差异(P>0.05),但添加了DF、FA 后各组游离氨基的含量均随着醒发时间的延长呈现下降的趋势,这说明在醒发的过程中,DF、FA 与GMP 蛋白质分子的游离氨基之间的交联作用逐渐增强,更多的游离氨基与FA、DF 结合,导致了游离氨基含量的显著下降(P<0.05)。另外,蛋白中游离氨基含量的降低也说明膳食纤维与阿魏酸会和GMP 蛋白分子中的游离氨基之间产生共价键[31],而这也可能是导致蛋白质结构发生变化的原因之一[32]。
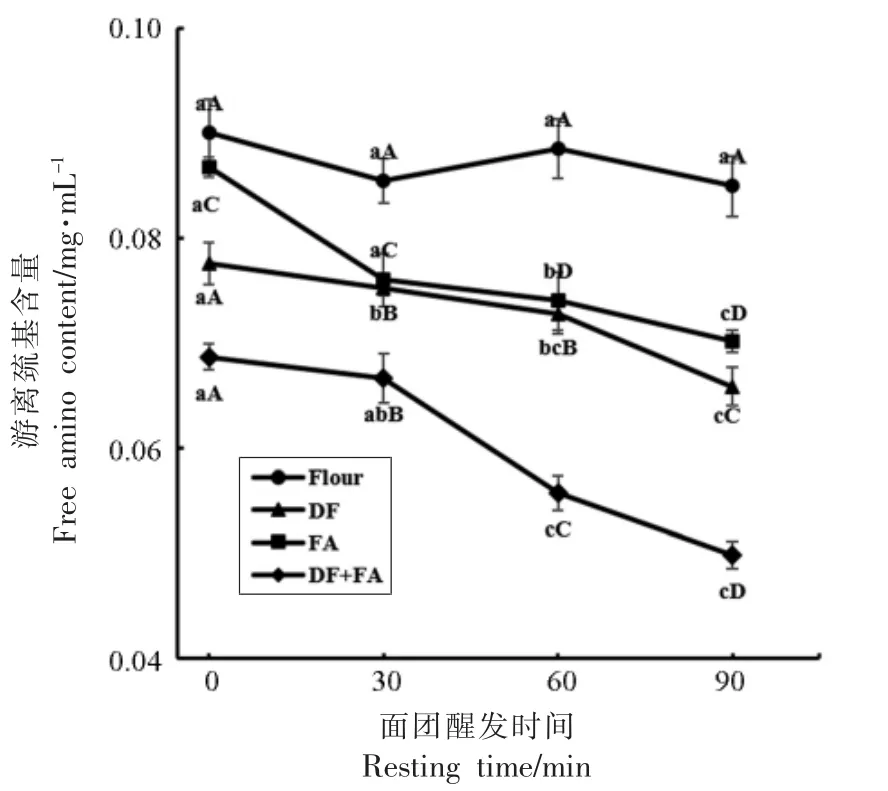
图6 添加DF、FA 及DF+FA 对面团醒发过程中GMP 游离氨基含量的影响Fig.6 Effects of DF,FA and DF+FA on the free amino groups of GMP during resting process
3 结论
DF 与FA 的添加会对GMP 蛋白质的分子聚集产生影响,并且会与GMP 蛋白质之间产生分子间相互作用,使GMP 的结构产生变化。在0~60 min 醒发的时间范围内,DF 使大粒径GMP 的体积分数增加,FA 则增加了小粒径GMP 的体积分数。FA 会导致较高分子质量范围的GMP 发生解聚,DF+FA 能够平衡FA 对GMP 蛋白分子质量分布以及亚基比值的影响,也会降低单独添加DF或FA 对GMP 粒径分布的影响。添加DF、FA 均会使GMP 高分子谷蛋白亚基与低分子谷蛋白亚基的比值下降。DF 与FA 使GMP 分子中含有色氨酸、酪氨酸等蛋白结构的空间结构发生改变,FA使GMP 的色氨酸荧光色谱与紫外吸收光谱发生红移,使色氨酸、酪氨酸残基的极性微环境发生变化。DF、FA 由于与GMP 分子发生共价交联的相互作用,使GMP 中的游离氨基含量发生显著下降。

