CH3COONa-NH4OH-H2O体系下磷石膏矿化CO2-联产高纯CaCO3
丁文金,刘卓齐,卢海臣,孙红娟,彭同江
(1 西南科技大学固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;2 西南科技大学矿物材料及应用研究所,四川 绵阳 621010)
近年来由温室效应所引起的环境气候变化越来越受到大家的广泛关注。而控制大气中CO2的浓度被认为是减缓温室效应的关键措施之一[1]。目前用于CO2大规模储存与固定的技术主要包括地质封存[2]、海洋封存[3]、生态系统封存[4]以及矿物碳酸化固定[5]。矿物碳酸化固定是模仿自然界中CO2的矿物吸收过程,将CO2与含有碱性或碱土金属氧化物的矿石进行反应,生成长久的、更为稳定的碳酸盐的过程[6]。矿物碳酸化固定以其原料丰富易得、可大规模封存以及碳酸化产物可作进一步应用等优势而受到国内外学者的普遍关注。
磷石膏是湿法生产磷酸过程中所产生的一种以CaSO4·2H2O 为主要成分的固体废弃物。每生产1t磷酸会产生4.5~5t 的磷石膏。随着磷化工业的不断发展,目前全世界磷石膏的年排放量约为2.8 亿吨,我国磷石膏的年排放量约为7000万吨[7]。磷石膏除主要成分为CaSO4·2H2O 外,还含有一定量的P、F 和有机物等有害杂质,部分产地的磷石膏还含有放射性元素。这些都严重制约了磷石膏的大规模利用。目前我国磷石膏的资源化利用率约40%,大量的磷石膏露天堆放,不仅会占用大量土地,而且磷石膏中大量有害元素也会污染土壤和地下水,对当地的生态环境带来不利影响[8]。
磷石膏中钙离子的含量较高,以其为原料碳酸化固定CO2既可以降低CO2的排放量,又可以实现磷石膏的资源化利用。目前国内外学者对磷石膏碳酸化固定CO2进行了一些研究[9-14],但仍未能实现大规模工业化应用。主要存在如下问题:所得碳酸化产物的品质不高;碳酸化工艺条件较为苛刻,整个碳酸化过程需消耗大量的化学助剂,经济与环境成本较高。
本文在前期试验研究基础之上,针对磷石膏富含钙离子的成分特点,以盐效应与难溶电解质溶解平衡理论为基础,采用“反向提纯”的学术思想,在磷石膏矿化CO2过程中首先以强电解质醋酸钠为助剂提取出原料中的Ca2+,再以富含Ca2+的浸出液为原料进行CO2的矿化,并联产高纯CaCO3。提取过程中可实现原料中Ca2+与石英等不溶杂质组分的有效分离,且醋酸钠不直接参与矿化反应,一直以离子的形式存在于溶液中,可循环用于原料中Ca2+的提取,既为高白度、高纯度CaCO3的制备奠定了基础,又富集了原料中的杂质组分,为磷石膏的全组分资源化利用奠定基础。实验过程中系统讨论了不同工艺条件对磷石膏中Ca2+浸出率及氨水强化Ca2+提取液矿化CO2过程中钙离子转化率的影响机制;初步掌握了矿化过程中调控产物晶粒尺寸、结构与形貌的关键因素与反应机制;同时探索了矿化过程中醋酸钠的循环利用与回收工艺。本文的研究以期为磷石膏的高值化利用与CaCO3的可控制备提供了一种新的思路与方案。
1 材料和方法
1.1 材料
本文实验用磷石膏样品采自四川绵阳某磷化工厂,样品经40℃烘干后,球磨至粒径150mm,备用。磷石膏样品中主要的物相为板状的石膏[图1(a)、(b)],另含有少量颗粒状的石英。原料的化学成分为:CaO 29.6%, SO339.36%, SiO25.03%, P2O51.6%, Al2O31.85%, H2O 20.74%,其他组分1.82%,均为质量分数。实验所用试剂醋酸钠和氨水为分析纯,CO2为工业级纯度。

图1 磷石膏、浸出产物、碳酸化产物及碳酸化副产物的XRD图谱[(a)];磷石膏、浸出产物和碳酸化产物的SEM图[(b)~(d)]
1.2 磷石膏浸出与浸出液矿化实验
取20g 的磷石膏样品置于250mL 的锥形瓶中,向锥形瓶中加入一定量设定浓度的醋酸钠溶液,将锥形瓶置于摇床中,搅拌速度240r/min,在一定温度下反应一段时间后抽滤,滤液用于后期CO2的矿化实验,滤饼洗净后在40℃烘干。实验过程中采用单因素实验确定优化的工艺条件。具体反应过程为
取400mL 钙离子浸出液倒入500mL 的烧杯中,向烧杯中加入一定量的浓氨水,将烧杯置于带搅拌的水浴锅中,按一定速率向溶液中通入CO2气体,在一定温度下搅拌反应一段时间后抽滤,滤饼洗净后在105℃下烘干备用;实验过程中采用单因素实验确定优化的工艺条件。具体反应过程为+H2O。滤液循环用于磷石膏原料的浸出,待滤液循环使用次满后采用蒸发结晶回收醋酸钠。
1.3 分析测试仪器
通过X 射线衍射仪(荷兰帕纳科公司X’pert pro型X射线衍射分析仪。测试条件为:以Cu为阳极,步长为0.02°,测试范围为3°~80°,采样时间为0.5s,管电压40kV,管电流40mA)对所得产物的物相与晶粒尺寸进行表征;通过扫描电子显微镜(德国蔡司产Ultra 55型场扫描电子显微镜,工作电压为15kV)对所得样品的显微形貌进行表征;通过傅里叶变换红外光谱仪(美国PE 仪器公司,Spectrum one型,测试范围400~4000cm-1)对产物的结构进行表征;通过HY-BDY 型白度仪对碳酸化产物的白度进行表征;通过化学滴定法对原料、浸出液和碳酸化产物中Ca2+含量进行表征;钙离子碳酸化转化率以及碳酸化滤液循环利用反应效能的计算方法参考文献[10]。
2 结果与讨论
2.1 磷石膏中钙离子的提取
为了实现磷石膏中二水硫酸钙与SiO2、Al2O3等属性各异的杂质组分有效分离,基于盐效应与难溶电解质溶解平衡理论,选择以强电解质醋酸钠为助剂提取磷石膏中的钙离子。为了获得醋酸钠浸出磷石膏优化的工艺条件,实验过程中通过单因素实验系统讨论了醋酸钠浓度、液固比、反应温度和反应时间对原料中钙离子浸出效果的影响,结果如图2所示。
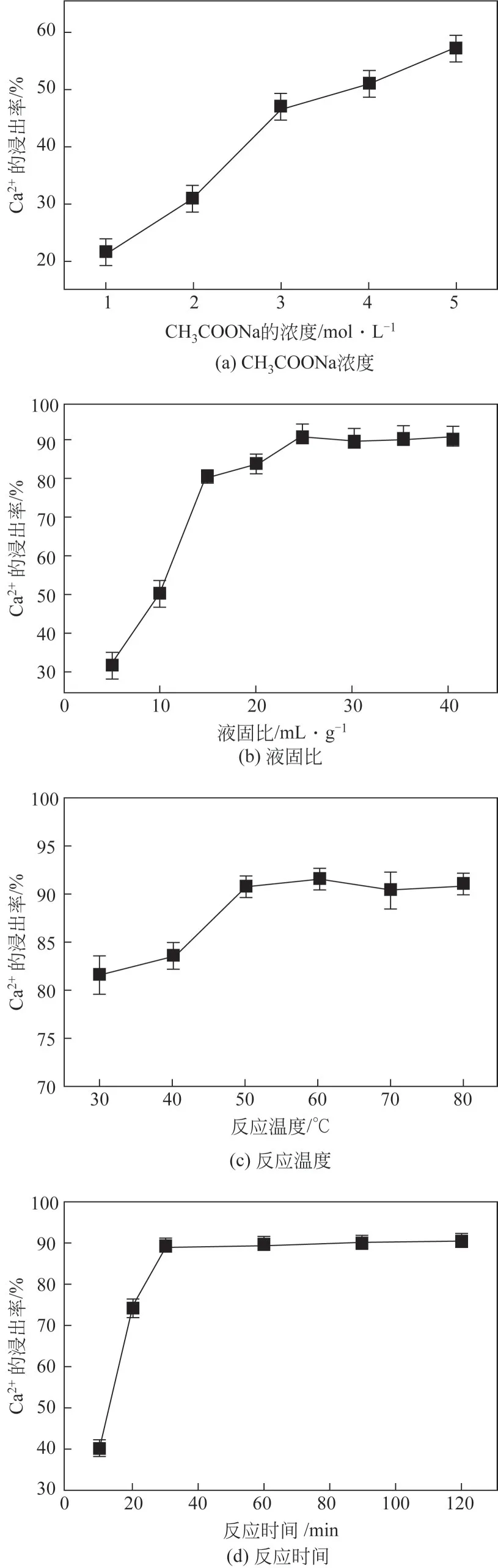
图2 不同工艺条件对Ca2+浸出率的影响
不同工艺条件对磷石膏中钙离子浸出率的影响均呈现先增大后逐渐趋于平稳的趋势。由图2(a)可知,当醋酸钠浓度为1mol/L 时,钙离子的浸出率为21.26%,随着醋酸钠浓度的升高,钙离子的溶解量逐渐增大;当醋酸钠浓度为4mol/L 时,钙离子的浸出率为50.66%;继续增大醋酸钠浓度到5mol/L,原料中钙离子的浸出率继续增大,但此时的溶液已接近过饱和,溶液的配置较为困难。因此,确定4mol/L 为优化的醋酸钠浓度。当醋酸钠溶液与原料的液固比为5mL/g时,原料中钙离子的浸出率为31.37%,随着液固比的增大,钙离子的溶解量逐渐增加;当液固比为25mL/g 时,钙离子的浸出率为91.17%,继续增大液固比,钙离子的溶解量基本不变[图2(b)]。从图2(c)、(d)可知,反应温度和反应时间对钙离子浸出效果的影响基本与液固比相同。通过实验获得醋酸钠溶液浸出磷石膏中二水硫酸钙优化的工艺条件为磷石膏20g、醋酸钠浓度4mol/L、液固比25mL/g、反应温度50℃、反应时间30min,优化条件下所得钙离子的浸出率为91.1%。由图1(a)可知,优化条件下磷石膏浸出渣中主要的物相为石膏和石英,浸出渣经过二次浸出后石膏的衍射峰消失,颗粒状石英的衍射峰增强[图2(c)],产物中还出现黄铁矿和磷铝铈石的衍射峰;二次浸出渣的化学成分为CaO 14.96%、SO32.99%、SiO233.82%、P2O514.01%、Al2O310.28%、Fe2O34.84%、SrO 2.13%,烧失量13.2%,其他组分3.77%,均为质量分数。浸出渣的物相与成分分析为后续系统开展浸出渣资源化利用研究奠定了基础。
弱电解质或难溶电解质的水溶液中,加入与其不含相同离子的其他强电解质,溶液中离子的总浓度增大,根据离子强度的定义,该溶液的离子强度增大,则活度系数减小,使离子的活度不能维持平衡,平衡只能右移,增大离子的活度,以达到新的平衡,从而导致弱电解质或难溶电解质的解离度增大[15]。醋酸钠溶液促进磷石膏中二水硫酸钙溶解的主要原因为醋酸钠的醋酸根离子在溶液中水解,促使溶液中离子运动加剧,从而使得二水硫酸钙溶解度增大较为明显[16]。
2.2 钙离子浸出液的矿化
通过上述研究获得了以Ca2+、SO2-4、CH3COO-、Na+为主要成分的浸出液,以此浸出液为原料进行碳酸钙的制备研究。实验过程中为进一步加速碳酸钙的生成过程,选择以氨水为强化反应的助剂。为获得磷石膏浸出液矿化CO2优化的工艺条件,实验过程中系统讨论了氨水的添加量、CO2流速、反应温度和反应时间对浸出液中钙离子碳酸化转化率的影响,结果图3所示。
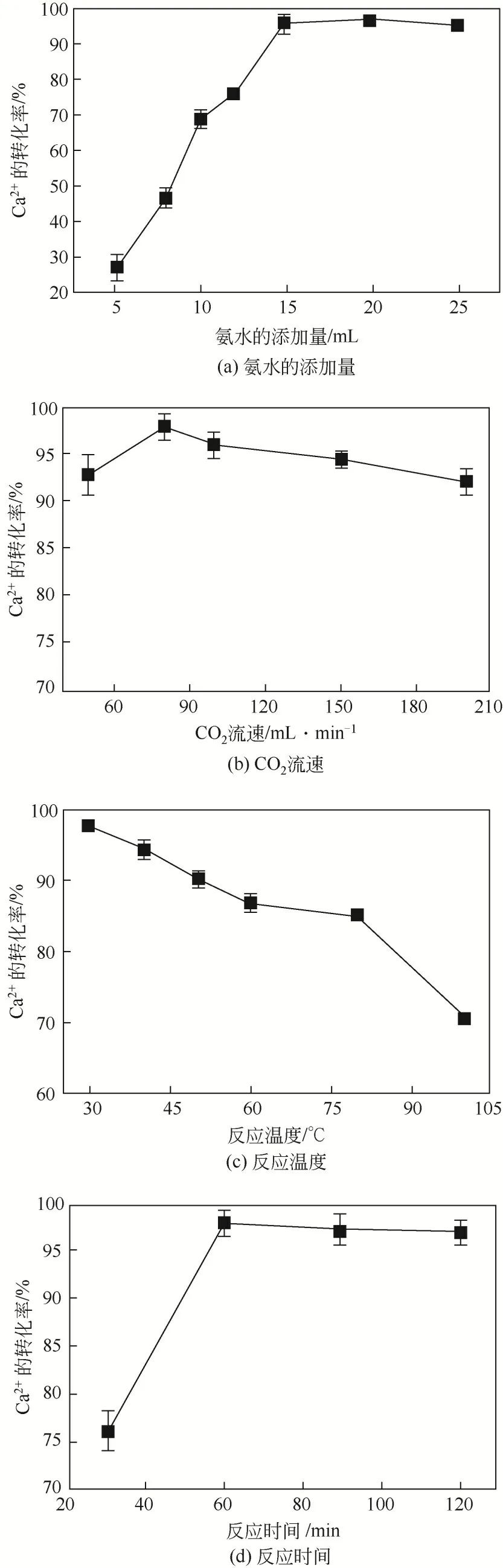
图3 不同工艺条件对Ca2+碳酸化转化率的影响
由图3(a)可知,当氨水的添加量为5mL时,钙离子的碳酸化转化率为27.36%,随着氨水添加量的增加,钙离子碳酸化转化率逐渐增大;当氨水的添加量为15mL 时,钙离子的碳酸化转化率为95.98%,继续增大氨水的量,碳酸钙的量基本不变。这主要是因为当氨水的量小于15mL 时,碳酸化反应不充分,溶液中仍存在一部分钙离子没有转化为碳酸钙;当溶液中的钙离子基本都转化为碳酸钙时,继续添加氨水对增大碳酸钙的量基本没有影响。二氧化碳流速和反应时间对溶液中钙离子转化为碳酸钙的影响基本与氨水的量相同[图3(b)、(d)]。反应温度对钙离子碳酸化转化率的影响具有与氨水的添加量相反的变化趋势[图3(c)]。当反应温度为30℃时,钙离子的碳酸化转化为97.95%,随着反应温度的升高,碳酸钙的生成量逐渐降低;当反应温度为100℃时,钙离子的碳酸化转化为70.48%。这主要是因为随着反应温度的升高,溶液中二氧化碳的溶解量逐渐降低,参与碳酸化反应的碳酸根量减少。
磷石膏浸出过程中所用助剂醋酸钠并未直接参与碳酸化反应,一直以离子的形式存在于溶液中。碳酸钙制备完成后,经固液分离获得含有CH3COO-和Na+的滤液,可循环用于磷石膏或浸出渣中二水硫酸钙的提取。为了验证碳酸化反应滤液循环用于浸出钙离子并制备碳酸钙的可行性,系统考察了滤液循环使用次数对钙离子碳酸化反应效能及产物结构与形貌的影响,结果如图4所示。随着滤液循环使用次数的增加,钙离子碳酸化的反应效能不断降低。当循环使用1次时,钙离子的碳酸化反应效能为89.06%,所得产物为球形球霰石;随着循环次数的增加,产物中出现方解石C—O 的v3红外振动吸收峰[图4(c)],但由于生成的方解石量较少,样品中并未出现方解石的衍射峰[图4(b)];当循环使用6次时,体系的反应效能为21.76%,所得产物为球形球霰石和颗粒状方解石[图4(g)~(k)];产物中方解石的衍射峰随着循环次数的增加逐渐增强,方解石的量逐渐增多;当循环使用8次时,反应效能为5.83%,产物中方解石和球霰石的量分别为21.06%和78.94%。这主要是因为随着滤液循环利用次数的增加,碳酸化滤液中离子浓度增大,同离子效应增强,原料中钙离子的浸出率逐渐降低,溶液中钙离子的量和氨水的量不断减少,碳酸化反应时溶液中Ca2+浓度变低,所得碳酸钙的量变少,因而整个反应的效能变低;参与碳酸化反应的钙离子浓度的降低导致体系的过饱和度降低,球霰石的成核驱动力不断减少,促进了方解石晶型的不断形成。碳酸化滤液经两次循环后,此时的反应效能为58.38%>50%,经蒸发结晶回收溶液中的醋酸钠,所得产物的物相如图1(a)所示。从图中可知,所得产物中主要成分为醋酸钠,未检测出其他物相的衍射峰,且醋酸钠的衍射峰尖锐、强度高,表明醋酸钠晶体的结晶性较好。

图4 碳酸化滤液循环次数与反应效能的关系(a)以及不同碳酸化滤液循环次数下所得产物的 XRD图谱(b)、FTIR图谱(c)、SEM图[(d)~(k),循环次数分别为1次、2次、3次、4次、5次、6次、7次、8次]
通过上述实验获得氨水强化磷石膏浸出液矿化CO2的优化工艺条件为浸出液400mL、氨水的添加量15mL、CO2流速80mL/min、反应温度30℃、反应时间60min,优化条件下所得钙离子的碳酸化转化率为97.95%。即1t 磷石膏理论上可以生产472kg CaCO3,吸收208kg 的CO2。优化条件下所得产物的物相为球形球霰石[图1(a)、(d)],CaCO3的含量为99.63%,样品的白度为99.4%,样品的基本性能优于标准HG/T 2226—2010中的指标要求。助剂醋酸钠可循环利用且可从碳酸化滤液中回收,从而可降低整个碳酸化工艺的助剂使用成本。这一研究成果优于现有文献报道中有关工业副产石膏碳酸化固定CO2的结果,见表1。

表1 工业副产石膏制备CaCO3工艺的对比
2.3 矿化产物的可控制备
材料的结构决定其性能,从而决定其可能的应用领域。无水CaCO3具有方解石、文石和球霰石3种晶型,具有菱面体、纤维状和球形等多种形貌。不同颗粒尺寸、结构与形貌的CaCO3所具有的性能各不相同,可应用于不同的领域,进而产生不同的附加值。在CaCO3的制备过程中实现对其颗粒尺寸、结构与形貌的调控将有助于拓宽碳酸钙的应用领域,提升CaCO3的附加值。
图5~图8 给出了氨水的用量、CO2流速、反应温度和反应时间对碳酸钙晶粒尺寸、结构与形貌的影响。由图5(a)可知,不同氨水添加量对产物晶型没有影响,所得产物均为球霰石,所有球霰石呈不规整的球形,这些球形颗粒由直径20~40nm 的小球组合而成[图5(d)~(j)];由图5(c)可知,样品在1491cm-1、1432cm-1处的红外吸收峰均属于碳酸钙中CO2-3的v3振动,在1088cm-1处的吸收峰属于CO2-3的v1振动;877cm-1与745cm-1的吸收峰分别属于球霰石中CO2-3的v2和v4振动[22],样品中未发现其他晶型的红外吸收峰,这与XRD 分析结果一致。由图5(b)可知,碳酸钙颗粒的晶粒尺寸随着氨水添加量的增大呈先增大后趋于稳定的趋势。当氨水的用量为5mL 时,所得产物的晶粒尺寸为29.2nm;当氨水的用量增加到15mL 时,所得产物的晶粒尺寸为36.0nm,继续增大氨水的使用量,产物的晶粒尺寸变化不大。这主要是因为当氨水的用量小于15mL 时体系的碳酸化反应仍为完成,反应初期生成的碳酸钙随着反应的持续进行会不断生长,晶粒逐渐长大,这与图3(a)的分析结果一致。CO2流速对产物晶粒尺寸、结构与形貌的影响具有与氨水的用量相似的变化趋势(图6)。

图5 不同氨水添加量下所得产物的XRD图谱(a)、晶粒尺寸(b)、FTIR图谱(c)、SEM图[(d)~(j),氨水添加量分别为5mL、8mL、10mL、12mL、15mL、20mL、25mL]

图6 不同CO2流速下所得产物的XRD图谱(a)、晶粒尺寸(b)、FTIR图谱(c)、SEM图[(d)~(h),CO2流速分别为50mL/min、80mL/min、100mL/min、150mL/min、200mL/min]
随着反应温度的升高,碳酸化反应的产物晶型逐渐由单一球形球霰石转化为球霰石和纤维状文石共存[图7(a)、(c)~(i)]。由图7(c)可知,当反应温度升高到80℃和100℃时,产物在854cm-1、713cm-1处出现文石中CO2-3的v2、v4振动。除此之外部分产物在849cm-1处出现方解石中C—O的v3振动,但由于其含量较少因此XRD 结果中并未出现方解石的衍射峰。结合SEM 分析[图7(c)~(i)],随着反应温度的升高,溶液中析出少量方解石,继续升高温度球霰石和方解石转化为文石,这与前人的研究结果一致[23]。产物的晶粒尺寸随反应温度的升高呈先增大后减小的趋势[图7(b)]。这主要是因为反应温度的升高有利于促进碳酸化反应的进行,从而促进晶体的生长[24];当温度升高到50℃时,产物中出现方解石晶粒,随着反应温度的持续升高,产物中球霰石进一步转化为方解石和文石,新生成晶相在反应初期晶体未完全生长,晶粒尺寸较小。另一方面,当反应温度达到80℃和100℃时,CO2的溶解量急速降低,参与反应的CO2-3的量大幅减少,生成的碳酸钙的量骤减,晶粒较小,这与图3(c)中80℃和100℃时的钙离子转化率分析结果一致。反应时间对产物晶粒尺寸、结构与形貌的影响具有与反应温度相似的变化趋势(图8)。

图7 不同反应温度下所得产物的XRD图谱(a)、晶粒尺寸(b)、FTIR图谱(c)、SEM图[(d)~(i),反应温度分别为30℃、40℃、50℃、60℃、80℃、100℃]

图8 不同反应时间下所得产物的XRD图谱(a)、晶粒尺寸(b)、FTIR图谱(c)、SEM图[(d)~(g),反应时间分别为30min、60min、90min、120min]
3 结论
(1)磷石膏中二水硫酸钙浸出的优化工艺条件为:磷石膏20g,醋酸钠浓度4mol/L,液固比25mL/g,反应温度50℃,反应时间30min。优化条件下所得钙离子的浸出率为91.1%,浸出渣的化学成 分 为CaO 14.96%、SO32.99%、SiO233.82%、P2O514.01%、Al2O310.28%、Fe2O34.84%、SrO 2.13%、烧失量13.2%、其他组分3.77%。
(2)钙离子浸出液矿化CO2优化的工艺条件为:浸出液400mL,氨水的添加量15mL,CO2流速80mL/min,反应温度30℃,反应时间60min。优化条件下1t 磷石膏吸收208kg 的CO2,并联产472kg CaCO3;产物的基本性能优于标准HG/T 2226—2010 中的指标要求。通过对碳酸化滤液的利用可实现助剂的循环利用与回收。
(3)在矿化过程中,通过调控工艺条件可实现产物颗粒尺寸的调节;通过调节反应温度和反应时间可实现产物晶型的调控。

