纳米材料用于铁死亡联合治疗的研究进展
徐沛瑶,陈标奇,KANKALA Ranjith Kumar,王士斌,陈爱政
(1 华侨大学生物材料与组织工程研究所,福建 厦门 361021;2 福建省生物化工技术重点实验室,福建 厦门 361021)
2012 年,Stockwell 团队发现小分子药物爱拉斯汀(erastin)可引起一种不同于细胞凋亡、自噬和坏死的细胞程序性死亡方式,并将这种死亡方式定义为铁死亡[1]。在形态学上,铁死亡展现出与典型的细胞死亡方式完全不同的特征,通常表现为线粒体萎缩、线粒体膜密度增加、线粒体嵴减少或消失[2]。与细胞凋亡相比,铁死亡可以不受细胞凋亡相关因子的抑制从而可以绕过细胞凋亡的抑制作用[3]。作为一种由铁依赖性和脂质过氧化驱动的特殊细胞死亡方式,铁死亡在肿瘤治疗方面具有广阔的应用前景[4]。目前研究认为细胞内脂质过氧化物代谢和铁稳态的破坏是驱动铁死亡的两个主要机制[5-6]。细胞内铁的积累可导致癌细胞中铁和过氧化氢(H2O2)发生芬顿反应产生活性氧(ROS),并诱导脂质过氧化物产生[7]。目前普遍认为,铁死亡可以通过抑制谷胱甘肽过氧化物酶4(GPX4)及半胱氨酸-谷氨酸交换转运体的活性诱发[8-9]。
近年来研究人员着重开发了多种小分子铁死亡诱导剂用于实现肿瘤治疗,但是较低的靶向作用以及较差的生物利用度限制了小分子药物的应用[10-11]。基于纳米材料比表面积大、尺寸小等特点,其在实现药物靶向递送、控制释放及药物协同治疗方面具有天然的优势,在小分子铁死亡诱导剂递送方面也得到了广泛应用。更重要的是,研究发现部分纳米材料不仅能作为药物载体,其材料本身还能够有效诱导细胞铁死亡[12]。然而,癌细胞内高浓度的谷胱甘肽(GSH)会激活GPX4 而明显降低铁死亡的治疗效果,在一定程度上限制了铁死亡的临床应用。此外,研究人员发现将铁死亡与不同癌症治疗方式进行协同治疗,可实现通过多种抗肿瘤途径高效杀伤肿瘤[13-14]。因此,利用纳米材料作为药物载体协同铁死亡与其他癌症治疗方式,不仅可以实现药物的有效递送,还能增强肿瘤细胞对其他治疗方式的敏感性,或通过多重抗肿瘤途径实现肿瘤协同治疗,已经成为肿瘤治疗领域的热点。
本文首先介绍了不同类型纳米材料在铁死亡协同肿瘤治疗中的应用,总结了基于纳米材料实现铁死亡联合多种治疗方法的抗肿瘤研究(如图1),最后对纳米材料实现铁死亡协同治疗的发展前景及未来研究方向进行展望。
图1 纳米材料用于铁死亡联合治疗肿瘤协同治疗研究的概述图
1 纳米材料在铁死亡联合治疗中的应用
纳米材料能够克服难溶性药物的溶解度差、跨膜难度高、生物利用度低等一系列问题,在肿瘤治疗方面具有明显优势。更重要的是,在一定粒径范围的纳米颗粒能够凭借其被动靶向作用在肿瘤部位富集,或利用特异性分子对其表面进行功能化修饰以实现更大程度蓄积。
基于纳米材料的结构和组成,本文将其分为铁基纳米材料[主要包括氧化铁纳米材料、铁合金纳米材料、含铁元素的金属有机框架(MOF)纳米材料、铁基金属多酚配位纳米材料]及非铁基纳米材料(主要包括无机纳米材料、聚合物纳米材料、MOF 纳米材料)两类,并阐明其在铁死亡联合治疗方面的应用。
1.1 铁基纳米材料
铁死亡过程与铁元素密切相关,铁基纳米材料在增加细胞内铁的利用率方面具有得天独道的优势。铁基纳米材料利用芬顿反应破坏细胞内的氧化平衡诱发铁死亡。此外,研究人员设计了多种铁基纳米材料不仅可以实现铁死亡,还可实现药物负载或展现出了其他形式的抗肿瘤作用。
1.1.1 氧化铁纳米材料
氧化铁纳米材料已获得美国食品和药物管理局批准用于临床,也是最为常见的铁死亡诱导剂,超顺磁性氧化铁纳米材料还可以作为核磁共振成像剂实现肿瘤诊断,可有效实现诊疗一体化[15]。例如,Xu 等[16]合成了锰掺杂四氧化三铁多孔纳米颗粒用于递送化学治疗药物阿霉素,在肿瘤酸性环境下,该纳米系统可以通过催化H2O2产生细胞毒性的羟基自由基,实现铁死亡协同化学治疗。
研究人员也构建了多种纳米载体对氧化铁实现修饰、包覆及复合,以提高氧化铁纳米材料在肿瘤部位的富集,并同时实现铁死亡联合治疗。例如,Cun等[17]利用铁基MOF对四氧化三铁纳米颗粒进行修饰,并利用其孔隙实现光热治疗剂IR780的负载以实现铁死亡联合光热治疗。Zhang 等[18]则合成了具有花生结构的四氧化三铁/氧化钆纳米颗粒并实现铂(Ⅳ)前药的有效递送,该复合结构能够将氧气递送至肿瘤细胞并促进铁死亡,同时联合化学治疗对前列腺癌细胞的增殖实现有效抑制。
此外,通过利用天然或合成聚合物材料对氧化铁纳米材料进行修饰或包裹,在铁死亡联合治疗方面应用最为普遍。例如,Liang 等[19]构建了卟啉接枝的脂质体用于包裹超小四氧化三铁纳米颗粒,该复合纳米颗粒可实现卟啉的高效负载,并在激光照射下展现了优异的光动力协同铁死亡抗肿瘤效果。Zhang 等[20]设计了一种基于叶酸修饰的氧化铁纳米颗粒共载顺铂和GPX4 靶向小干扰核糖核酸(RNA)(si-GPX4)的复合纳米颗粒(图2),氧化铁纳米颗粒在胞内降解后显著增加了铁水平并促使芬顿反应发生而诱导铁死亡,顺铂通过破坏细胞核和线粒体脱氧核糖核酸(DNA)诱导细胞凋亡,共同释放的si-GPX4 通过抑制GPX4 表达提高治疗效果,对脑胶质瘤展现出了优异的抑制效果。

图2 叶酸修饰的氧化铁纳米颗粒共载顺铂和si-GPX4复合纳米颗粒用于铁死亡联合治疗脑胶质瘤的作用机制[20]
体内来源的细胞膜在药物递送方面展现了优异的应用前景。例如,Liu 等[21]构建了巯基修饰的四氧化三铁纳米颗粒与程序性死亡受体-1(PD-L1)特异的小干扰RNA(siPD-L1)偶联,并利用小胶质细胞的细胞膜在其表面包被用于实现脑肿瘤靶向。该靶向纳米颗粒可在肿瘤部位有效释放siPDL1 从而显著降低PD-L1 的蛋白表达,还能够有效诱导肿瘤细胞的铁死亡并促进树突状细胞的成熟,对胶质母耐药细胞瘤展现了优异的协同抗肿瘤效果。
表1中列举了基于氧化铁纳米材料用于实现铁死亡联合治疗的相关应用。
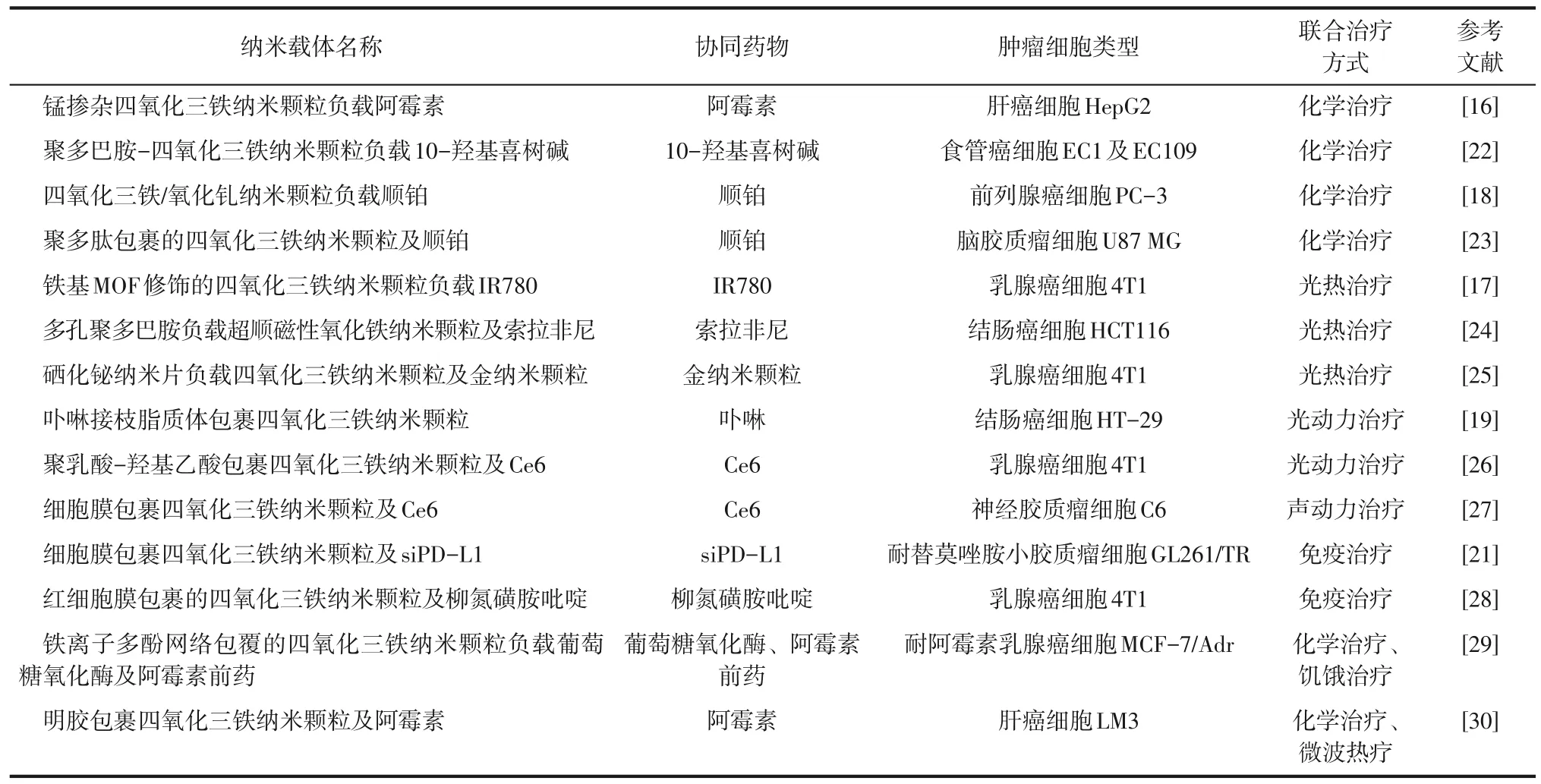
表1 基于氧化铁纳米材料用于实现铁死亡协同肿瘤治疗的应用实例
1.1.2 铁合金纳米材料
除氧化铁颗粒外,研究人员通过设计合成了铁合金纳米颗粒用于实现协同治疗。Zhang 等[31]利用pH 响应及具有靶向性的脂质体包裹合成的FePt 纳米颗粒及葡萄糖氧化酶以实现铁死亡联合饥饿治疗。Yang等[32]则合成了超小FePtMn纳米晶体并在其表面修饰叶酸及光敏剂二氢卟吩e6(Ce6),当纳米晶体通过叶酸靶向递送到肿瘤微酸环境后,能有效释放亚铁离子并通过芬顿反应催化H2O2转化为氧气和单线态氧。重要的是,所产生的氧气能逆转肿瘤乏氧微环境并提升Ce6 的光动力效果。此外,FePtMn纳米晶体具有较强的光热转化效率,展现了优异的铁死亡/光动力学/光热联合治疗效果。
1.1.3 含铁元素的MOF
MOF 是一类由金属及有机连接体通过配位键相连的新型多孔材料,具有尺寸可控、比表面积大、孔隙率高等优点[33]。含铁元素的MOF 不仅能够在肿瘤部位释放亚铁/铁离子诱导铁死亡,其孔径结构还可有效对不同种类的药物实现负载,在铁死亡协同治疗领域具有独特的优势[34]。
Xu 等[35]通过一锅法构建了负载阿霉素的含铁非晶态MOF,并在其表面修饰透明质酸实现靶向作用。该纳米颗粒展现了优异的光热升温效果,靶向肿瘤后在肿瘤微环境下响应性释放药物,其中阿霉素发挥化学治疗作用诱导细胞凋亡,并通过提高细胞内H2O2水平而促进铁死亡的效果,实现了肿瘤的光热-化学治疗-铁死亡协同高效治疗。除实现单一药物递送外,Yang等[36]构建了铁与二硫化物修饰的有机配体组成的MOF 用于实现葡萄糖氧化酶及阿霉素的协同递送,并利用癌细胞对其表面进行靶向修饰获得靶向纳米颗粒。结果显示,该纳米颗粒展现出优异的肿瘤靶向能力,负载的葡萄糖氧化酶通过催化肿瘤细胞内的葡萄糖以提高H2O2水平并放大芬顿反应,导致过量的ROS 生成并抑制糖酵解过程。更重要的是,铁死亡与阿霉素联合作用有效诱导免疫原性细胞死亡并释放抗原以启动抗肿瘤免疫循环,葡萄糖代谢的抑制显著改善肿瘤免疫抑制微环境并促进了抗肿瘤的免疫循环过程,最终展现了优异的肿瘤抑制效果。
1.1.4 铁基金属多酚配位纳米材料
由于铁离子特殊的性质,可与多酚或多酚衍生物鳌合后获得自组装纳米颗粒。Mu 等[37]利用铁离子与表没食子儿茶素没食子酸酯自组装形成纳米颗粒并递送药物阿霉素,被细胞摄取实现了阿霉素和铁离子的有效释放,这一化学治疗联合铁死亡治疗方式对肿瘤展现了优异的抑制作用。Liu 等[38]则利用铁离子和单宁酸的螯合作用,在已制备好的索拉非尼纳米颗粒表面修饰获得pH 响应性的自沉积网络,并用于负载光动力治疗剂亚甲蓝。在肿瘤微环境下,螯合作用被破坏进而促进亚甲蓝释放以实现光动力治疗,同时触发索拉非尼释放以启动铁死亡过程。过量的单宁酸将铁离子转化为亚铁离子,造成了细胞中亚铁离子的持续释放并进一步提高了铁死亡对癌细胞的杀伤效率。
1.2 非铁基纳米材料
除了直接供应外源铁/亚铁离子以加速芬顿反应的铁基纳米材料外,研究人员还设计了多种利用非铁基纳米材料通过消耗胞内GSH、调节肿瘤细胞中的脂质过氧化或递送铁死亡诱导剂等多种方式实现铁死亡协同治疗。
1.2.1 无机纳米材料
介孔二氧化硅、二氧化锰、贵金属等无机纳米材料也可用于实现肿瘤的铁死亡联合治疗。介孔二氧化硅是最为常用的纳米药物载体,其不仅自身可以单独实现药物递送,还可作为其他颗粒的壳层以实现进一步载药[39]。Li 等[40]构建了基于上转化纳米颗粒为核、介孔二氧化硅为壳层、脂质体为表面层的复合纳米颗粒,用于实现光敏剂Ce6及铁死亡诱导剂丁硫氨酸硫酸亚胺的共递送。该复合纳米颗粒能有效利用上转换纳米颗粒的特性实现深层光动力治疗,同时释放的丁硫氨酸硫酸亚胺能有效清除胞内的GSH并导致GPX4失活后诱导铁死亡。
二氧化锰纳米颗粒自身可以通过消耗细胞内GSH 促进肿瘤细胞的铁死亡,在铁死亡治疗中具有优异的表现和前景。Liu 等[41]发现合成的碱金属掺杂的二氧化锰纳米花可有效增加胞内ROS水平、促进脂质过氧化物的积累并下调GPX4水平,进而诱导肿瘤细胞铁死亡。此外,该纳米颗粒展现了优异的光热/光催化协同效应,可有效抑制胞内的热休克蛋白(HSP)90表达以实现肿瘤高效治疗。
重金属纳米颗粒如金、铂等也可以消耗细胞内GSH 或提升胞内ROS 水平,促进肿瘤细胞的铁死亡。Wei 等[42]构建了细胞膜修饰的金纳米笼用于实现光热治疗化学治疗协同铁死亡,近红外激发下可促进丁硫氨酸硫酸亚胺及阿霉素的释放,这一联合治疗手段能有效促进M2 型巨噬细胞转化为M1 型巨噬细胞,以激活T淋巴细胞并促进细胞因子的释放,在体外和体内均表现出优异的抗肿瘤效果。Valle 等[43]构建了具有光热性能的铂修饰的星型金纳米颗粒,在近红外光照射下,纳米颗粒可有效诱发细胞热损伤并诱发脂质过氧化物累积,对多药耐药肿瘤展现了显著的抑制作用。
1.2.2 聚合物纳米材料
常见的聚合纳米材料如合成聚合物纳米材料、天然聚合物纳米材料等广泛应用于生物医药领域,其具有无/低毒、体内易被代谢等优点,在肿瘤治疗方面具有独特的优势。
牛血清白蛋白、人血清白蛋白等天然聚合材料是较为常见的药物载体。Wang 等[44]则利用Ce6-牛血清白蛋白偶联物通过偶氮苯与转铁蛋白结合实现索拉非尼的递送,该复合纳米反应器展现了优异的肿瘤靶向效率,在光动力治疗引起严重的肿瘤乏氧环境中,低氧响应性的偶氮苯被破坏进而导致更多Ce6的释放。此外,响应释放的铁蛋白和索拉非尼可通过诱发铁死亡展现出出色的联合治疗能力。Xu等[45]则通过自组装的方式将光敏剂Ce6及索拉非尼共载于血红蛋白中,并将基质金属蛋白酶-2 响应肽嵌入该结构获得复合纳米结构,以实现药物响应性释放并联合铁死亡及光动力治疗,见图3。

图3 血红蛋白负载Ce6和索拉非尼复合纳米颗粒用于铁死亡联合光动力治疗的作用机制[45]
Ou 等[46]开发了具有近红外二区吸收的有机光热剂TMB-F4TCNQ 并将其与叶酸修饰的聚乙二醇通过超分子自组装和纳米沉淀法构建复合纳米颗粒。该复合纳米颗粒通过消耗半胱氨酸水平而抑制GSH 合成引发铁死亡,联合光热治疗对肿瘤具有优异的杀伤效率。研究人员也通过对聚合物进行设计获得响应性纳米药物载体用于实现药物的精准释放。Jiang等[47]设计了基于二硫键的聚合物纳米颗粒用于包覆葡萄糖转运蛋白1抑制剂(BAY-876)及阿霉素-DNA配体配合物,含二硫键的聚合物有效响应肿瘤细胞内过表达的GSH并释放药物。此外,GSH 的消耗有效地诱发铁死亡并联合阿霉素的化疗效果以及BAY-876 的糖酵解抑制效果,有效提升了肿瘤细胞对化学治疗的敏感性。
1.2.3 MOF
除含铁元素的MOF 外,研究人员发现不含铁元素的MOF 也可通过实现铁死亡诱导剂的有效递送或基于其自身性质诱导铁死亡。Meng 等[48]设计了一种含二硫化物的咪唑配体与锌配位形成的MOF用于递送光敏剂Ce6,当纳米颗粒在肿瘤部位聚集后,含有二硫键的有机配体诱导细胞内GSH消耗以促进GPX4失活并诱导铁死亡,同时,激光照射触发单线态氧的产生实现协同治疗。类似地,Xu 等[49]构建了锰卟啉基MOF 用于实现铁死亡联合声动力治疗,该纳米颗粒可以通过促进GSH 耗竭进而引发铁死亡。此外,在超声刺激作用下,纳米颗粒能够有效将产生的氧气转化为ROS,提高了声动力治疗的效果。
2 铁死亡联合治疗策略
前文讨论了不同纳米材料用于铁死亡联合治疗,除关注材料本身性质外,了解单一治疗策略的优势和缺点及其与铁死亡联合抗肿瘤特点也极为重要。表2中简单列举了目前临床常用的单一治疗手段的优势及缺点,并讨论了不同治疗方式与铁死亡协同治疗策略的特点。

表2 不同治疗方式与铁死亡协同治疗策略的特点
2.1 铁死亡联合化学治疗
化学治疗是临床上最具代表性的肿瘤治疗手段,具有普适性广、可操作性强等诸多优点。化学治疗药物受到如溶解度低、稳定性差、肿瘤靶向能力差以及易产生耐药性等限制导致其临床治疗效率不高,且全身毒副作用会加重癌症病人的身体负担,进而限制了其临床使用。纳米药物载体在提高化学治疗药物的药物传递效率和肿瘤靶向能力方面展现了一定的优势,但一些商用纳米制剂的临床效果比预想中低很多[50]。
化学治疗与铁死亡联合治疗已成为癌症治疗的新兴领域。Wang 等[51]构建了前列腺特异性抗原靶向修饰的砷纳米片负载阿霉素以实现靶向前列腺癌的协同治疗,其一方面通过引起溶质载体家族7成员11 的表达并触发GSH 耗竭而后诱导铁死亡;另一方面通过下调共济失调毛细血管扩张突变基因的表达进而对阿霉素的化学治疗效果实现增效。此外,顺铂类药物也可以激活烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶,并通过转移NADPH的电子产生氧气,通过超氧化物歧化酶提高胞内H2O2水平,进而为芬顿反应提供更多的原料[52]。Gao等[23]则构建了基于聚多肽为载体递送四氧化三铁及顺铂的纳米颗粒,当纳米颗粒到达溶酶体后可释放四氧化三铁,通过级联反应促使铁死亡,并释放顺铂有效诱导细胞凋亡。结果显示,该复合纳米载体不仅展现出了优异的核磁共振成像介导的铁死亡-化学治疗协同治疗性能,还显著降低了顺铂的毒性。Pan等[53]制备了癌细胞膜修饰的铁基MOF纳米材料用于实现抗肿瘤药物替拉扎明的靶向递送(图4),该纳米材料与富含GSH 及H2O2的肿瘤微环境发生氧化还原反应及芬顿反应,触发铁死亡并通过产生氧气增强光动力治疗的效果。随后,在激光照射下光动力过程消耗氧气并加重肿瘤乏氧,进一步激活缺氧响应性前药替拉扎明的化学治疗效果,展示出优异的协同抗肿瘤作用。
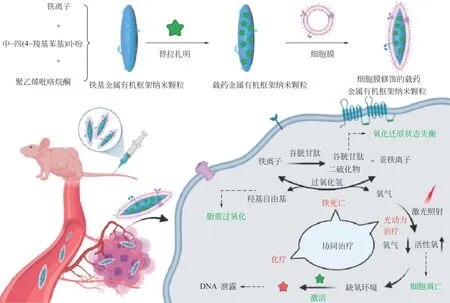
图4 细胞膜修饰铁基金属有机框架纳米颗粒用于负载替拉扎明用于实现光动力治疗-化学治疗-铁死亡联合作用机制[53]
除较高的毒性问题外,化学治疗引起的肿瘤多药耐药或肿瘤固有的耐药性仍是限制化学治疗应用的主要问题[54]。有趣的是,研究发现铁死亡与肿瘤治疗的耐药性相关,诱导铁死亡可以有效逆转肿瘤的多药耐药性以实现高效治疗。Peng等[55]设计了基于铁离子与土槿皮乙酸B的自组装纳米颗粒并利用MOF 及红细胞膜进行表面修饰,MOF 的多孔结构实现阿霉素负载,探究其对耐阿霉素肿瘤细胞的协同治疗效果。该纳米颗粒可有效诱导肿瘤细胞的铁死亡并释放药物,铁死亡通过调节细胞膜的流动性和通透性并下调P糖蛋白的表达,从而逆转肿瘤的多药耐药性并发挥协同抗肿瘤效果。
2.2 铁死亡联合光热治疗
光热治疗作为一种低创且高效的肿瘤治疗方式,其造成的高温能有效诱导细胞蛋白变性并造成细胞膜不可逆损伤。此外,与正常细胞相比,癌细胞耐受高温的能力较低。然而,光热治疗常需要较高的局部温度以实现肿瘤高效清除,可能会造成周围正常组织的坏死[56]。此外,由于癌细胞通过表达HSP产生耐热性抵抗光热治疗效果,使得肿瘤在光热治疗后快速复发。
光热治疗与铁死亡联合抗肿瘤也展现了令人瞩目的优势。一方面,光热治疗可以促进芬顿反应的速率进而促进铁死亡。Chang 等[57]合成了负载钯单原子的锌基MOF 结构用于实现低温光热治疗联合铁死亡,该复合纳米颗粒展现了优异的光热转换性能,并通过高效催化ROS 产生并促进GSH 消耗进而诱发铁死亡。该研究还发现胞内ROS 以及脂质过氧化物的积累导致HSP 的表达受到抑制,使得光热治疗的效果进一步提高。Cui 等[58]制备了富含铁离子的聚吡咯纳米颗粒用于铁死亡联合治疗光热治疗(图5),该纳米颗粒可分解胞内的H2O2生成羟基自由基进一步诱导铁死亡。此外,该纳米颗粒表现出优异的光热升温效果,不仅显示出优异的光热性质,还可以加快芬顿反应的效率进而增强铁死亡的效果。另一方面,铁死亡过程中ROS 和脂质过氧化物的积累可通过抑制HSP 的表达,进而可以阻止癌细胞对光热治疗的抵抗效果。
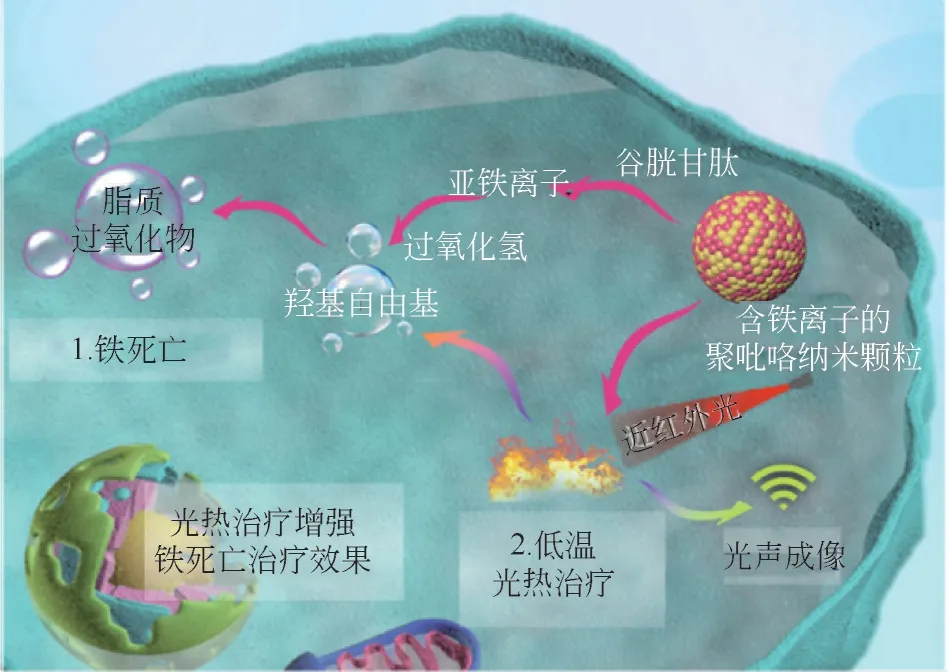
图5 含铁离子的聚吡咯纳米颗粒用于实现光热治疗增强铁死亡的作用机制[58]
2.3 铁死亡联合光/声动力治疗
光动力治疗作为一种非侵入性临床疗法广泛应用于浅表癌症的治疗,其基于激光照射光敏剂所产生的光化学反应生成ROS 进而诱导细胞凋亡/坏死[59]。由于激光的穿透深度有限,研究人员也发现在超声刺激下声敏剂也可以产生ROS 进而实现声动力治疗[60]。尽管光/声动力治疗展现出了可控的肿瘤治疗优势,但由于肿瘤血管的供血不足和治疗过程中细胞耗氧量高等因素进一步造成了肿瘤乏氧,削弱了光/声动力治疗的效果。
铁死亡联合光/声动力治疗在肿瘤治疗方面有优异的应用前景。研究发现,光动力治疗可作为芬顿反应中H2O2的来源并提供单线态氧用于脂质过氧化过程[61]。例如,Chen等[26]设计了一种基于聚乳酸的纳米载药平台用于实现Ce6及四氧化三铁纳米颗粒的递送。释放的Ce6在激光照射下产生单线态氧,从而诱导肿瘤细胞死亡并促进铁死亡的治疗效果。此外,铁死亡过程的芬顿反应导致氧气积累,进而缓解肿瘤乏氧微环境用于提高光动力治疗效果。Zhu 等[62]构建了Ce6 及铁死亡诱导剂erastin 自组装纳米颗粒用于协同治疗。纳米颗粒被肿瘤细胞摄取后,铁死亡导致细胞内部ROS 积累并通过芬顿反应增加肿瘤部位的氧气浓度。持续生成的氧气能有效克服肿瘤乏氧微环境,以促进光动力治疗对细胞的氧化损伤作用。
声动力治疗能够有效突破光动力治疗穿透深度不够的壁垒,声动力治疗联合铁死亡已展现出了明显优势。Zhou等[63]构建了共载声敏剂原卟啉及临床批准药物纳米氧化铁的脂质体纳米平台,在超声作用下诱导原卟啉的声动力治疗不仅能诱导细胞凋亡发挥抗肿瘤作用,还能通过促进细胞选择性自噬来提高纳米氧化铁诱导铁死亡的敏感性。
2.4 铁死亡联合其他治疗方式
除上述典型的肿瘤治疗方法外,其他治疗方式(如饥饿治疗、气体治疗、免疫治疗等)与铁死亡协同抗肿瘤方面也展现出各自的优点。例如,Wan等[64]制备了癌细胞膜包裹的负载了葡萄糖氧化酶的铁基MOF 纳米材料实现饥饿治疗与铁死亡协同治疗。在肿瘤部位纳米材料的崩解导致芬顿反应的发生,同步释放的葡萄糖氧化酶催化葡萄糖生成葡萄酸和H2O2,进而克服铁死亡过程中H2O2不足的缺点以实现协同治疗。Zhang 等[65]则构建了叶酸靶向修饰的锌基MOF 用于一氧化氮气体联合铁死亡协同治疗。在溶酶体酸性条件下,双氢青蒿素和硝普钠在胞内大量释放,硝普钠一方面释放亚铁离子与双氢青蒿素作用诱发铁死亡,另一方面分解为一氧化氮促进细胞凋亡,对头颈部鳞状细胞癌具有优异的协同抑制作用。Liu 等[66]合成了基于铁离子、锰离子及单宁酸的金属多酚网络纳米结构实现抗PDL1 DNA 的递送。纳米颗粒所诱导的光热治疗及铁死亡作用具有协同抗肿瘤活性,还能有效诱导免疫原性细胞死亡。此外,共同释放的锰离子作为金属辅因子激活脱氧核酶有效下调PD-L1,最终促进免疫治疗的疗效。
3 结语
铁死亡作为一种新型的肿瘤治疗方式,在临床转化方面具有广阔的应用前景。纳米技术的蓬勃发展为肿瘤治疗奠定了深厚的基础,纳米材料用于诱导铁死亡的研究日益增多。更重要的是,利用纳米材料实现药物协同递送,可通过整合多种治疗方式以实现更为高效的治疗效果,目前已经成为铁死亡的主要研究方向之一。然而,基于纳米材料用于铁死亡的协同抗肿瘤方式在临床转换方面仍需要跨越巨大的障碍。
(1)当前研究对铁死亡诱导剂所参与的铁死亡途径中的详细机制及作用通路知之甚少,基于利用铁死亡联合作用机制对不同类/亚型的癌症治疗效果研究尚浅,评价其对不同类型肿瘤的疗效仍需要更多的理论支撑。
(2)尽管铁基纳米材料可引入大量外源铁引发铁死亡,但肿瘤微酸环境及较低的H2O2浓度无法快速且有效产生铁/亚铁离子和ROS,其诱发的联合治疗效果可能不佳,设计开发不依赖酸性环境及H2O2浓度的铁基纳米材料可能是未来研究的方向之一。相比于铁基纳米材料而言,非铁基纳米材料可通过GSH耗竭、GPX4失活或增加细胞内ROS实现铁死亡,但其本身通常无法实现肿瘤成像功能,开发具有诊疗一体化性能的非铁基纳米材料用于实现铁死亡联合治疗可能是未来研究的热点。
(3)将铁死亡与放疗、基因治疗等治疗方式或利用多重联合治疗方式实现协同抗肿瘤的工作仍在探索过程中。设计集成像、治疗、诊断于一身的多功能纳米材料并制定合适的联合治疗策略,可能是未来研究的重点方向。
(4)研究纳米材料的生物安全性依旧是实现其临床使用的重中之重,需要进一步确定纳米材料对正常细胞、组织、器官的副作用,并从降解、代谢等多角度评价纳米材料的毒性。
总之,结合多学科领域知识及研究手段以确定铁死亡的具体作用机制、探索高效协同治疗手段和开发生物相容性好的纳米材料将成为重点。相信在研究人员的共同努力下,铁死亡联合治疗手段可能在肿瘤临床治疗领域获得进一步应用。

