短链伯醇氧化酶的研究进展
王首丰,丛文杰,曹昕莼,陆婷,王明轩,周化岚,张建国
(上海理工大学 健康科学与工程学院,上海,200093)
短链伯醇氧化酶(short-chain primary alcohol oxidase,SPAOX,EC 1.1.3.13)是一种依赖黄素腺嘌呤核苷酸(Flavin adenine dinucleotide,FAD)氧化短链伯醇(C1~C8)生成相应的醛和过氧化氢的氧化还原酶。SPAOX最早由JANSSEN等[1]于1968年从Basidiomycete(多孔菌科担子菌)的菌丝体中分离出来。近年来,SPAOX在甲基营养型微生物等多种真核生物中被发现。而且,SPAOX已经较为广泛地应用于醇类分析、生物转化等场景中。与SPAOX相关的研究逐渐得到众多学者的关注,取得一定进展的同时具有广泛的应用前景。本文对比了不同生物来源的SPAOX,阐述了其催化机制,总结了SPAOX性质的优缺点,并对提高SPAOX稳定性的研究进行了展望,以期为其进一步的应用奠定基础。
1 SPAOX的来源和催化机制
SPAOX已经在博乙丁假丝酵母(Candida boidinii)[2]、汉逊酵母(Hansenulapolymorpha[3]、Ogataeaangusta[4])、法夫驹形氏酵母(Komagataellaphaffii)[5-6]、毕赤酵母(Pichiasp.)[7]等甲基营养型酵母中发现,也在土曲霉(Aspergillusterreus)[8-9]、黄孢原毛平革菌(Phanerochaetechrysosporium)[10]等丝状真菌中存在。利用软件MEGA7[11]对SPAOX的基因进行进化树分析(图1),表明SPAOX有2个分支;其中上分支第一部分中的SPAOX主要来源于甲基营养型酵母菌、曲霉以及癌肿病菌(Lachnellulawillkommii)、特异青霉(Penicilliumchrysosporium)、立枯丝核菌(Rhizoctoniasolani)等真菌;上分支第二部分则来源于褐孢霉(Fulviafulva)、密粘褶菌(Gloeophyllumtrabeum)、朱红栓菌(Trametescinnabarina)、牛樟芝(Taiwanofunguscamphoratus)、原毛平革菌(Phanerochaetesordida)等真菌。而下分支中的SPAOX主要来源于短梗霉(Aureobasidiumsp.)、担子菌(Basidiomycete)、炭疽病菌(Colletotrichumchlorophyti)、裂褶菌(Schizophyllumcommune)、环红酵母(Rhodotorulatoruloides)、炭角菌(Xylariomycetidaesp.)等真菌。两个分支中微生物种类差异较大。例如,上分支中汉逊酵母、博乙丁假丝酵母、法夫驹形氏酵母等甲基营养型酵母菌中SPAOX序列的分支置信度达100。其他真菌类,例如青霉、曲霉、原毛平革菌、牛樟芝、担子菌等的置信度则为13~99。
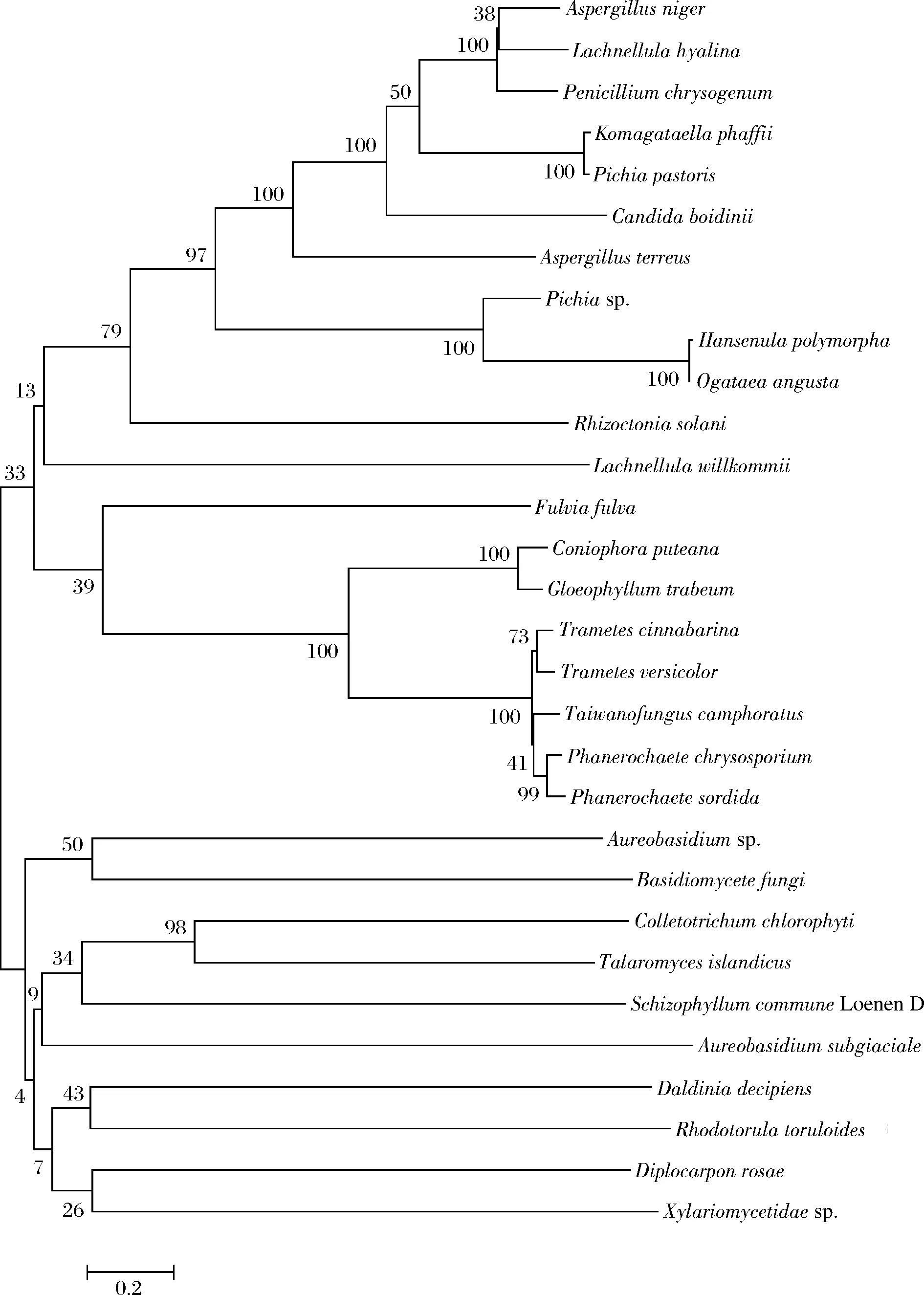
图1 短链伯醇氧化酶基因的进化树
因为SPAOX在甲基营养型酵母中参与甲醇代谢,将甲醇氧化成甲醛和过氧化氢,所以很多关于SPAOX的研究以甲基营养型酵母中的SPAOX作为研究对象来开展[12-13]。甲基营养型酵母新生成的SPAOX依靠其过氧化物酶体靶向信号(peroxisome targeting signal,PTS),被运输到过氧化物酶体中发挥作用。SPAOX单亚基的分子质量约为65 k~80 kDa,SPAOX的活性功能体是含有8个FAD辅因子和8个亚基的同源八聚体,分子质量约500~700 kDa。SPAOX属于葡萄糖-甲醇-胆碱(glucose-methanol-choline,GMC)家族氧化还原酶,由FAD结合域和底物结合域组成。GMC家族氧化还原酶的FAD结合域的氨基酸序列保守,而由于不同酶的最适底物不同,使得底物结合域的氨基酸序列差异较大[14]。因为GMC氧化还原酶的催化活性中心(组氨酸/组氨酸或组氨酸/天冬酰胺)高度保守,所以其催化机制相似[15]。SPAOX的催化过程分为还原半反应(还原FAD,以及醇类电子供体底物的氧化)和氧化半反应(FADH2被氧化形成H2O2)[16]。其中催化活性中心进行还原半反应,H567与醇底物结合并在催化过程中携带正电荷,由N616催化醇底物并稳定醇盐的负电荷[17]。结合口袋的W566和F98的芳香族侧链限制了底物分子的可用空间,使其最适底物为短链伯醇[3,18]。还原半反应中底物的氢转移到FAD的异四氧嘧啶上,FAD被还原成FADH2。另一部分氧化半反应的FAD结合域E38与FAD的腺嘌呤基团结合,N97与黄素连接环相互作用,FADH2被氧重新氧化成FAD,并释放H2O2[5, 17]。不同于乙醇脱氢酶(alcohol dehydrogenase,ADH,EC 1.1.1.1)在催化反应中不断消耗辅酶烟酰胺腺嘌呤二核苷酸,SPAOX循环利用FAD是一大优势[19]。
表1总结了GMC氧化还原酶家族常见酶的单体分子质量、结构、底物结合口袋等性质。其中,只有SPAOX是八聚体,其他家族中的酶都是单体或二聚体。单体大小除了胆固醇氧化酶(cholesterol oxidase)为36 kDa相对较小,其他都在60 k~80 kDa附近。底物结合口袋中都有H/H或H/N作为底物催化活性中心,而限制底物分子可用空间的氨基酸有所不同。例如SPAOX中的F98在胆碱氧化酶(choline oxidase)中为S101,W566为V464,而F98在芳香醇氧化酶(aryl-alcohol oxidase)中为Y92,在胆固醇氧化酶中为G66,而丝氨酸、缬氨酸、甘氨酸等氨基酸的残基都较小,使得这些氧化酶可催化诸如胆碱、胆固醇等较大醇类底物[5, 17]。

表1 GMC氧化还原酶家族结构的比较
SPAOX在过氧化物酶体中组装成八聚体,得益于外界条件的影响,促使亚基相互接触[17]。由于八聚体结构组装较困难,因此SPAOX的稳定性较差,容易受到环境的影响而降解。
2 SPAOX的性质
2.1 底物特异性
SPAOX的底物主要为甲醇、乙醇、正丙醇、正丁醇。随着醇类底物碳链的增长,SPAOX的Km值逐渐变大,活力也逐渐下降(表2)。甲基营养型酵母中多形汉逊酵母(HansenulapolymorphaDL-1)SPAOX的Km值最小,为0.23 mmol/L。其他类型真菌中只有茯苓(Poriacontigua)SPAOX的Km为0.2 mmol/L,小于甲基营养型酵母SPAOX的Km值。而且,茯苓SPAOX的最大反应速率为12.8 μmol/(min·nmol),高于目前报道的其他SPAOX的最大反应速率[24]。对SPAOX进行突变可以改变其催化底物的性质。SPAOX对甲醇和乙醇表现出良好的催化活性,对其他底物的低活性限制了SPAOX的进一步应用。SPAOX的蛋白质工程改造使其适配多种底物,将拓宽SPAOX的应用范围。DMYTRUK等[25]对多形汉逊酵母SPAOX进行突变,得到对甲醇Km值从0.62 mmol/L提高到1.1~2.48 mmol/L,拓宽了多形汉逊酵母SPAOX突变体的应用范围。虽然大部分SPAOX也展现出较弱的氧化甲醛的活力(表2),但是KJELLANDER等[26]将毕赤酵母SPAOX固定到纳米多孔氧化铝膜后,固定化SPAOX对甲醛表现出与游离酶对甲醇的102%相对活力,说明固定化技术为保护SPAOX不受甲醛的损伤提供了有力保障。
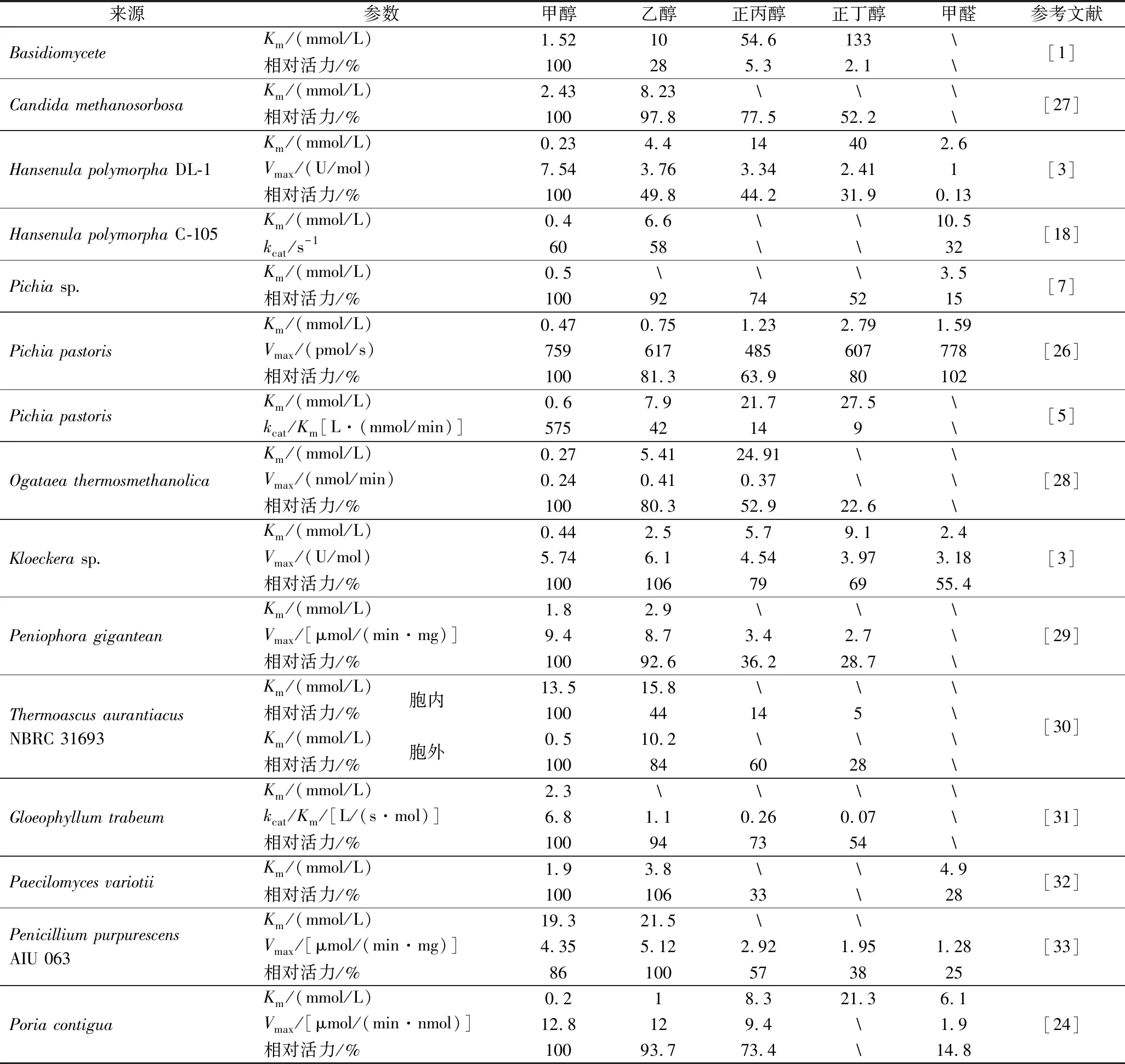
表2 不同SPAOX的底物特异性比较
2.2 SPAOX活力
由于SPAOX的八聚体结构,易受到环境因素的影响,因此,很多学者对多种SPAOX的影响因素pH、温度、化合物等进行考察。
2.2.1 环境的影响
表3汇总了pH和温度分别对不同SPAOX活力的影响。SPAOX的最适pH可以低至5,也可以高达9。部分菌株来源的SPAOX具有相同的最适pH,例如Candida25-A和Komagataellapastoris的最适pH为7.5。Ogataeaangusta、Aspergillusterreus和PenicilliumpurpurescensAIU 063的最适pH为8.5。Phanerochaetechrysosporium、Pichiasp.、Phanerochaetechrysosporium和Ogataeathermomethanolica的最适pH为9。相比pH性质的较为相似性,不同SPAOX的最适温度差异较大。例如Aspergillusochraceus[34]、Candidamethanosorbosa[27]、Thermoascusaurantiacus[30]、Ogataeaangusta[4]、Phanerochaetechrysosporium[10]、Ogataeathermomethanolica[28]的SPAOX均有较好的热稳定性,最适温度为45~55 ℃左右;而其他SPAOX的最适温度均为25~40 ℃左右。环境因素除了pH和温度,静水压力也会影响SPAOX的活力[35-36]。高静水压力会稳定SPAOX的热失活,尤其是酶的不稳定组分,使得结构更加稳定。高静水压力可以使SPAOX在高温下保持活性并获得更快的反应速度。
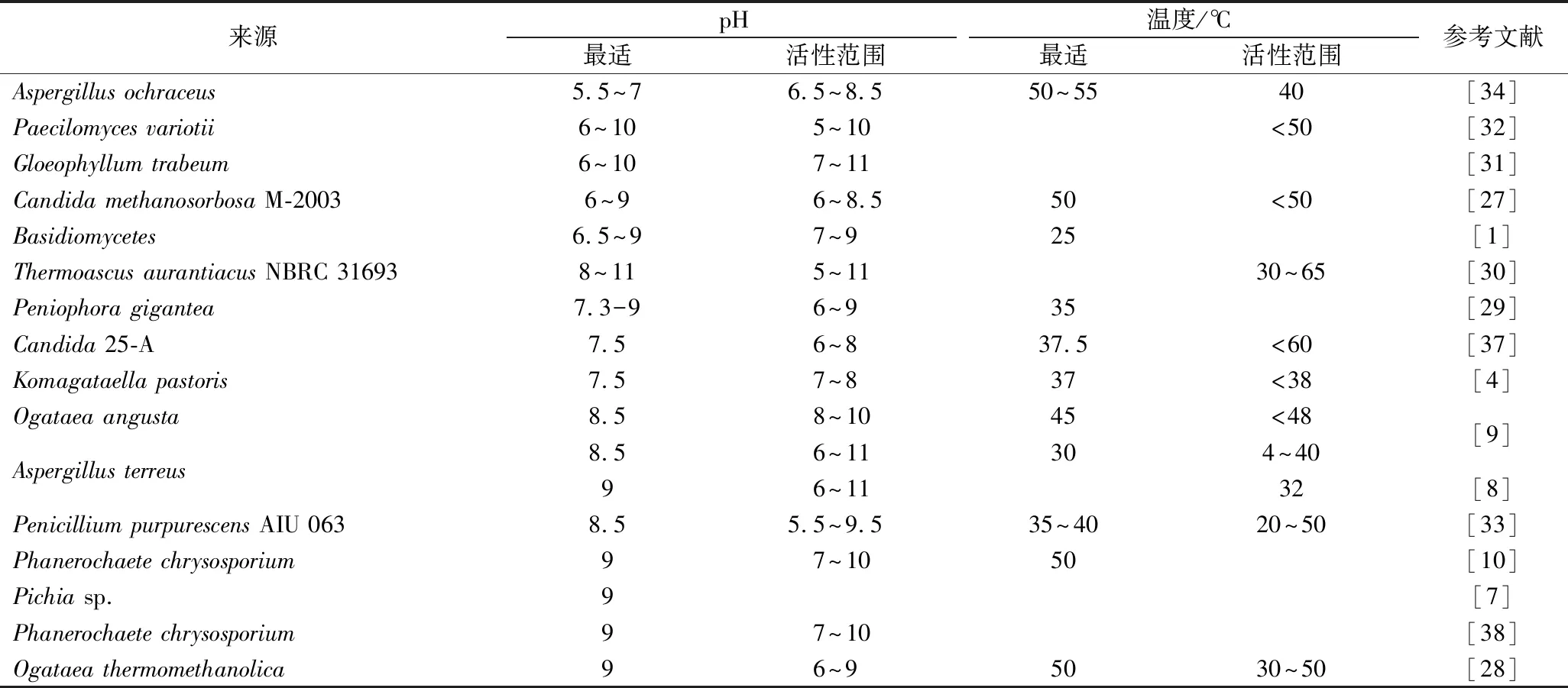
表3 不同SPAOX性质的比较
2.2.2 化合物的影响
SPAOX溶液中有机、无机化合物、金属离子等物质会影响SPAOX活性(表4、表5)。其中联吡啶对SPAOX活性没有显著影响。羟基喹啉、氨基脲、Cu2+等因为羰基作用对SPAOX活性有一定的抑制[33]。羰基试剂诸如苯肼、羟胺以及肼等也对SPAOX活性有显著抑制作用[32,34]。Cd2+、Hg2+等金属离子对Candida、Ogataeapolymorpha、Paecilomycesvariotii的SPAOX活性有显著抑制作用,而其他金属离子对SPAOX活性无显著影响[7,29-30,34,39-40]。这也使得金属螯合剂乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、邻菲咯啉对SPAOX活性也无显著抑制作用[39]。叠氮化钠是甲醇的可逆竞争性抑制剂,结合位点位于SPAOX的活性中心区域,与FAD作用,从而改变SPAOX二级结构[18]。此外,SPAOX在环丙酮中20 ℃、pH 7.5条件下孵育2 h后完全失去活性[41]。但是在隔绝氧气情况下能有效抑制失活。由于SPAOX活性位点附近有巯基,因此,对氯苯甲酸汞(p-chloromercuribenzoate,PCMB)、Cu2+、Hg2+等对巯基有封闭作用的化合物对SPAOX有显著抑制作用。这表明SPAOX中半胱氨酸残基对于维持结构的作用必不可少[24,27,32]。此外,可以通过在Hg2+处理后的SPAOX中添加硫醇或在Cu2+处理后的SPAOX中添加EDTA进行去抑制[40]。过量的β-巯基乙酸可恢复由PCMB引起的失活,表明抑制由有机汞与巯基结合而引起[40]。因此,巯基的抑制作用是可逆竞争性抑制。

表4 化合物对SPAOX活力的影响

表5 金属离子对SPAOX活力的影响
此外,碘乙酸可以使SPAOX可逆失活[40]。炔醇底物使SPAOX不可逆失活,炔醇氧化后产物醛的羟基再与SPAOX的活性中心发生亲电结合,使底物醇不能与SPAOX结合,所以炔醇底物是自杀性底物[2]。此外,底物和产物对SPAOX的稳定性也有影响。在没有过氧化氢酶存在的情况下,SPAOX会被大量产生的过氧化氢可逆抑制[4]。过氧化氢将SPAOX活性中心的巯基可逆氧化。加入巯基乙醇或二硫苏糖醇等还原剂可使SPAOX活性恢复[42]。
2.3 SPAOX的稳定性
SPAOX稳定性的相关研究一直受到广泛关注。将SPAOX储存于4 ℃可保持活性数周至数月[8],储存于-20或-80 ℃可保持活性数年[24]。虽然低温保存对活性的影响较小,但反复冻融会使SPAOX快速失活[29]。Basidiomycota的SPAOX可在0.05 mol/L的磷酸缓冲液中保持至少5个月活性[1]。添加500 g/L蔗糖可使Pichiaputida的SPAOX的稳定性提高10倍,在300~500 g/L蔗糖、-20或-80 ℃下SPAOX活性可保持数年[43]。固定化技术可显著提高SPAOX的活性范围,有利于酶保持稳定性。ZHAO等[44]将SPAOX固定在静电纺丝纤维上后,由于纤维表面的生物相容性和亲水性使得最适温度提高至50 ℃,最适pH范围扩大至6.5~7.5,在40 ℃孵育2 h后SPAOX活性仅降低10%。CHUNG等[45]将SPAOX固定在活性纤维素载体上,SPAOX的最适温度提高至65 ℃,在80 ℃仍有25%活性,pH范围扩大至4~10,并在25 ℃下保持稳定10周以上。KJELLANDER等[26]将SPAOX固定在多孔纳米氧化铝上后,室温下反应50 h后仍能保持50%以上的活性。稳定性在SPAOX作为传感器元件中也发挥了重要作用,固定在含有聚中性红(poly neutral red,PNR)介质的碳膜电极上的SPAOX作为传感器,使用2周后传感器的灵敏度下降0.8%,在pH 7、0.1 mol/L磷酸缓冲液中4 ℃保存6周后,传感器的灵敏度仅下降12%[46]。
3 SPAOX的应用
SPAOX的底物广泛、反应的不可逆性和辅因子循环使用的优势使得SPAOX已经在多个方面成功应用。图2从SPAOX的催化机制出发总结了SPAOX的主要应用场景,例如基于固定化SPAOX构建的生物反应器用于醇醛类物质分析检测、醇醛物质的生物转化、生物修复方面的醛类物质降解等。

图2 SPAOX的应用
3.1 醇类物质的分析检测
固定化的SPAOX常被用于食品中短链醇、醛的检测。根据检测技术分类,可分为光学方法和电化学方法。
光学分析方法基于SPAOX和辣根过氧化物酶(horseradish peroxidase,HRP)耦合,氧化显色物质发生显色反应,进而测定吸光度的变化分析目的物的含量。例如SPAOX、HRP和显色剂混合于两层滤纸之间构成酒精检测试纸,可以快速检测血液或唾液乙醇,其检测范围达10~1 200 mg/L[47]。将二茂铁包埋的SPAOX和包覆HRP的溶胶-凝胶壳聚糖膜逐层固定在多壁碳纳米管(Multi-walled carbon nanotube,MWCNT)修饰的玻碳电极上,制成检测乙醇的生物传感器[48],其检测范围达5~3 000 μmol/L。此外,AHMAD等[49]报道了将SPAOX包埋在含有尼罗蓝(Nile blue chromoionophore,NBCM)的聚丙烯酸酯薄膜上,用于甲醛检测。其原理为SPAOX与甲醛反应的产物甲酸提供的氢离子与NBCM发生离子转移反应,生成深蓝色络合物HNBCM+,进而通过吸光度的变化分析甲醛的含量,其检测范围达10-3~103mmol/L。基于显色分析的方法操作简单、高效,线性的准确度高,但存在重复性较差的缺点。
电化学分析基于溶解氧含量的测定。例如将SPAOX与纳米金颗粒结合,氧化醇生成的H2O2将苯胺氧化聚合成聚苯胺(polyaniline,PANI),再将PANI包裹的SPAOX-AuNPs组装在玻碳电极上,所制备的生物传感器可用于醇的分析检测,检测范围达10~4 700 μmmol/L[50]。此外,电化学分析方法也可以测定H2O2分解而产生的电流。例如,将SPAOX固定在以氯化高铁血红素和金纳米粒子(CF-H-Au)修饰的碳微纤维而制备成纳米酶,其对H2O2的亲和力比溶液中的氯化血红素高2.6倍,对乙醇的检出限为5 μmol/L,检测范围达0.01~0.15 mmol/L[51]。HOODA等[52]将SPAOX共价固定在聚氯乙烯烧杯上,同时将HRP、Nafion、MWCNT、壳聚糖和金纳米颗粒固定在电极上,检测乙醇的范围为0.01~42 mmol/L。采用电化学分析方法,检测灵敏度高,重复性好,然而生物传感器的搭建较为复杂。
此外,还可以通过气体压力变化检测氧气。ZHANG等[53]将两亲性气凝胶结合Pd @ Pt核壳纳米颗粒,形成密封设备,乙醇经SPAOX和过氧化氢酶得到终产物氧气,通过便携式压力传感器来定量乙醇含量,检出限为0.5 mmol/L。该方法的样品制备和检测反应时间短,且不受醇类的干扰,也为乙醇检测提供了一种新的信号转导途径。
3.2 醇醛物质的生物转化
SPAOX可用于生产甲醛、H2O2、复杂有机物的中间产物[54]。例如,DIENYS等[55]将SPAOX固定在戊二醛活化后的大孔纤维素载体上,用于合成杂环化合物。SPAOX固定在纳米多孔氧化铝膜上,生产H2O2的生产效率远高于葡萄糖氧化酶[26]。为了克服SPAOX稳定性差的问题,MANGKORN等[56]将SPAOX固定在钡铁氧体磁性微粒(BaFe12O19)上不仅提高了SPAOX的热稳定性和催化效率,并且可以固定化SPAOX,在合成醛方面具有良好的工业应用前景。
3.3 环境修复
SPAOX固定于海藻酸钙凝胶中,开发了用于检测或生物修复空气中甲醛的连续生物反应器,能清除90%以上甲醛[57]。DAS等[58]将SPAOX用于燃料电池,链接漆酶,从甲醇基质中发电,用于环境修复中。SPAOX以新颖的生物发电的方式用于环境修复中,开发了SPAOX更大的应用价值。
4 展望
SPAOX的结构和催化原理已经明晰。SPAOX也被成功固定化和应用。但是相对较低的底物亲和力和较差的稳定性限制了SPAOX的应用。未来可以从3个方面克服SPAOX的不足,提高SPAOX在应用中的催化效率和便捷性:
(1)提高SPAOX对特定底物的亲和力。SPAOX氨基酸序列的突变是提高其底物亲和力的有效措施[25]。部分SPAOX由于来自特定物种或是经过改造可以有不同的最适底物,如甘油[10]。着重研究SPAOX的序列及结构,尤其针对底物结合口袋,找到改变底物特异性的关键残基,有利于改变底物结合口袋,控制SPAOX的最适底物,有助于检测应用和特定化合物的生产。
(2)提高SPAOX的环境稳定性。来自O.angusta、A.ochraceus、T.aurantiacusNBRC 31693的SPAOX有较好的pH和热稳定性[4,30,34]。对这些SPAOX的序列进行研究,有利于在后续进一步提高SPAOX的稳定性,使SPAOX在实际检测应用中的损耗更低,重复性更高。研究不同环境条件对SPAOX活性的影响,从氨基酸序列和蛋白质结构2方面分析环境对SPAOX影响的原因,找到更加合适的反应条件,提高SPAOX的反应速率,使其在生产应用中的生物转化效率更高,产量更大。
(3)开发不同的定量方法,以及将生物转化应用于更多领域。优化传统的光学或电化学分析检测定量方法,并开发诸如气体压力检测等非传统的定量方法,使SPAOX可以在不同应用场景中对短链伯醇类物质进行检测。SPAOX循环利用辅酶FAD的特点,可以在各种场景中随时、长时间反应,使其不仅可以用于生产,还可用于环境修复、生物发电等更多领域,提高了SPAOX的应用价值。