反应条件对葡萄糖-甘氨酸美拉德反应体系中糠醛类化合物形成的影响
李玉真
(1.乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院,上海 200436;2.江南大学食品营养与安全协同创新中心,江苏无锡 214122)
糠醛类化合物是一类含有呋喃环的小分子化合物。食品中常见的糠醛类化合物主要有5-羟甲基糠醛(5-Hydroxymethylfurfural,HMF)、2-糠 醛(2-Furfural,F)、2-呋喃甲基酮(2-Furyl-methyl ketone,FMC)和5-甲基糠醛(5-Methyl-2-furfural,MF)等。有研究表明,HMF 具有致癌性、致突变性、器官毒性和遗传毒性等潜在危害[1−4];F 具有较大的潜在遗传毒性和生殖毒性,被世界卫生组织国际癌症研究机构列为第三类致癌物质[5];MF 和F 曾被报道通过与细胞DNA 反应具有诱变特性[6]。虽然糠醛类化合物具有潜在的毒性,但是限量范围内作为食品添加剂使用还是安全的。我国《食品添加剂使用标准》(GB 2760-2014)指出,F 和MF 允许作为食品用香料使用;美国环境保护署规定平均体重为70 kg 的人,每日摄入F 的最大值为0.2 mg[7];欧盟食品安全局给出每人每日摄入HMF 最大参考值为1.6 mg;联邦风险评估研究所指出HMF 的允许摄入量为4~30 mg/人/日[1]。因此,食品中糠醛类化合物的含量及影响因素的研究广受关注。
糠醛类化合物广泛存在于咖啡、果汁、牛奶、蜂蜜、面包、干果、醋等多种热加工食品中,鲜少被发现存在于新鲜和未加工的食品中[8−12]。研究发现,糠醛类化合物易产生于食品热处理或长期储存过程中,主要是由碳水化合物在酸性条件下脱水形成,或在美拉德反应过程中产生[13−14]。美拉德反应是氨基化合物和羰基化合物之间发生的非酶褐变反应,在含有糖和蛋白质的食品中广泛存在。糠醛类化合物是与食品新鲜度和质量有关的识别参数,常被用来评价加工方法的质量和最终产品的感官特性[9]。糠醛类化合物的生成量受到体系pH、加热温度以及糖和氨基酸的种类和浓度的影响[15−23]。温度对美拉德反应具有很大的影响,温度越高其反应速率越快,HMF 的生成量也随着反应温度的增加明显增多,甚至呈指数增长[24−26]。Zhang 等[27]研究发现,随着烘烤温度和时间的增加,海绵蛋糕中HMF 和F 的生成量逐渐增加。本课题组[28]前期的研究也证实,较高的处理温度,可激发牛奶中产生更多的HMF 和F,它们在各种牛奶中的含量对比为:超高温灭菌奶(135~150 ℃,2~4 s)>超高压巴氏杀菌奶(115~121 ℃,2~4 s)>高温短时巴氏杀菌奶(72~75 ℃,10~15 s)。
为了研究美拉德反应体系中糠醛类化合物的形成规律,探究反应条件对其生成量的影响,科研人员主要采用还原糖和氨基酸反应体系进行研究。目前,大部分研究主要关注HMF 的生成。Zhang 等[18]选用葡萄糖、蔗糖和半胱氨酸、谷氨酸、亮氨酸建立了6 种糖-氨基酸模型,研究发现,随着糖和氨基酸(除半胱氨酸外)含量、温度和反应时间的增加,HMF 的生成量增加;低pH 可以促进HMF 的形成;HMF 的形成在葡萄糖-半胱氨酸/谷氨酸/亮氨酸和蔗糖-亮氨酸模型中符合一级动力学模型,在蔗糖-谷氨酸模型中符合零级动力学模型。曾世通等[29]研究了葡萄糖-丙氨酸美拉德反应体系中HMF 的形成,发现HMF的生成量随着pH 增加而减少,随着加热时间的延长而逐渐增加,在12 h 时达到最大值。卢键媚等[22]基于果糖/蔗糖/葡萄糖-柠檬酸反应体系,研究发现pH降低和温度升高可促进HMF 的形成,70~100 ℃时,HMF 的形成符合零级动力学模型。王丹等[30]采用木糖、果糖、葡萄糖和赖氨酸分别构建了3 种焦糖化和3 种美拉德反应体系,在120 ℃油浴锅中分别加热10~120 min 进行研究,发现随着加热时间延长,两种体系中HMF 的含量均逐渐升高,但F 仅在焦糖化体系中生成(尤其是木糖体系),在三种美拉德反应体系中均未被检出。
本研究以食品中广泛存在的葡萄糖和常用添加剂甘氨酸(结构最为简单的天然氨基酸)构成的美拉德反应体系为研究模型,采用高效液相色谱法测定糠醛类化合物(主要包括HMF、F 和MF)的生成量,研究葡萄糖与甘氨酸的初始摩尔浓度比、体系初始pH、加热温度和加热时间等对美拉德反应体系中糠醛类化合物生成量的影响,并预测它们的形成动力学。本研究有望为控制热加工食品中糠醛类化合物的含量提供理论基础。
1 材料与方法
1.1 材料与仪器
HMF(纯度98%,色谱纯)、F(纯度99.5%,色谱纯)、FMC(纯度95.5%,色谱纯)、MF(纯度99.6%,色谱纯)德国Dr.Ehrenstorfer 公司;葡萄糖、甘氨酸、磷酸二氢钠、磷酸氢二钠 分析纯,国药集团化学试剂有限公司。
AL104 电子天平、PE28-Standard pH 计梅特勒-托利多仪器(上海)有限公司;SBH200D 恒温金属浴 英国比比科技有限公司;Milli-Q 超纯水仪 默克化工技术(上海)有限公司;1200 高效液相色谱仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 葡萄糖-甘氨酸反应体系的构建 将葡萄糖、甘氨酸配制成0.2 mol/L 的溶液,准确移取4 mL 溶液置于15 mL 耐高温的玻璃管中,拧紧盖子密封,金属浴加热进行美拉德反应,反应后取出置于冰水浴中迅速冷却至室温(25 ℃)。
1.2.2 原料配比对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的影响 以pH 为7 的磷酸盐缓冲溶液为溶剂,配制葡萄糖与甘氨酸的添加比例(摩尔浓度比)分别为1:4、1:3、1:2、1:1、2:1、3:1 和4:1的溶液,加热温度为90 ℃,加热时间为3 h,进行美拉德反应并检测反应液中HMF、F 和MF 的含量,每组实验重复3 次。
1.2.3 体系初始pH 对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的影响 分别精确称取一定质量的Na2HPO4和NaH2PO4,用去离子水配制成0.2 mol/L的溶液,将二者按一定比例混合,并用少量1 mol/L HCl 或NaOH 调整pH 为 3、5、7、9 和11,即得准确配制的不同pH 的磷酸盐缓冲溶液。以其为溶剂,将葡萄糖和甘氨酸按照物质的量比1:1 配制成0.2 mol/L的混合溶液,加热温度为110 ℃,加热时间为5 h,进行美拉德反应并检测反应液中HMF、F 和MF 的含量,每组实验重复3 次。
1.2.4 加热时间对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的影响 加热时间分别为1、2、3、4、5 和6 h,加热温度为90 ℃,葡萄糖和甘氨酸的物质的量之比为1:1,进行美拉德反应并检测反应液中HMF、F 和MF 的含量,每组实验重复3 次。
1.2.5 加热温度对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的影响 加热温度分别为70、90、110和130 ℃,加热3 h,葡萄糖和甘氨酸的物质的量之比为1:1,进行美拉德反应并检测反应液中HMF、F 和MF 的含量,每组实验重复3 次。
1.2.6 糠醛类化合物含量的测定 采用高效液相色谱法(HPLC)[28]测定样品中的HMF、F 和MF 的含量,具体液相色谱条件如下:
色谱柱:Waters Atlantis T3 柱(3.0 mm×15 cm,3 μm);流动相A 为超纯水,流动相B 为乙腈;0~18.0 min,5%~65% B;18.0~20.0 min,65%~95% B;20.0~22.0 min,95% B;22.0~22.1 min,95%~5% B;22.1~30.0 min,5% B;流速:0.6 mL/min;色谱柱温度:30 ℃;进样量:5 μL;紫外-可见检测器检测波长:280 nm。
采用外标一点法计算了样品中的糠醛类化合物含量,详细的检测结果计算方法见参考文献[28]。
1.3 数据处理
采用零级动力学和一级动力学两种动力学模型对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的变化规律进行分析,公式如下:
式中,Ct:检测指标在任意时间的浓度值(μmol/L);C0:检测指标的起始浓度值(μmol/L);t:美拉德反应时间(h);k0和k1:零级和一级动力学常数,单位分别为μmol/(L·h)和h−1。
式中,k 为动力学常数;A 为指前因子,也称为Arrhenius 常数,单位与k 相同;Ea为表观活化能,单位为kJ/mol,通常来说,Ea越小,反应越容易进行;R 为摩尔气体常数,8.314 J/(mol·K);T 为绝对温度,单位为K。
将ln k 对1/T 作图,当其近似为一条直线时,由该直线的斜率和截距即可得到指前因子A 和表观活化能Ea。
模型拟合度的评价指标:回归系数(R2)、精确因子(Af)、偏差因子(Bf)和均方根误差(RMSE)等参数通常用作模型的定量评价指标[31−32]。Af、Bf和R2的值越接近1,模型拟合得越好。
精确因子(Af):用于评价预测值与实测值之间的偏离度,其计算公式为:
偏差因子(Bf):用于判断实测值与预测值之间的大小关系,是过大预测(Bf>1)、过小预测(Bf<1)还是精确预测(Bf=1),其计算公式为:
2 结果与分析
2.1 糠醛类化合物的高效液相色谱分析
标准品和美拉德反应样品中糠醛类化合物的HPLC 分析如图1 所示,其中,以pH3,加热温度为130 ℃,加热5 h 条件下得到的美拉德反应样品为例。可以看出,四种糠醛类化合物HMF、F、FMC 和MF 能够很好地被分开,说明选定的HPLC 测定条件能够很好地测定美拉德反应样品中的糠醛类化合物。本课题组采用该HPLC 分析方法已成功对多种样品中糠醛类化合物进行了检测研究[28,33−34]。

图1 美拉德反应样品(A)和标准品(B)中糠醛类化合物的高效液相色谱图Fig.1 Chromatograms of furfural compounds in Maillard reaction samples (A) and standards (B)
本研究葡萄糖-甘氨酸模拟体系样品中很少能检测到FMC,因此,本研究主要针对HMF、F 和MF进行测定。
2.2 原料配比对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的影响
反应体系pH 为7,90 ℃加热3 h,葡萄糖和甘氨酸的添加比例对糠醛类化合物生成量的影响如图2 所示,随着葡萄糖和甘氨酸的摩尔浓度比由1:4 增加到1:1,HMF、F 和MF 的生成量均逐渐增大,其中HMF 的增速最大,当葡萄糖和甘氨酸的添加比例由1:1 增加到4:1 时,F 和MF 的生成量则逐渐减小,而HMF 的生成量继续增大,但增速趋缓,这说明葡萄糖含量的增加有利于HMF 的生成。有报道指出单一糖溶液模拟体系在加热时,也可以经由焦糖化途径生成HMF[18,35],本文的研究结果也恰好证明了这一点。当葡萄糖和甘氨酸的添加摩尔浓度比为1:1 时,F 和MF 的生成量最大,HMF 的生成量虽未达到最大值,但据文献报道,葡萄糖和甘氨酸通过美拉德反应生成HMF 的分子个数之比为1:1[36−37],因此,后续关于反应条件对美拉德反应体系中糠醛类化合物形成的研究,选择葡萄糖和甘氨酸的添加摩尔浓度比为1:1。

图2 葡萄糖与甘氨酸配比对模拟体系中糠醛类化合物生成量的影响Fig.2 Effect of concentration ratio of glucose to glycine on the formation of furfural compounds in model system
2.3 体系初始pH 对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的影响
由于在90 ℃,加热3 h 条件下,当pH>7 时,未检测到HMF、F 和MF,无法实现对较宽pH 范围(pH3~11)的研究。故选择在110 ℃,加热5 h 条件下,研究体系不同初始pH 对葡萄糖-甘氨酸美拉德反应体系中糠醛类化合物生成量的影响。由图3 中可以看出,随着体系初始pH 从3 增加到7,反应体系中HMF 的生成量急剧减小,从1431.64 μmol/L迅速减少到34.84 μmol/L;当体系初始pH 从7 增加到11 时,反应体系中HMF 的含量呈平缓减少趋势。说明酸性环境更有利于HMF 的生成,这与文献报道的葡萄糖-丙氨酸、蔗糖-半胱氨酸、蔗糖-谷氨酸、蔗糖-亮氨酸等美拉德反应体系中HMF 生成量随体系初始pH 的变化趋势基本一致[18,29]。其原因可能是:反应体系pH 的降低促进了葡萄糖发生烯醇化反应生成3-脱氧葡萄糖醛酮,并进一步降解形成HMF[38−39]。

图3 体系初始pH 对模拟体系中糠醛类化合物生成量的影响Fig.3 Effect of the initial pH on the formation of furfural compounds in model system
模拟体系中F 的生成量随着体系初始pH 从3 增加到7 而逐渐增大,当pH 从7 增加到11,F 的生成量虽有增加,但增幅不大,说明在110 ℃时,中性和碱性环境有利于F 的生成,而酸性环境不利于F 的生成。MF 的生成量在pH 为5 时达到最大值。
总体而言,当加热温度110 ℃,加热5 h 时,初始pH<7 时,HMF 的生成量最多;初始pH≥7 时,三种糠醛类化合物中F 的生成量最多;HMF、F 和MF的总生成量随着pH 的增加而迅速减少,并有趋于平衡的趋势。因此,在实际生产过程中,可通过适当提高反应体系pH 来抑制糠醛类化合物的形成。
2.4 加热时间对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的影响
在90 ℃,体系初始pH 为7 的条件下,不同加热时间对葡萄糖-甘氨酸美拉德反应模拟体系中糠醛类化合物的影响如图4 所示。从图中可以看出,随着加热时间的延长,葡萄糖-甘氨酸美拉德反应模拟体系中HMF、F 和MF 的生成量均逐渐升高,这与已有文献报道葡萄糖-丙氨酸和葡萄糖/蔗糖-半胱氨酸/谷氨酸/亮氨酸美拉德反应体系中HMF 的生成量随加热时间的变化趋势一致[18,29]。在加热1~6 h 的过程中,HMF 的生成量由0.36 μmol/L 增加至2.93 μmol/L;F 的生成量由1.23 μmol/L 增加至30.80 μmol/L;MF 的生成量由0.12 μmol/L 增加至2.78 μmol/L。HMF 的生成量与加热时间之间呈现出指数增加的关系,所得拟合方程为ln C(t)=0.4139 t+ln 0.2903(R2=0.9501),符合一级反应动力学模型;F 的生成量与加热时间之间成线性关系,得到的线性拟合方程为C(t)=5.7972 t–5.1545(R2=0.9882),符合零级反应动力学模型;MF 的生成量与加热时间之间也成线性关系,拟合方程为C(t)=0.5466 t–0.6242(R2=0.9793),符合零级反应动力学模型。
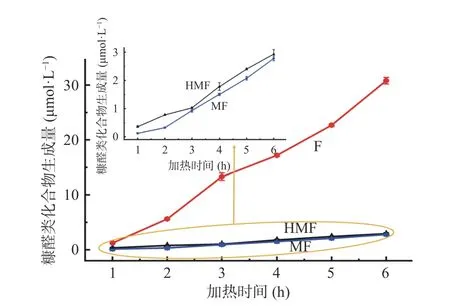
图4 加热时间对模拟体系中糠醛类化合物生成量的影响Fig.4 Effect of heating time on the formation of furfural compounds in model system
2.5 加热温度对葡萄糖-甘氨酸模拟体系中糠醛类化合物生成量的影响
在缓冲溶液初始pH 为7,加热3 h 的条件下,不同加热温度对葡萄糖-甘氨酸美拉德反应模拟体系中糠醛类化合物生成量的影响如图5 所示。整体而言,温度明显影响反应体系中糠醛类化合物HMF、F 和MF 的形成,温度越高,它们的生成量越大。其中,70 ℃时,未检测到MF,F(0.12 μmol/L)的生成量大于HMF(0.08 μmol/L);90 ℃和110 ℃,F 的生成量分别为13.32 μmol/L 和61.37 μmol/L,HMF 的生成量分别为1.03 μmol/L 和17.30 μmol/L,MF 的生成量分别为0.93 μmol/L 和21.33 μmol/L,可见,F 的生成量明显大于HMF 和MF;但是,当温度升高到130 ℃时,HMF 的生成量明显增加至163.01 μmol/L,大大超过了F(94.77 μmol/L)和MF(76.19 μmol/L)。多项研究表明,高温下HMF 的形成速度明显提高[24−27],Zhang 等[18]关于六种糖-氨基酸美拉德反应模型中HMF 生成动力学研究也证实,在所研究糖-氨基酸模型中,HMF 的生成量均随温度的增加而升高。温度提高对糠醛类化合物形成的促进作用主要体现在两个方面:a.温度的提升可以促进葡萄糖的开环,而开链糖的浓度是决定反应速率的一个关键因素[40];b.高温可以促进葡萄糖烯醇化并进一步脱水形成HMF[41−42]。
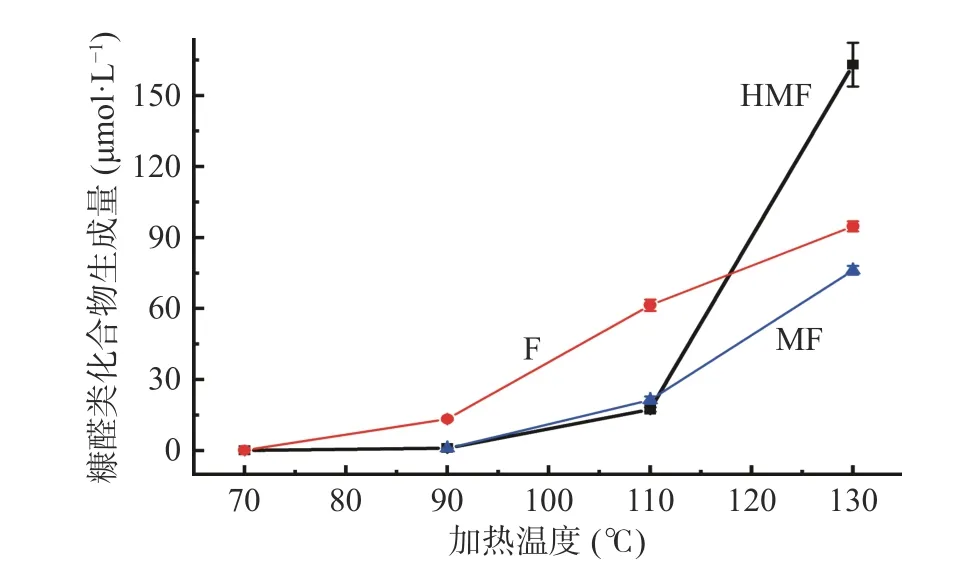
图5 加热温度对模拟体系中糠醛类化合物生成量的影响Fig.5 Effect of heating temperature on the formation of furfural compounds in model system
结合2.3 部分中初始pH 对模拟体系中糠醛类化合物生成量的影响,可以看出,酸性和高温有利于HMF 的生成。因此,在实际生产过程中,可通过适当提高反应体系pH 和降低反应体系温度来抑制糠醛类化合物的形成。
2.6 葡萄糖-甘氨酸模拟体系加热过程中糠醛类化合物的形成动力学分析
为了研究模拟体系中糠醛类化合物的形成动力学,考察了缓冲溶液pH 为7 时,葡萄糖和甘氨酸的摩尔浓度均为0.2 mol/L 时,不同温度、不同加热时间时,葡萄糖-甘氨酸美拉德反应模拟体系中糠醛类化合物的生成量。随着加热时间的增加、加热温度的升高,糠醛类化合物(HMF、F 和MF)生成量的变化如图6~图8 所示。葡萄糖-甘氨酸模拟体系中糠醛类化合物的形成动力学分析见表1~表3。可以看出,糠醛类化合物HMF、F 和FMC 的生成量均随着反应时间的增加而增加,随着反应温度的升高而增加,温度越高,糠醛类化合物的增加量越显著;随着加热温度从70 ℃升高到130 ℃、加热时间从1 h 增加到6 h,HMF 和F 的生成量由10−2量级增加到102量级(单位为μmol/L),MF 的生成量从无法检出增加到139.67 μmol/L,可见加热温度和加热时间对糠醛类化合物生成量的影响非常大,尤其是反应温度的影响更为显著,原因在于较高的反应温度使烯醇缩合反应和相关的水解、脱水反应均比较容易进行[42−43]。因此,建立糠醛类化合物随温度和时间变化的动力学方程尤为重要。

表1 模拟体系中HMF 的形成动力学分析Table 1 Kinetic analysis of HMF formation in model system

图6 加热温度和时间对模拟体系中HMF 生成量的影响Fig.6 Effect of heating temperature and time on the formation of HMF in model system
加热温度和时间对模拟体系中HMF 生成量的影响如图6 所示,HMF 的形成动力学分析如表1 所示。经过分析可以发现,当加热温度为70~110 ℃时,随着加热时间从1 h 增加到6 h,葡萄糖-甘氨酸模拟体系中HMF 的生成量与加热时间呈指数增加的关系,符合一级动力学模型,计算得出,模拟体系中生成HMF 的表观活化能Ea为38.10 kJ/mol。但在温度为130 ℃时,HMF 生成量的指数拟合并不理想(R2=0.7852),更倾向于符合零级动力学模型(R2=0.9764)。文献报道[18],在90~110 ℃时,葡萄糖-半胱氨酸、葡萄糖-谷氨酸、葡萄糖-亮氨酸等美拉德模拟体系中HMF 的形成均符合一级动力学模型。再结合本文的研究结果,可以看出,在大多数葡萄糖-氨基酸模拟体系中,HMF 的形成在反应温度低于110 ℃时,符合一级动力学模型。
加热温度和时间对模拟体系中F 生成量的影响如图7 所示,F 的形成动力学分析如表2 所示。当加热温度为70 ℃时,随着加热时间从1 h 增加到6 h,葡萄糖-甘氨酸模拟体系中F 的生成量与加热时间之间呈指数增加的关系,符合一级动力学模型(R2=0.9839)。但是,当加热温度为90~130 ℃时,F 的生成量与加热时间呈线性关系,符合零级动力学模型(R2=0.9336~0.9882),计算得出F 生成量的表观活化能为45.21 kJ/mol。目前,尚未见有关于F 的形成动力学的文献报道。
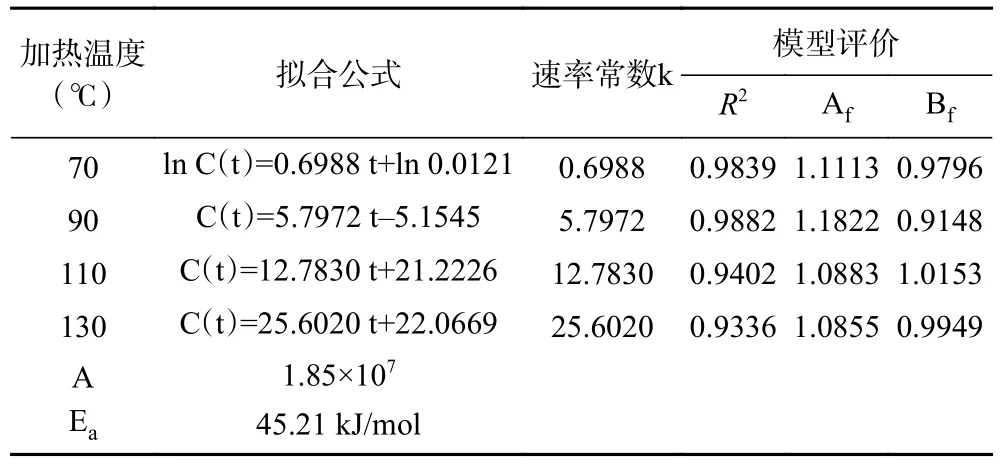
表2 模拟体系中F 的形成动力学分析Table 2 Kinetic analysis of F formation in model system

图7 加热温度和时间对模拟体系中F 生成量的影响Fig.7 Effect of heating temperature and time on the formation of F in model system
加热温度和时间对模拟体系中MF 生成量的影响如图8 所示,MF 的形成动力学分析如表3 所示。当加热温度为70 ℃时,葡萄糖-甘氨酸模拟体系中MF 的含量未检出。当加热温度为90~130 ℃时,随着加热时间从1 h 增加到6 h,葡萄糖-甘氨酸模拟体系中MF 的生成量与加热时间呈线性关系,符合零级动力学模型,计算得出MF 生成量的表观活化能为56.58 kJ/mol。目前,尚未见有关于MF 的形成动力学的文献报道。

表3 模拟体系中MF 的形成动力学分析Table 3 Kinetic analysis of MF formation in model system
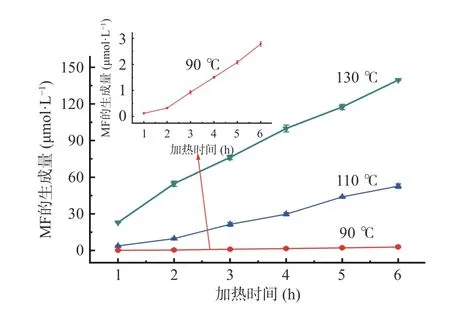
图8 加热温度和时间对模拟体系中MF 生成量的影响Fig.8 Effect of heating temperature and time on the formation of MF in model system
HMF、F 和MF 三种糠醛类化合物表观活化能的大小顺序为Ea,HMF 本研究以葡萄糖-甘氨酸模型为研究对象,探究了葡萄糖与甘氨酸的摩尔浓度比、体系初始pH、加热时间和加热温度等因素对糠醛类化合物生成量的影响规律,并对HMF、F 和MF 的形成动力学进行了分析。结果表明,葡萄糖的添加量对糠醛类化合物生成量的影响大于甘氨酸的添加量,葡萄糖含量越高,HMF 的生成量越多;酸性pH 条件有利于HMF的形成,中性和碱性pH 条件有利于F 的形成;随着加热时间的延长、加热温度的增加,HMF、F 和MF的生成量均逐渐增加,其中,温度的影响更为明显。这些结论表明,在实际生成过程中,可通过适当减少糖添加量、提高反应体系pH、降低反应体系温度、缩短反应时间等方式来抑制热加工食品中糠醛类化合物的形成。对HMF、F 和MF 形成动力学方程的模拟,可为预测不同反应时间、温度时糠醛类化合物的生成量提供参考。但是本研究对糠醛类化合物生成机理的研究不足,尤其是HMF、F、MF 三者之间是否存在相互转化,转化机理如何等还有待进一步探讨。3 结论

