抗MDA5抗体阳性皮肌炎合并自发性腹膜外出血2例
来娜琳,孟德芳,魏华
抗MDA5抗体阳性皮肌炎合并自发性腹膜外出血2例
来娜琳,孟德芳,魏华
江苏省苏北人民医院风湿免疫科,江苏扬州 225000
自发性腹膜外出血(spontaneous extraperitoneal hemorrhage,SEH)是一种极罕见的、不易识别的、死亡率极高的皮肌炎并发症。本文报道2例抗黑色素瘤分化相关基因5抗体阳性皮肌炎合并SEH患者的诊疗经过,并探讨其可能的发生机制,以提高临床医生对此疾病的认识。
皮肌炎;抗黑色素瘤分化相关基因5抗体;自发性腹膜外出血;血管炎
1 病例资料
病例1:患者,男,64岁,因“咳嗽、咳痰伴气喘2个月余,加重5d”入院。患者2021年2月无明显诱因出现咳嗽、咳痰伴气喘,渐加重,就诊于盐城市某医院,行胸部CT提示双肺散在炎症,实验室检查示肌酸激酶升高,抗Ro-52抗体阳性,考虑诊断为皮肌炎、间质性肺炎,予甲泼尼龙、环孢素治疗,病情好转后出院。院外规律口服泼尼松,早30mg、晚5mg,环孢素75mg/次,2次/d。5d前再次出现咳嗽、咳痰加重,咳白色泡沫样痰,易咳出,为求进一步诊治来我院就诊。患者既往体健,无吸烟、饮酒史,否认家族史。查体:眶周、颜面部可见紫红色水肿样皮疹,双侧肘关节、双侧膝关节伸侧面可见暗红色皮疹。双肺呼吸音粗,可闻及少量Velcro啰音。四肢肌力、肌张力正常。患者入院后查血:红细胞计数4.23×1012/L、血红蛋白129g/L、白细胞计数3.41×109/L、血小板计数65×109/L、白蛋白21.80g/L、丙氨酸氨基转移酶150.00U/L、天门冬氨酸氨基转移酶213.00U/L、γ谷氨酰基转移酶287.00U/L、乳酸脱氢酶1049.00U/L、肌酸激酶224.00U/L;红细胞沉降率23mm/h;C反应蛋白12.51mg/L、凝血酶原时间11.90s、活化部分凝血活酶时间41.80s、D-二聚体1.14μg/ml、白细胞介素-6(interleukin-6,IL-6)26.9pg/ml、铁蛋白8338.00ng/ml、抗Ro-52抗体(+++)、抗核抗体1∶100,抗黑色素瘤分化相关基因5(melanoma differentiation-associated gene 5,MDA5)抗体免疫球蛋白G(immunoglobulin G,IgG)(+++),抗Ro-52抗体IgG(+++)。胸部CT提示两肺间质性炎症,见图1。正电子发射计算机体层显像无明显肿瘤证据。
入院后诊断:无肌病性皮肌炎(抗MDA5抗体阳性);间质性肺炎。予吸氧、心电、血氧监测,静脉输注甲泼尼龙40mg×4d、60mg×5d抗炎,口服他克莫司1mg/次、2次/d抑制免疫活动,头孢哌酮舒巴坦、氟康唑抗感染,辅以止咳化痰、雾化平喘、保肝降酶、预防骨质疏松等对症治疗。考虑患者抗体滴度高、铁蛋白显著升高,临床预后不良,予免疫吸附治疗,静脉注射丙种球蛋白10g×3d增强免疫,辅以低分子肝素钠抗凝。患者咳嗽、气喘症状有所缓解。入院第9天,第2次免疫吸附治疗后第2天夜间,患者诉左侧腰背部疼痛,完善腹部增强CT示左侧腰大肌区肿块性病变,向下延续至髂腰肌、髂肌及左侧髋关节,出血可能,其他待排,见图2。患者心率加快,血压下降,复查血红蛋白进行性下降,考虑出血性休克,请介入科、骨科、普外科联合诊疗,考虑手术过程复杂、风险极大,与患者家属交代病情后患方拒绝手术,停用抗凝药物,予止血、扩容、积极补充血浆及浓缩红细胞纠正凝血异常及贫血,患者低血容量性休克仍无法纠正,患者放弃治疗自动出院,院外患者死亡。
病例2:患者,女,54岁,因“全身散在皮疹伴咳嗽2个月余”入院。患者2022年1月无明显诱因出现面部、双手及双肘关节伸侧面、双大腿外侧散在红色皮疹,眼睑、双手水肿,伴全身乏力,咳嗽,咳黄褐色痰,活动后胸闷气喘,症状进行性加重,就诊于当地医院,查肝肾功能:丙氨酸氨基转移酶107.0U/L,天门冬氨酸氨基转移酶103.0U/L,乳酸脱氢酶288.8U/L;自身抗体:抗核抗体138U/ml,余项正常;胸部CT:两肺炎症,下叶较重。诊断考虑皮肌炎、间质性肺炎,予左氧氟沙星抗感染、雾化祛痰平喘、保肝等治疗后症状无明显改善,为求进一步诊治遂来我院。既往体健,无吸烟、饮酒史,否认类似家族病史。查体:双手掌指关节伸侧面、双肘关节Gottron征(+),双手掌面散在皮疹,出现角化,指腹末端可见浅表溃疡,见图3。大腿外侧散在红色皮疹伴鳞屑。双肺呼吸音粗,未闻及明显干湿啰音。入院后完善相关辅助检查:血常规未见明显异常;丙氨酸氨基转移酶32.00U/L、天门冬氨酸氨基转移酶119.00U/L、乳酸脱氢酶37.00U/L、肌酸激酶148.00U/L、凝血酶原时间11.90s、活化部分凝血活酶时间32.40s、D-二聚体0.73mg/L、红细胞沉降率3mm/h、C反应蛋白0.18mg/L、铁蛋白1461.00ng/ml、IL-6 86.52pg/ml;涎液化糖链抗原6 380.09U/ml、抗MDA5抗体IgG(+++)、抗Ro-52抗体IgG(+++),抗转录中介因子1γ抗体IgG(+)。肌电图:未提示肌源性损害。胸部CT:两下肺、左上肺舌段炎症。
入院诊断:无肌病性皮肌炎(抗MDA5抗体阳性);间质性肺炎;肺部感染。治疗予静脉输注甲泼尼龙40mg×2d、80mg×10d、60mg×5d,口服羟氯喹0.2g/次、2次/d,枸橼酸托法替布5mg/次、2次/d,静脉注射环磷酰胺累计0.6g,血浆置换3次,丙种球蛋白20g×3d,辅以抗感染、保肝、护胃、补钙、抗凝等治疗。患者双手皮疹明显消退,见图4。咳嗽、胸闷气喘症状缓解。患者入院第16天磕碰窗台后出现一过性右下腹疼痛,未告知,夜间再次出现疼痛,渐加重。完善腹部增强CT,提示右侧附件区囊性病灶(较大截面约127mm×77mm),右侧腹直肌局部肿胀,考虑脓肿可能,血肿待排,建议磁共振检查,见图5。复查血常规提示血红蛋白57g/L、白细胞计数11.24×109/L。请胃肠外科会诊后考虑右下腹囊性包块性质不明,出血可能?脓肿可能?转入胃肠外科行急诊手术剖腹探查。术中见右侧髂窝、盆腔、下腹壁壁层腹膜外一巨大血肿,肿块位于腹膜反折下方,大小约13cm×10cm,盆腔脏器受压,位移明显,盆腔内未见明显积血、腹水,余腹腔未见明显血肿。遂行腹膜外血肿清除术,手术过程顺利,术毕安返病房。
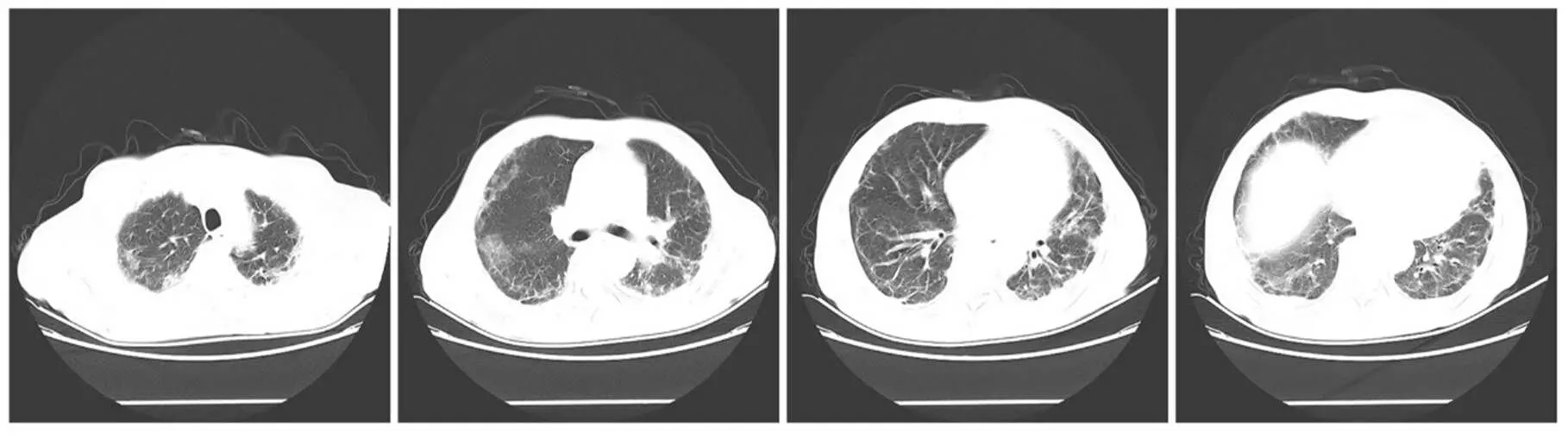
图1 病例1胸部CT示两肺间质性炎症
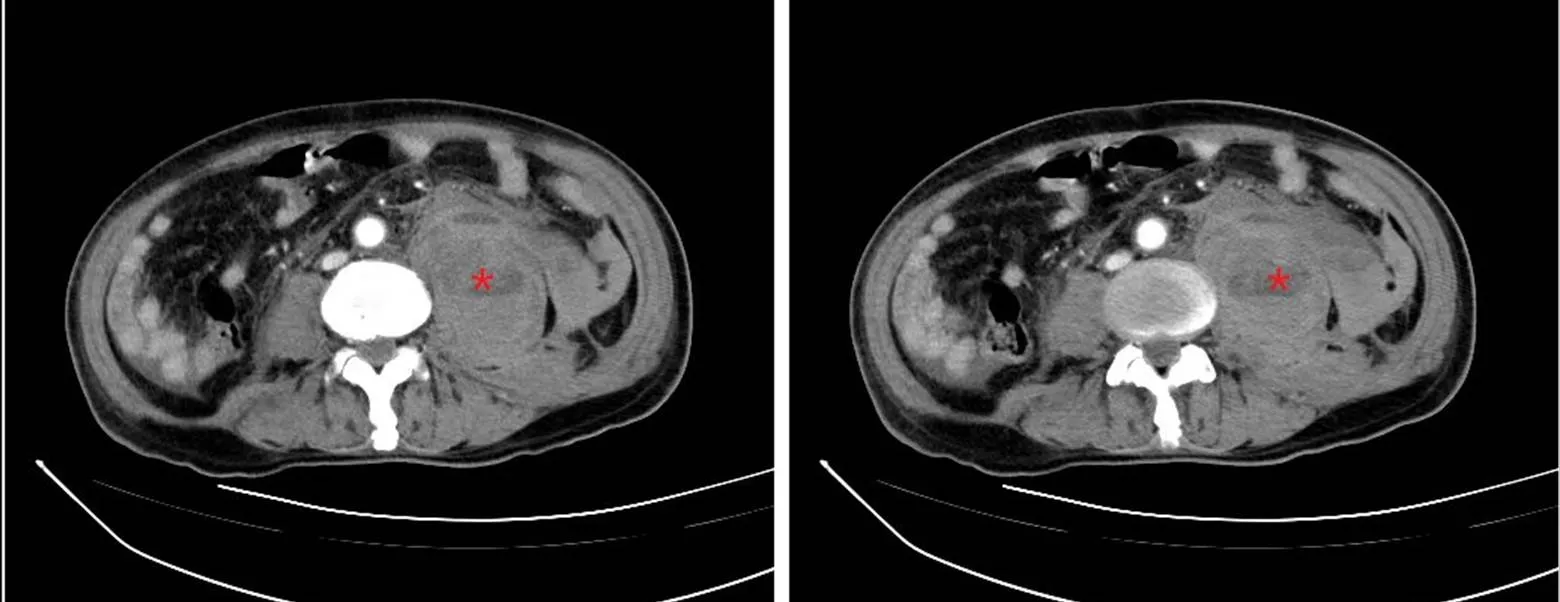
图2 病例1腹部增强CT示左侧腰大肌区肿块性病变

图3 病例2入院时双手皮疹
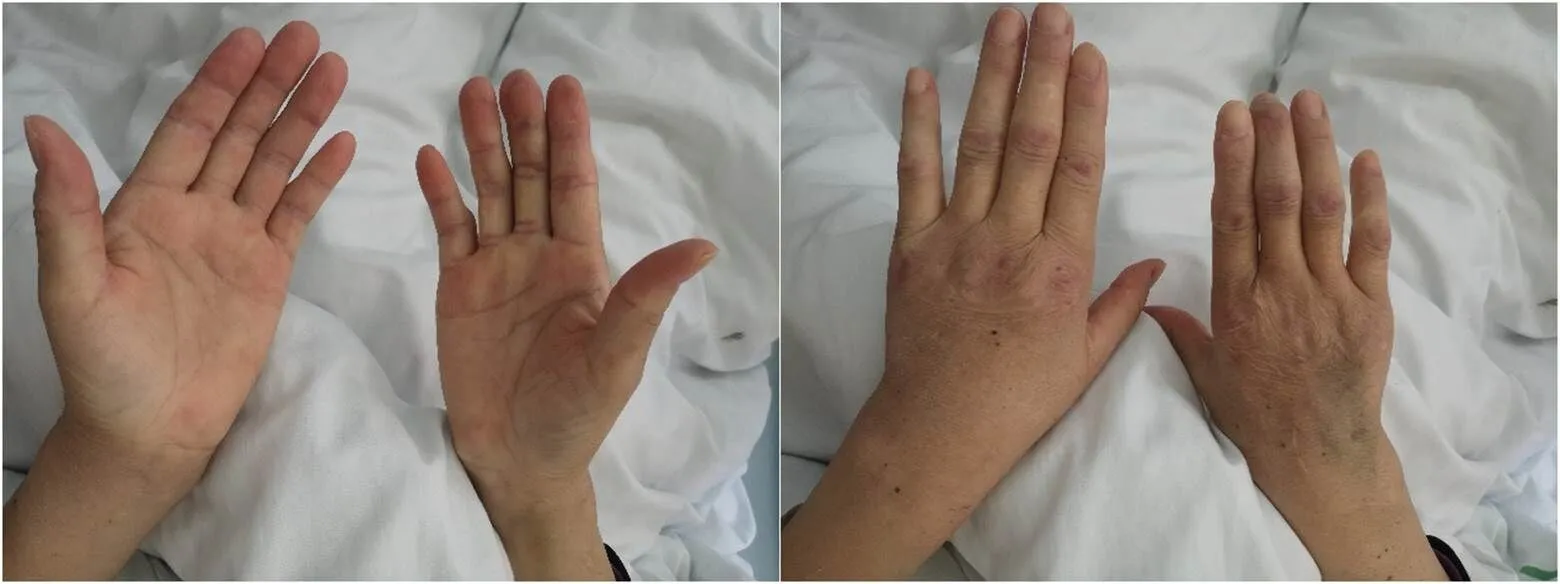
图4 病例2治疗后双手皮疹

图5 病例2腹部增强CT示右侧附件区囊性病灶
2 讨论
特发性炎症性肌病(idiopathic inflammatory myopathies,IIM)是一组少见的可累及肌肉、皮肤、肺脏等重要脏器的结缔组织病,包括皮肌炎、多肌炎、免疫性坏死性肌病、包涵体肌炎、抗合成酶综合征[1]。上述几组炎症性肌病在临床表现、预后、病理特征表现出明显的异质性,因此给诊断及治疗带来极大挑战。
典型皮肌炎是指有皮肌炎特征性皮损并伴有近端肌无力、肌炎的客观依据,皮肌炎有一种特殊亚型,即有特征性皮损,但在6个月内无肌肉受累的临床和实验室表现或仅有轻微实验室表现,被称为临床无肌病性皮肌炎(clinically amyopathic dermatomyositis,CADM)。抗MDA5抗体最早在CADM中发现[2];与抗MDA5抗体阴性的皮肌炎患者相比,抗MDA5抗体阳性的皮肌炎患者常有典型的皮肤病变、较轻的肌肉症状,急性间质性肺炎的发生率和死亡率更高,因呼吸衰竭的6个月死亡率高达33%~66%[3-4]。
相比于急性间质性肺炎,自发性腹膜外出血(spontaneous extraperitoneal hemorrhage,SEH)是一种极罕见的、不易识别的、死亡率极高的并发症。目前为止,皮肌炎相关的SEH发病机制尚不明确,总结既往报道[4-6]及本次报道的2例病例特点,考虑发生SEH的原因:①血管炎所致血管壁脆性增加。血管炎是皮肌炎的基本病理改变,尤其是抗MDA5抗体阳性皮肌炎患者的皮肤溃疡、口腔溃疡发生率较高,提示有较严重的血管病变[7-8]。研究发现抗MDA5抗体阳性皮肌炎患者血清中可溶性血管细胞黏附分子-1、内皮素-1及血管性血友病因子水平较健康人群或多肌炎患者升高,表明血管内皮功能障碍参与抗MDA5抗体阳性皮肌炎的发展[9]。本文报道的2例SEH患者均在疾病急性期内发病,既往报道的病例多数在起病6个月内出现腹膜外出血,因此,笔者认为全身小血管炎所致的血管壁脆性增加是引起SEH的主要原因,这也印证了Hanawa等[6]的推测。②糖皮质激素治疗所致血管脆性增加。虽然糖皮质激素的有效性还没有通过对照试验进行验证,但因其强大的抗炎作用,目前仍是治疗皮肌炎的一线用药[10]。轻中度活动期患者建议口服泼尼松,每日剂量0.5~1mg/kg,症状改善后逐渐减量至最小有效剂量。而对重症患者,如合并急性间质性肺炎、吞咽肌受累者,可予甲泼尼龙500~1000mg冲击治疗3d后改为口服泼尼松[11]。但糖皮质激素可导致毛细血管扩张、血管内皮细胞功能受损、伤口愈合延缓等不良反应,可增加血管脆性引起出血或出血后难以止血[12-13]。③抗凝药物的使用。研究显示抗凝药物的使用也可能是皮肌炎合并自发性出血的诱发因素。超过半数的患者在病程中接受抗凝治疗[4];而本文报道的2例患者因血浆置换、免疫吸附治疗,行深静脉置管,为预防静脉血栓形成予低分子肝素钠抗凝治疗。因此,预防性抗血栓治疗有引起SEH的潜在风险。
上述2例患者均为亚急性起病,以特征性皮疹和间质性肺炎为典型临床表现,辅助检查提示铁蛋白明显升高、抗MDA5抗体滴度高,均接受常规剂量糖皮质激素抗炎治疗、低分子肝素钠预防深静脉血栓,并在治疗过程中出现SEH。此2例患者诊断明确,具有皮肌炎预后不良因素,既往无基础病史及长期糖皮质激素、抗血栓药物服药史,其SEH更多考虑与免疫介导的血管炎症相关,而糖皮质激素和抗凝药物的使用可加重这一倾向。
SEH作为一种极罕见的皮肌炎并发症,死亡率极高,需引起临床医生的高度重视,并在诊疗过程中仔细评估各项诊疗措施的风险及收益,早期诊断、及时积极治疗有望避免不良结局的出现。但目前相关报道病例较少,其发病机制尚不明确,需进一步研究阐明,以为临床诊治提供依据及建议。
[1] MARIAMPILLAI K, GRANGER B, AMELIN D, et al. Development of a new classification system for idiopathic inflammatory myopathies based on clinical manifestations and myositis-specific autoantibodies[J]. JAMA Neurol, 2018, 75(12): 1528–1537.
[2] NOMBEL A, FABIEN N, COUTANT F. Dermatomyositis with anti-MDA5 antibodies: Bioclinical features, pathogenesis and emerging therapies[J]. Front Immunol, 2021, 12: 773352.
[3] SONTHEIMER R D. MDA5 autoantibody-Another indicator of clinical diversity in dermatomyositis[J]. Ann Transl Med, 2017, 5(7): 160.
[4] XU Z, LV X, XU W, et al. Spontaneous intramuscular hemorrhage in anti-MDA5 positive dermatomyositis: A case series and literature review[J]. Front Med (Lausanne), 2022, 8: 802753.
[5] LI FRAINE S, COMAN D, VALLÉE GUIGNARD V, et al. Spontaneous retroperitoneal hemorrhage in dermatomyositis[J]. Am J Med, 2021, 134(2): e137–e138.
[6] HANAWA F, INOZUME T, HARADA K, et al. A case of dermatomyositis accompanied by spontaneous intramuscular hemorrhage despite normal coagulability[J]. Rheumatol Int, 2013, 33(11): 2949–2950.
[7] TANSLEY S L, BETTERIDGE Z E, GUNAWARDENA H, et al. Anti-MDA5 autoantibodies in juvenile dermatomyositis identify a distinct clinical phenotype: A prospective cohort study[J]. Arthritis Res Ther, 2014, 16(4): R138.
[8] PENG Y, ZHANG S, ZHAO Y, et al. Neutrophil extracellular traps may contribute to interstitial lung disease associated with anti-MDA5 autoantibody positive dermatomyositis[J]. Clin Rheumatol, 2018, 37(1): 107–115.
[9] HE C, CHEN J, LUO X, et al. Evaluation of biomarkers related to endothelial dysfunction: Proof of vasculopathy in anti-melanoma differentiation-associated gene 5 dermatomyositis[J]. Clin Exp Rheumatol, 2021, 39(1): 151–157.
[10] SASAKI H, KOHSAKA H. Current diagnosis and treatment of polymyositis and dermatomyositis[J]. Mod Rheumatol, 2018, 28(6): 913–921.
[11] DOURMISHEV L A. Inflammatory myopathies with cutaneous involvement: From diagnosis to therapy[J]. Folia Med (Plovdiv), 2017, 59(1): 7–13.
[12] RAMZY D, TUMIATI LC, TEPPERMAN E, et al. Dual immunosuppression enhances vasomotor injury: Interactive effect between endothelin-1 and nitric oxide bioavailability[J]. J Thorac Cardiovasc Surg, 2008, 135(4): 938–944.
[13]LIU Y, MLADINOV D, PIETRUSZ J L, et al. Glucocorticoidresponse elements and 11 beta-hydroxysteroid dehydrogenases in the regulation of endothelial nitric oxide synthase expression[J]. Cardiovasc Res, 2009, 81(1): 140–147.
(2022–10–29)
(2023–06–27)
R593
A
10.3969/j.issn.1673-9701.2023.22.034
魏华,电子邮箱:yzweihua2018@163.com

