NSCLC患者胸腔积液ROS1、EGFR基因突变与临床病理及靶向治疗的关系研究
伍秉翔,杨雪荣,刘 龙△
上海天佑医院:1.肿瘤科;2.中医科,上海 200061
国际癌症研究机构2018年公布的数据显示,在全球恶性肿瘤中,肺癌发病率为11.6%,病死率为18.4%,均排在首位[1]。我国国家癌症报告中也指出,肺癌发病率与病死率在恶性肿瘤中占比最高[2]。根据病理分型,肺癌可分为小细胞肺癌(SCLC)、非小细胞肺癌(NSCLC),后者在肺癌中占比约为80.0%,主要为腺癌、鳞癌等[3]。尽管临床诊治恶性肿瘤均获得了一定进展,但多数肺癌患者在确诊时已发展至中晚期,此时难以进行手术治疗。近年来,分子生物学技术的快速发展使特异性分子靶向治疗在临床恶性肿瘤治疗中应用增多。分子靶向治疗具有高度特异性,能够更好地作用于肿瘤特定位点,选择性杀死肿瘤细胞,有利于改善肺癌患者预后[4]。在分子靶向治疗中,以肉瘤致癌因子-受体酪氨酸激酶(ROS1)、表皮生长因子受体(EGFR)等为靶点的靶向药物酪氨酸激酶抑制剂(TKI)应用较多,但并非所有患者均可从TKI治疗中获得满意效果,ROS1、EGFR基因突变是TKI药物靶向治疗的前提条件[5]。有研究指出,EGFR基因突变与患者性别、病理分型等有关[6]。因此了解NSCLC患者ROS1、EGFR基因突变情况,并对患者特征进行分析总结,对指导临床治疗具有重要意义。因NSCLC患者确诊时多处于中晚期,大多不符合手术要求,而穿刺标本取样少,加之肿瘤组织本身具有异质性,故需寻找其他方法来完成检测。胸腔积液的获取安全性相对较高,实时性强,可作为ROS1、EGFR基因突变检测的生物学材料。本研究检测了NSCLC患者胸腔积液中ROS1、EGFR基因突变情况,并分析了胸腔积液ROS1、EGFR基因突变与患者临床特征及治疗效果的关系,现报道如下。
1 资料与方法
1.1一般资料 选取2018年10月至2021年2月上海天佑医院收治的285例NSCLC患者,其中有197例患者采用靶向治疗(靶向治疗组),88例患者采用传统化疗(化疗组)。纳入标准:(1)符合《肿瘤综合诊疗新进展》[7]中NSCLC相关的诊断标准,且经病理学检查确诊;(2)在进行胸腔积液ROS1、EGFR基因突变检测前未行放化疗;(2)临床资料完整。排除标准:(1)合并其他恶性肿瘤;(2)心、肝、肾功能不全;(3)合并免疫系统疾病。
1.2方法
1.2.1治疗方法 (1)靶向治疗:口服厄洛替尼片(上海罗氏制药有限公司)150 mg/d,连续治疗2个月。(2)化疗:顺铂(江苏豪森药业集团有限公司)70 mg/m2,第1天静脉滴注;吉西他滨(南京正大天晴制药有限公司)1 000 mg/m2,第1、8天静脉滴注;每21天为1个周期,连续治疗2个周期。
1.2.2检测方法
(1)胸腔积液ROS1、EGFR提取。取经细胞学检查确定有癌细胞的胸腔积液50 mL,4 ℃保存并于24 h内进行DNA提取及基因检测。于4 ℃环境中3 000 r/min离心10 min;吸取上清液,再在4 ℃环境中3 000 r/min离心10 min;吸取上清液加入Buffer SPL和蛋白酶K溶液,于63 ℃水浴消化。加入DNA示踪剂、异丙醇,1 000 r/min离心5 min。清洗2次,1 000 r/min离心5 min,收集DNA。采用厦门艾德生物医药科技有限公司生产的人类ROS1融合基因检测试剂盒与EGFR基因突变检测试剂盒进行检测,检测仪器为ABI7500仪器,检测方法为突变扩增系统-聚合酶链反应(ARMS-PCR)。离心机为美国Beckman Coulter公司Allegra 64R台式高速冷冻离心机。
(2)ROS1基因检测。于-20 ℃冰箱中取出ROS1混合酶和N(ROS1样本数)条8联PCR反应管条,均离心15 s。移取1.5 μL ROS1混合酶至待测样本cDNA、阳性及阴性对照中,振荡混匀后快速离心10 s。进行PCR扩增,扩增条件:第1阶段95 ℃ 5 min;第2阶段95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15个循环;第3阶段93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,35个循环。
(3)EGFR基因检测。于-20 ℃冰箱中取出EGFR混合酶和N(EGFR样本数)+2条8联PCR反应管条,均离心15 s。稀释DNA,加入2.7 μL EGFR混合酶,振荡后离心。行PCR扩增,扩增条件:第1阶段95 ℃ 5 min;第2阶段95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15个循环;第3阶段93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,35个循环。
1.2.3基因检测结果判读 ROS1基因检测位点包含SLC34A2-ROS1、CD74-ROS1、SDC4-ROS1、EZR-ROS1、TPM3-ROS1、LRIG3-ROS1、GOPC-ROS1,若未检测到上述突变则认为ROS1融合阴性。EGFR基因检测位点包含19-Del、L858R、T790M、20-Ins、G719X、S768I、L861Q。因EGFR基因除18~21外显子外的突变极少见且目前与用药不相关,故如果未检测到上述突变则判断为EGFR野生型。
1.3疗效评价 采用实体瘤临床疗效评价标准(RECIST)评价治疗效果,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。客观缓解率(ORR)=(CR例数+PR例数)/总例数×100.00%,疾病控制率(DCR)=(CR例数+PR例数+SD例数)/总例数×100.00%。
1.4统计学处理 采用SPSS20.0统计软件进行数据分析。计数资料以例数或百分率表示,组间比较采用χ2检验或连续性校正χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1NSCLC患者胸腔积液ROS1、EGFR基因突变情况 NSCLC患者胸腔积液ROS1基因突变率为3.51%(10/285),EGFR基因突变率为41.05%(117/285)。在ROS1基因突变中,SLC34A2-ROS1占比最高,其次为CD74-ROS1;在EGFR基因突变中,19-Del占比最高,其次为L858R。见表1。
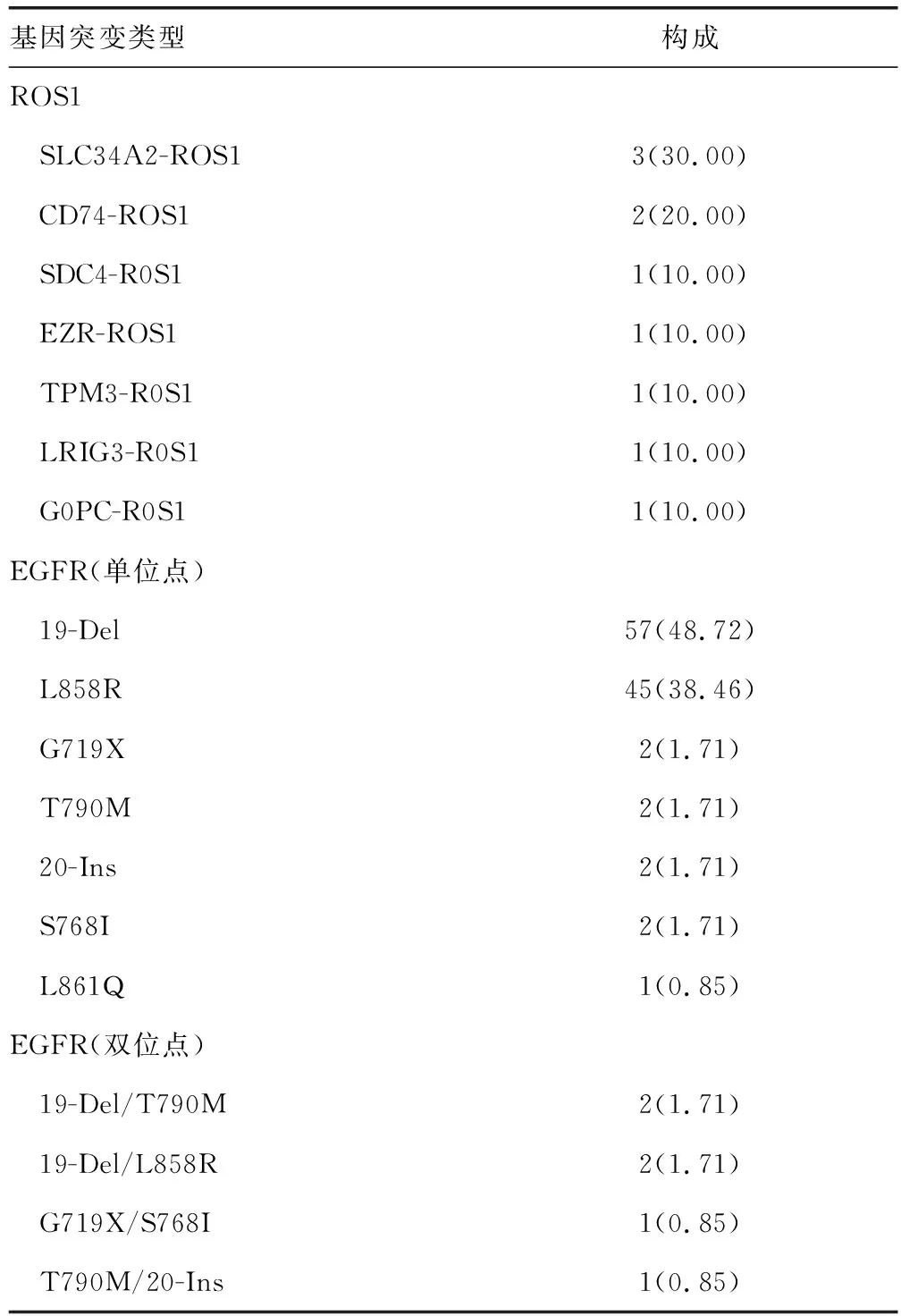
表1 NSCLC患者胸腔积液ROS1、EGFR基因突变类型[n(%)]
2.2NSCLC患者ROS1、EGFR基因突变与临床特征的关系 女性NSCLC患者ROS1、EGFR基因突变率高于男性NSCLC患者(P<0.05);腺癌NSCLC患者ROS1、EGFR基因突变率高于非腺癌NSCLC患者(P<0.05);无吸烟史NSCLC患者ROS1、EGFR基因突变率高于有吸烟史NSCLC患者(P<0.05);但不同年龄、肿瘤最大径、解剖学部位、初诊TNM分期患者ROS1、EGFR基因突变率比较,差异均无统计学意义(P>0.05)。见表2。
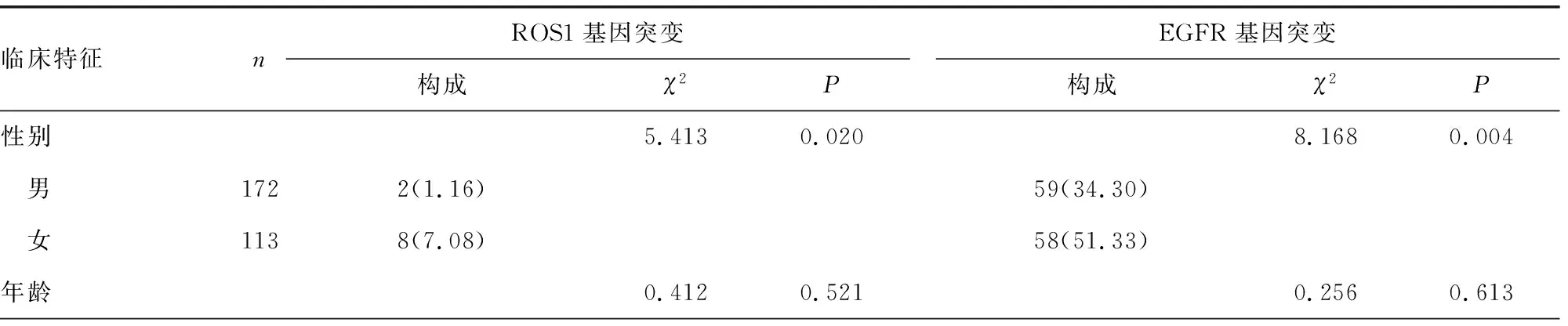
表2 NSCLC患者ROS1、EGFR基因突变与临床特征的关系[n(%)]
2.3伴ROS1基因突变的NSCLC患者靶向治疗与化疗效果比较 伴ROS1基因突变的NSCLC患者中,靶向治疗组ORR、DCR与化疗组比较,差异均无统计学意义(P>0.05)。见表3。

表3 伴ROS1基因突变的NSCLC患者靶向治疗与化疗效果比较[n(%)]
2.4伴EGFR基因突变的NSCLC患者靶向治疗与化疗效果比较 伴EGFR基因突变的NSCLC患者中,靶向治疗组ORR、DCR均高于化疗组(P<0.05)。见表4。

表4 伴有EGFR基因突变的NSCLC患者靶向治疗与化疗效果比较[n(%)]
2.5伴ROS1基因突变的NSCLC患者靶向治疗与化疗后的不良反应比较 伴ROS1基因突变的NSCLC患者靶向治疗组不良反应发生率与化疗组比较,差异均无统计学意义(P>0.05)。见表5。
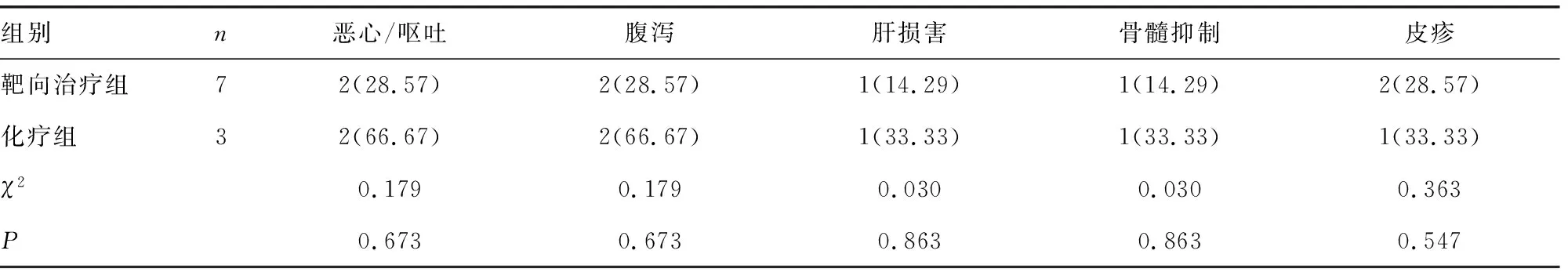
表5 伴ROS1基因突变的NSCLC患者靶向治疗与化疗后的不良反应比较[n(%)]
2.6伴EGFR基因突变的NSCLC患者靶向治疗与化疗后的不良反应比较 伴EGFR基因突变的NSCLC患者靶向治疗组恶心/呕吐、肝损害、骨髓抑制的发生率均低于化疗组(P<0.05)。见表6。
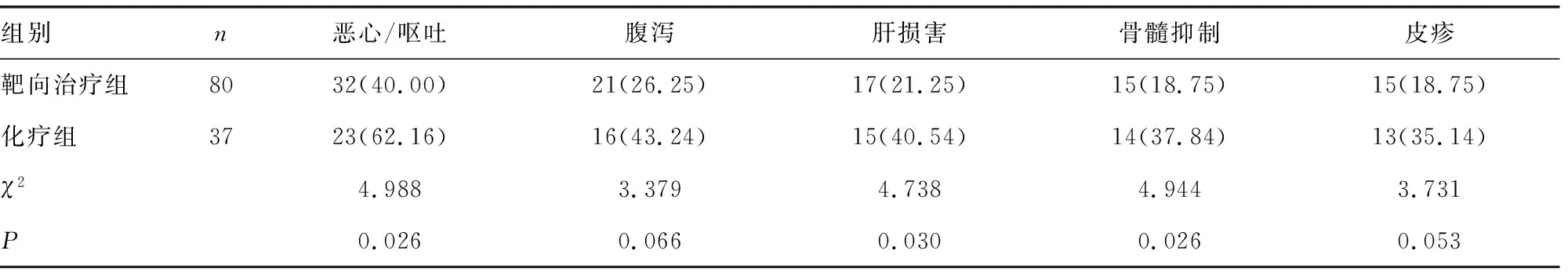
表6 伴EGFR基因突变的NSCLC患者靶向治疗与化疗后的不良反应比较[n(%)]
3 讨 论
外科手术、放化疗、免疫治疗是NSCLC治疗的常用手段,但由于多数患者确诊时已经处于癌症中晚期,故化疗使用更多。然而化疗不具有特异性,其在杀死肿瘤细胞的同时也会对正常细胞造成损害,引起明显不良反应。随着分子生物技术的不断发展,分子靶向治疗NSCLC逐渐兴起,与放化疗相比较,其可减少不良反应,更好地延长患者生存期。与NSCLC相关的基因较多,其中ROS1、EGFR基因为目前临床研究较多的驱动基因,本次研究选取上述2种基因,分析其在NSCLC患者胸腔积液中的突变率,并探讨了伴ROS1、EGFR基因突变的NSCLC患者临床特征和治疗效果。
ROS1为单体型受体酪氨酸激酶,人ROS1基因定位于6q21染色体中,其发生重排时会丢失细胞外区域,重排位点主要见于32~36外显子[8]。有研究显示,NSCLC中ROS1基因主要和CD74、SLC34A融合,可促使下游JAK/STAT、PI3K/AKT等信号通路呈持续激活状态,继而促进肿瘤发生[9-10]。有研究显示,ROS1染色体重排在NSCLC中较少见,仅为1%~2%[11-12]。刘光峨等[13]对黔北地区NSCLC患者ROS1基因突变进行检测,显示ROS1基因突变率为1.2%。吴丹等[14]研究显示,NSCLC患者ROS1基因突变率为2.7%。本研究结果显示,285例NSCLC患者胸腔积液ROS1基因突变率为3.51%(10/285),略高于以往研究,可能与患者居住地、生活习惯有关。EGFR基因位于第7号常染色体7p12-14区,是人表皮生长因子受体家族成员之一,其发生突变或异常高表达均能够引发肿瘤[15]。EGFR基因突变主要区域为TK区域18~21外显子[16],本研究中,EGFR基因突变率为41.05%(117/285),19-Del占比最高(48.72%),其次为L858R(38.46%)。鲁涛等[17]研究显示,NSCLC患者胸腔积液EGFR基因突变率为54.5%,且突变类型以19-Del、L858R为主,可见尽管不同研究中NSCLC患者EGFR基因突变率存在差异,但总体而言EGFR基因突变率较高,且主要类型为19-Del、L858R。
有研究显示,ROS1、EGFR基因突变与性别、组织类型、地域等有关,多数ROS1、EGFR基因突变阳性者为女性、腺癌、东亚人群[18-19]。本研究结果中,女性、腺癌、无吸烟史的NSCLC患者ROS1、EGFR基因突变率高于男性、非腺癌、有吸烟史的NSCLC患者(P<0.05),但不同年龄、肿瘤最大径、解剖学部位、初诊TNM分期ROS1、EGFR基因突变率比较,差异均无统计学意义(P>0.05),提示性别、病理分型和吸烟史与ROS1、EGFR基因突变有关。ROS1、EGFR基因突变是造成患者预后不良的影响因素之一,采用分子靶向药物治疗存在ROS1、EGFR基因突变位点的患者,可以减少不良反应,有效提升患者治疗耐受性和生存质量,延长其无进展生存期。本研究对采用靶向治疗或化疗的伴有ROS1、EGFR基因突变的NSCLC患者治疗效果进行观察分析,发现ROS1基因突变阳性患者中,靶向治疗组ORR、DCR分别为42.86%、71.43%,高于化疗组的0.00%、33.33%,但差异无统计学意义(P>0.05),这可能与例数太少有关,提示通过靶向治疗有提高伴ROS1基因突变NSCLC患者的疗效的可能。EGFR基因突变阳性患者中,靶向治疗组ORR、DCR分别为61.25%、80.00%,高于化疗组的32.43%、51.35%,差异均有统计学意义(P<0.05),表明EGFR基因突变阳性患者采用靶向治疗可获得更好的效果。笔者还对治疗不良反应进行分析,显示伴ROS1基因突变的NSCLC患者靶向治疗组与化疗组不良反应发生率比较,差异无统计学意义(P>0.05),伴EGFR基因突变的NSCLC患者靶向治疗组恶心/呕吐、肝损害、骨髓抑制不良反应发生率均低于化疗组(P<0.05),提示伴有EGFR基因突变阳性的NSCLC患者行靶向治疗可以降低不良反应发生率。虽然本次研究中胸腔积液EGFR基因突变检测结果没有对应的肿瘤组织检测结果予以对比验证,但是该检测结果指导下的靶向治疗效果与过去在肿瘤组织检测结果指导下的靶向治疗效果相符[20],间接说明了在病理质控把关前提下的胸腔积液EGFR突变检测结果准确可靠,有确切的临床价值。
综上所述,NSCLC患者胸腔积液检测可见ROS1、EGFR基因突变,其突变率分别为3.51%、41.05%,ROS1、EGFR基因突变与患者性别、病理分型和吸烟史等临床特征有关,且EGFR基因突变和疗效、不良反应存在关系。检测NSCLC患者胸腔积液能够有效指导NSCLC患者靶向治疗。本次研究也存在不足之处,纳入样本量相对较少,使ROS1基因突变阳性病例少,对研究结果会产生一定影响,还有待后续扩大样本量研究。

