丙型肝炎患者血清丙型肝炎病毒抗体滴度、miR-27a和miR-130a水平及意义
宋娟芳,李 源
陕西省西安市北方医院检验科,陕西西安 710043
丙型肝炎是丙型肝炎病毒(HCV)感染机体所导致的病毒性肝炎。相关数据显示,HCV属于世界范围内的感染性疾病,除东欧外,1990-2017年全球HCV感染年龄标准化患病率逐渐下降[1]。在我国,丙型肝炎是发病率仅次于乙型肝炎的病毒性肝炎[2]。慢性HCV感染有进展为肝硬化的风险,约28.0%肝硬化由HCV感染所引发[3],而肝硬化存在较高肝细胞癌发生风险[4]。做好丙型肝炎肝硬化的准确诊断对预后改善有重要作用。HCV抗体(HCV-Ab)是机体遭受HCV感染后所产生的抗体,是HCV感染的主要诊断指标之一。以往在乙型肝炎病情研究中发现,乙型肝炎病毒核心抗体定量检测值与乙型肝炎炎症程度和纤维化相关,故临床可通过定量测定乙型肝炎病毒核心抗体水平判断肝脏损伤程度,同时为疾病治疗提供依据[5-6]。但在丙型肝炎中HCV-Ab是否存在与乙型肝炎相似状态,目前尚缺少数据报道。微小RNA(miRNA)是一类广泛参与细胞增殖、分化、凋亡及病毒感染等过程的小分子肽,其中miRNA-27a(miR-27a)位于19p13.13号染色体,具有促炎症反应、促血管生成、调控细胞增殖分化等功效;miRNA-130a(miR-130a)是一种内源性非编码单链RNA分子,可通过与靶基因上的信使RNA选择性结合,抑制其表达,从而参与真核生物组织发育、细胞分化及免疫调控等生理变化。以往研究显示,miR-27a在乙型肝炎患者体内高表达,是影响乙型肝炎进展为肝硬化和肝癌的独立危险因素[7];miR-130a在乙型肝炎病毒感染患者体内呈高表达,尤其是隐匿性乙型肝炎患者,对隐匿性乙型肝炎病毒感染具有一定诊断价值[8],但关于其在丙型肝炎患者体内表达状态及意义尚未明确。本研究检通过测定丙型肝炎患者血清HCV-Ab、miR-27a、miR-130a水平,分析其与HCV肝损伤情况的相关性,以期为患者临床诊治提供新的依据。
1 资料与方法
1.1一般资料 选取2020年1月至2022年6月在西安市北方医院(以下简称本院)就诊的152例丙型肝炎患者为观察组,另选取同期在本院体检中心接受常规体检的健康人群152例为对照组。纳入标准:观察组符合《丙型肝炎防治指南(2019年版)》[9]中有关丙型肝炎的诊断标准;无凝血功能障碍;临床资料完整;非过敏体质;精神正常,能配合研究。排除标准:被确诊为乙型、戊型肝炎病毒感染;合并其他原因所致肝病;合并其他类型局部或全身性感染;近6个月内接受过干扰素、核苷酸类或免疫调节剂治疗;合并恶性肿瘤或免疫系统疾病。观察组男83例,女69例;年龄33~69岁,平均(57.15±8.16)岁;体质量指数(BMI)为19.45~29.13 kg/m2,平均(23.76±3.97)kg/m2。对照组男77例,女75例;年龄35~70岁,平均(56.64±8.17)岁;BMI为18.69~30.13 kg/m2,平均(23.77±3.95)kg/m2。两组受试者性别、年龄、BMI比较,差异均无统计学意义(P>0.05),具有可比性。本研究符合本院医学伦理委员会审核标准。所有受试者均签署知情协议书。
1.2方法
1.2.1血清指标测定 取两组受试者晨起空腹肘静脉血3~5 mL,3 000/min离心10 min,留取上清液待用。采用酶联免疫吸附试验测定观察组HCV-Ab滴度,采用实时荧光定量PCR(qRT-PCR)测定观察组血清HCV-DNA载量和两组血清miR-27a、miR-130a表达水平(2-△△Ct法计算)。
1.2.2肝脏损伤程度评估 观察组于入院后3 d内在超声引导下进行肝穿刺活检,获取5个及以上完整汇管区长度1.0~2.0 cm的肝组织标本,10%甲醛溶液固定,制作石蜡切片,苏木精-伊红染色,采用Scheuer评分系统评估患者肝脏炎症分级和纤维化分期情况。(1)炎症分级:G0级为肝脏汇管区、肝小叶及周围均无炎症;G1级为汇管区出现炎症病变,肝小叶有肝细胞变性和少数点状或灶状坏死;G2级为汇管区及周围均有轻度碎屑状坏死,肝小叶内细胞变性,出现点状和灶状坏死或嗜酸性小体;G3级为汇管区及周围中度碎屑状坏死,肝小叶变性,呈现融合坏死或桥接坏死;G4级为汇管区及周围重度碎屑状坏死,大范围桥接坏死,多小叶坏死。(2)纤维化分期:S0期为无纤维化;S1期为汇管区无纤维化,但肝小叶和肝窦内现纤维化;S2期为汇管区周围呈现纤维化,且形成纤维间隔,但保留小叶结构;S3期为纤维间隔和小叶结构均紊乱,但尚未现肝硬化结节;S4期为肝硬化[10]。

2 结 果
2.1两组受试者血清miR-27a、miR-130a水平比较 观察组患者miR-27a、miR-130a水平均显著高于对照组(P<0.01)。见表1。

表1 两组受试者血清miR-27a、miR-130a水平比较
2.2观察组血清HCV-Ab、miR-27a、miR-130a与HCV-DNA载量的相关性 观察组患者HCV-DNA载量为0.86~3.17 IU/mL,平均(1.75±0.44)IU/mL。Pearson相关分析显示,观察组血清HCV-Ab、miR-27a、miR-130a均与HCV-DNA载量呈正相关(r=0.325、0.365、0.427,P<0.001)。见图1。
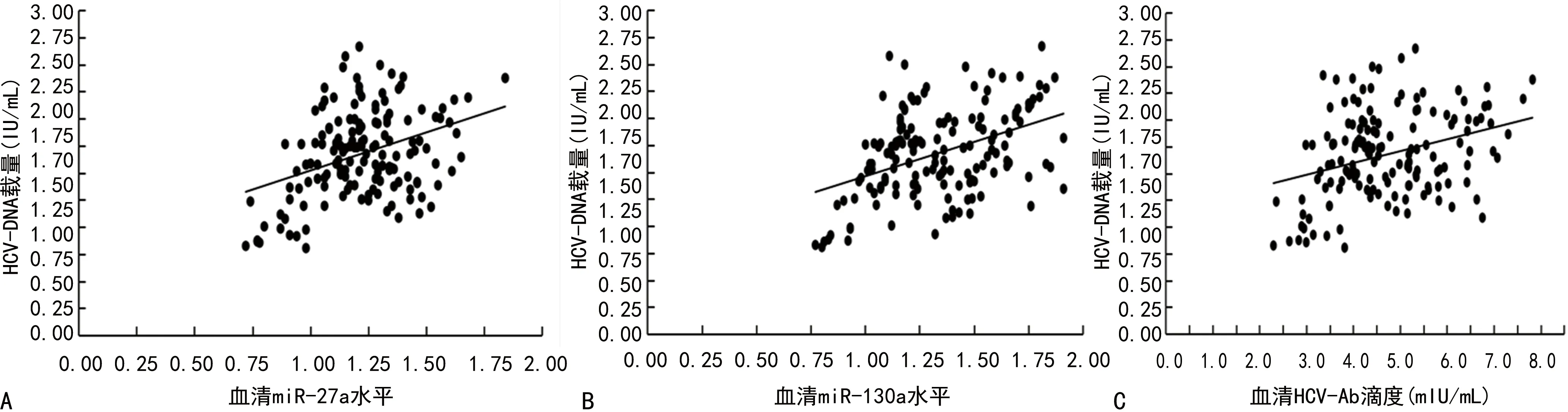
注:A为血清miR-27a与HCV-DNA载量相关性散点图;B为血清miR-130a与HCV-DNA载量相关性散点图;C为血清HCV-Ab滴度与HCV-DNA载量相关性散点图。
2.3观察组血清HCV-Ab滴度、miR-27a、miR-130a水平与肝脏炎症分级的相关性 不同炎症程度患者血清HCV-Ab滴度、miR-27a、miR-130a水平比较,差异均有统计学意义(P<0.01);肝脏炎症G4级患者的血清HCV-Ab滴度、miR-27a、miR-130a水平高于G3级、G2级和G1级(P<0.01)。见表2。

表2 观察组血清HCV-Ab滴度、miR-27a、miR-130a水平与肝脏炎症分级的关系
2.4观察组血清HCV-Ab滴度、miR-27a、miR-130a水平与肝脏纤维化的关系 不同纤维化程度患者血清HCV-Ab滴度、miR-27a、miR-130a水平间比较,差异均有统计学意义(P<0.01);肝脏纤维化S4期者的血清HCV-Ab滴度、miR-27a、miR-130a水平高于S2~S3期、S1期和S0期(P<0.01)。见表3。

表3 观察组血清HCV-Ab滴度、miR-27a、miR-130a水平与肝脏纤维化情况的关系
2.5血清HCV-Ab滴度、miR-27a、miR-130a水平预测肝硬化的效能 多因素Logistic回归分析结果显示,血清HCV-Ab滴度、miR-27a、miR-130a水平是发生丙型肝炎肝硬化的影响因素(P<0.05)。见表4。根据是否发生肝硬化,得回归方程为Y=-20.020+1.340×XHCV-Ab+1.197×XmiR-27a+1.061×XmiR-130a。3项指标联合预测丙型肝炎患者发生肝硬化的曲线下面积(AUC)明显高于血清HCV-Ab、miR-27a、miR-130a单独检测(Z=2.083、2.474、2.902,P<0.01)。见图2、表5。
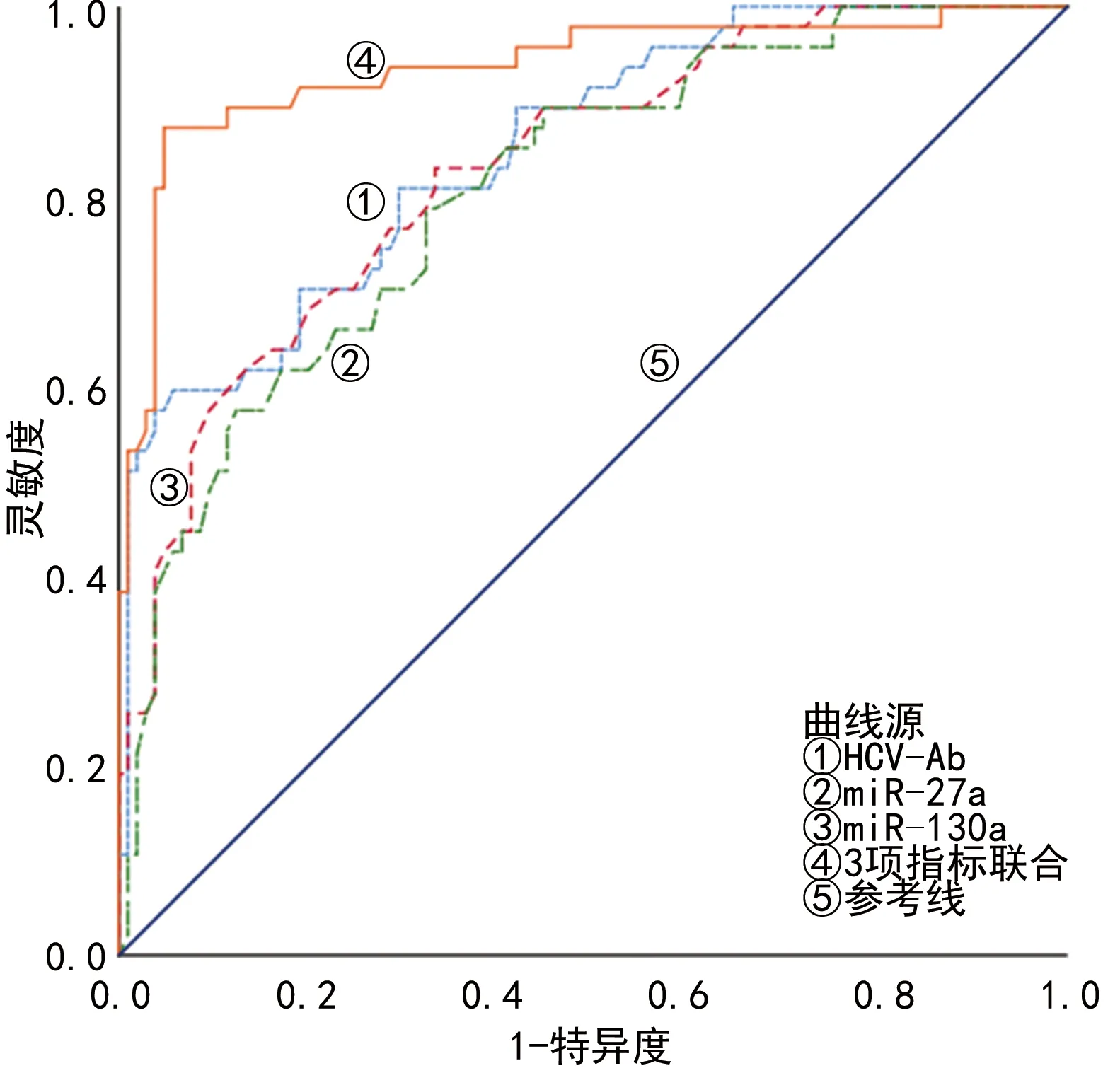
图2 观察组血清HCV-Ab滴度、miR-27a、miR-130a水平单独及联合预测肝硬化的ROC曲线

表5 观察组血清HCV-Ab滴度、miR-27a、miR-130a水平单独及联合预测肝硬化的效能
3 讨 论
HCV感染后自然转阴率较低,70.0%~80.0%急性HCV感染会转化为慢性肝炎。慢性肝炎是引发肝硬化的重要病因之一,患者一旦进入肝硬化代偿期即意味着其肝脏功能明显减退,死亡风险显著升高,5年存活率可降至50.0%左右[11]。相关数据显示,2015年全球共有约7 100万人被确诊为HCV感染,其中30.0%以上进展为肝硬化或肝癌,同时每年约39.9万人死于丙型肝炎及其所引发的肝硬化等疾病[12]。早期评估肝炎患者肝脏损伤情况对疾病治疗和预后改善均具有重要意义。超声引导下的肝脏穿刺活检是判断患者肝脏炎症分级和纤维化分期的“金标准”,但该技术属于有创操作,且检测工序烦琐、周期长。近年来,随着血清学指标研究的深入,其在疾病诊断、病情和临床效果评估中的优势越来越明显,受到临床工作者的广泛关注。
HCV属于单股正链RNA病毒,HCV感染者HCV-DNA水平可在一程度上反映疾病进展状况和宿住免疫状态,其水平越高提示病毒复制能力越强,机体循环病毒量越大,免疫机制清除病毒难度越大[13];同时,HCV大量复制会干扰细胞内大分子物质合成,改变溶酶体膜通透性,增加肝细胞毒性损伤[14]。HCV-Ab是HCV感染后刺激机体免疫系统所释放的蛋白分子,其在HCV感染和病毒性肝炎诊断中具有良好的灵敏度和特异度[15]。本研究结果显示,观察组HCV-Ab滴度与HCV-DNA载量呈正相关,且随着患者肝脏组织炎症分级增加,纤维化程度加重,血清HCV-Ab滴度显著升高(P<0.05),对患者肝硬化发生具有一定预测价值(P<0.05)。这可能归因于HCV持续复制不断刺激人体免疫细胞为对抗病毒而释放相应抗体,同时病毒复制导致局部炎症反复迁延,肝细胞持续坏死,纤维组织过度增生,最终导致了肝硬化的发生[16]。
miRNA是一类可在转录或翻译水平上调控相关基因表达的小分子RNA,同时可参与病毒感染性疾病及恶性肿瘤等发生、发展过程。相关研究证实,miRNA与肝炎病毒所致肝脏损伤过程密切相关[17]。miR-27a是位于19号染色体上的小分子RNA,其高表达与病毒侵袭、炎症反应及细胞增殖等病理过程有关[18];miR-130a是一种与血小板功能和恶性肿瘤发生、发展密切相关的小分子RNA。研究显示,miR-27a是乙型肝炎患者肝硬化发生的危险因素之一,且可预测乙型肝炎肝硬化的发生,但预测灵敏度和特异度仅分别为73.02%和61.19%,而与另外一种微小RNA分子联合检测能有效提高预测特异度[7];miR-130a同样高表达于乙型肝炎肝硬化患者体内[19]。本研究结果显示,与对照组相比,观察组血清miR-27a和miR-130a均明显表达上调,且其表达水平与HCV-DNA载量呈正相关,同时其表达水平随着丙型感染患者肝脏组织炎症分级增大、纤维化程度加重而显著升高(P<0.05)。分析原因,miR-27a一方面有助于HCV侵袭复制,促进局部炎症反应,加重肝脏损伤[18];另一方面,可通过抑制肝细胞增殖蛋白-跨膜泛素样蛋白1,抑制肝细胞增殖及肝脏损伤的修复过程[7]。HCV对骨髓细胞具有明显抑制作用,导致患者体内血小板显著减少;同时细胞外基质大量形成是肝脏纤维化的中心环节。miR-130a可作用于过氧化物酶体增殖物激活受体PPARγ的3’非翻译区,下调PPARγ表达,调节血管紧张素Ⅱ,一方面抑制血小板形成,加速肝脏纤维化;另一方面激活细胞外基质基因表达,加速肝脏纤维化进程及肝硬化发生[19-20]。此外,本研究结果显示,miR-27a、miR-130a与HCV-Ab滴度联合检测对丙型肝炎患者发生肝硬化具有较高预测效能,提示临床可通过检测miR-27a、miR-130a水平与HCV-Ab滴度变化,判断丙型肝炎患者肝脏损伤进程,从而指导临床治疗。
综上所述,丙型肝炎患者血清中存在与乙型肝炎相似的miR-27a、miR-130a表达状态,且丙型肝炎患者血清HCV-Ab滴度、miR-27a、miR-130a水平均与机体HCV-DNA载量、肝脏炎症活动度和纤维化严重程度呈一定相关性,对肝硬化具有一定预测价值,联合检测预测肝硬化效能更高。

