外源一氧化氮对扁豆采后贮藏品质的影响
韩丽春,何雪莲,郑鄢燕,左进华,王 清,王正荣
(1.河北工程大学生命科学与食品工程学院,河北 邯郸 056107;2.北京市农林科学院农产品加工与食品营养研究所,果蔬农产品保鲜与加工北京市重点实验室,农业农村部蔬菜采后处理重点实验室,北京 100097;3.邯郸市天然产物与功能食品开发重点实验室,河北 邯郸 056107)
扁豆[Lablab purpureus(Linn.)Sweet]是豆科、扁豆属多年生缠绕藤本植物,在我国南北方均有种植,目前我国栽培的种类主要有绿扁豆、白扁豆、紫扁豆、猪耳豆等[1]。扁豆作为典型的豆类蔬菜代表,在“南菜北运”产销物流链中占据一定地位,然而,扁豆豆荚组织幼嫩,且上市季节主要集中在夏秋季,在采后的商品化处理和物流过程中极易出现失水萎蔫、腐烂变质、锈斑化、豆粒膨大褐变等品质劣变问题而导致损耗严重,造成严重的经济损失。针对改善豆类蔬菜采后品质劣变问题的研究有很多,包括采取1-甲基环丙烯(1-methylcyclopropene,1-MCP)[2-3]、丙二酸[4]、壳聚糖涂膜[5]、精胺[6]和低温贮藏[7]等方式处理以延缓豆类蔬菜的黄化、软化、木质纤维化、锈斑化、失水萎缩、成熟衰老等品质劣变现象,从而维持其较好的感官品质,延长保鲜期。但目前扁豆的保鲜技术主要以冷藏为主,更多的保鲜方法仍有待进一步研究。
影响新鲜果实采后品质劣变的因素较多,但果实自身衰老是采后损耗的主要诱因。一氧化氮(nitric oxide,NO)作为植物中重要的信号分子,在调节果蔬的成熟衰老方面发挥着重要作用[8-9]。NO可以通过调控果蔬贮藏过程中乙烯的合成以及抗氧化酶的活性来达到延缓果蔬成熟衰老的目的[10-11]。目前的研究中多采用NO气体熏蒸或外源NO供体浸泡处理,而近年来外源NO供体硝普纳(sodium nitro prusside,SNP)浸泡处理受到研究者的广泛关注,NO气体熏蒸需要无氧条件,而SNP浸泡处理可以避免此条件的限制,达到更好的保鲜效果[12-13]。研究发现,0.25 mmol/L的SNP浸泡处理芒果2 min后置于23 ℃贮藏,可有效抑制果实呼吸速率和质量损失,维持果实硬度、好果率和果皮色泽,保持良好的果实品质,并延长其贮藏期[14]。范林林等[15]研究SNP浸泡处理对豇豆贮藏品质的影响,发现使用0.3 mmol/L SNP可以很好地维持豇豆的感官品质,抑制乙烯的释放和质量损失,减缓营养成分的降解,使豇豆维持较好的贮藏品质,保持商品价值。此外还有研究表明,SNP对蓝莓[16-17]、苹果[18]、血橙[19]等果蔬均有不同程度的保鲜效果,可以延缓果实的成熟衰老,抑制果实的品质劣变,调节抗氧化酶的活性,从而达到延长贮藏期的效果。但目前有关外源NO对扁豆成熟衰老影响的相关报道较少。
因此,本实验选取扁豆作为研究对象,课题组前期利用不同浓度的SNP(0、0.1、0.2、0.3、0.4 mmol/L)对扁豆进行处理,通过表型评价,确定最适SNP浓度为0.2 mmol/L,本研究进一步探讨0.2 mmol/L SNP处理对扁豆采后品质的影响,以期为扁豆采后保鲜提供新的思路和理论依据,为NO在蔬菜贮藏保鲜方面的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
扁豆购于北京果蔬好超市,挑选大小一致、质地脆嫩、新鲜有光泽、荚面清洁、无病虫害及其他伤害的豆荚进行实验。
0.03mm 低密度聚乙烯自封袋折扣包装(20 cm×40 cm)北京华盾雪花有限公司。
SNP 上海麦克林生化科技有限公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二水磷酸氢二钠、二水磷酸二氢钠 西陇科学股份有限公司;交联聚乙烯吡咯烷酮(crosslinked polyvinylpyrrolidone,PVPP) 柏吉(湖北)生物科技有限公司;愈创木酚上海麦克林生化科技有限公司;三氯乙酸(trichloroacetic acid,TCA) 柏吉(湖北)生物科技有限公司;硫代巴比妥酸(thiobarbituric acid,TBA) 国药集团化学试剂有限公司;过氧化氢酶(catalase,CAT)、多酚氧化酶(polyphenol oxidase,PPO)和苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活力检测试剂盒北京索莱宝科技有限公司。
1.2 仪器与设备
UV-1800紫外-可见分光光度计 上海精密科学仪器有限公司;Spectra Maxi3酶标仪 美谷分子仪器(上海)有限公司;TA-XT plus质构仪 英国SMS公司;Chroma-Meter CR-400色彩色差仪 柯盛行(杭州)仪器有限公司;Palette PR-100数显折光仪 日本Atago公司;M20研磨机 艾卡(广州)仪器设备有限公司。
1.3 方法
1.3.1 样品处理
将挑选好的扁豆分为两组(每个处理组设置5 个取样点,每个取样点设置3 个平行,每个平行装1 kg扁豆)进行浸泡处理,对照组(CK组)使用蒸馏水浸泡10 min,实验组(SNP组)使用0.2 mmol/L浓度的SNP溶液浸泡10 min。室温环境下自然晾干后装入0.03 mm厚低密度聚乙烯自封袋中折扣包装,每袋装约1 kg的扁豆,在20 ℃相对湿度80%~90%条件下贮藏。从0 d开始每2 d对两个处理组取样进行观察,统计腐烂率和锈斑率,同时测定色差、硬度、总可溶性固形物(total soluble solid,TSS),收集的豆荚组织于-80 ℃冻藏,以测定其他指标。
1.3.2 腐烂率和锈斑率的测定
腐烂率的测定:观察扁豆腐烂个数以及腐烂面积占整个豆荚表面积的百分比,将扁豆的腐烂面积分为3级。0级:无腐烂;1级:腐烂面积比小于50%;2级;腐烂面积比达50%以上。按照式(1)计算腐烂率。
锈斑率的测定:观察扁豆产生锈斑个数及锈斑面积占整个豆荚表面积的百分比,将扁豆的锈斑面积分为5级[20]。0级:无锈斑;1级:锈斑面积比例小于10%;2级:锈斑面积比例在10%~25%之间;3级:锈斑面积比例在25%~50%之间;4级:锈斑面积比例大于50%。按照式(2)计算锈斑率。
1.3.3 色泽和总叶绿素含量的测定
色泽使用Chroma-Meter CR-400色彩色差仪测定,选取扁豆中心避开豆粒所在位置进行测定,记录a*、b*和L*值。a*值代表红绿度,正值偏红,负值偏绿;b*值代表黄蓝度,正值偏黄,负值偏蓝;L*值代表亮度,正值偏亮,负值偏暗。
总叶绿素含量的测定参照曹建康等[21]的方法。
1.3.4 丙二醛含量和硬度的测定
丙二醛(malondialdehyde,MDA)含量采用曹建康等[21]的方法测定。
硬度采用TA-XT plus质构仪测定,探头直径为0.5 cm,选取扁豆中心位置表面平整的点(避开豆粒所在位置)进行测定。
1.3.5 TSS质量分数的测定
TSS质量分数使用手持式数显折光仪测定,豆荚需去头、尾、筋和豆粒,取中间部位进行测定。
1.3.6 类黄酮和总酚含量的测定
类黄酮和总酚含量的测定参照曹建康等[21]的方法。
1.3.7 代谢相关酶活力的测定
过氧化物酶(peroxidase,POD)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力的测定参考曹建康等[21]的方法。
CAT、PPO和PAL活力均采用试剂盒进行测定。
1.4 数据处理与分析
以上指标测定时均取3 个平行,重复测定3 次。采用Excel 2021软件进行数据处理,结果以平均值±标准差表示,采用Origin 2021软件作图,SPSS 21软件用于数据差异显著性分析(利用Duncan多重比较进行分析,P<0.05为差异显著,P<0.01为差异极显著)。
2 结果与分析
2.1 SNP处理对扁豆腐烂率和锈斑率的影响
从图1A可以看出扁豆的腐烂和锈斑主要集中在豆荚的两侧、尾部以及豆粒处。0 d的扁豆豆荚肥厚、色泽鲜嫩,而随着贮藏时间的延长,扁豆开始失水萎蔫、腐烂变质、产生锈斑,色泽也变得暗淡无光且有变黄的趋势,CK组的扁豆在第8天时已经完全失去了食用价值,豆粒膨大褐变,豆荚出现大面积锈斑腐烂,整个豆荚也出现萎蔫失水、暗淡无光的现象,SNP组扁豆外观品质的劣变较CK组延缓2~4 d,可以明显看出SNP组的扁豆外观品质在第8天时与CK组第4~6天的相近。
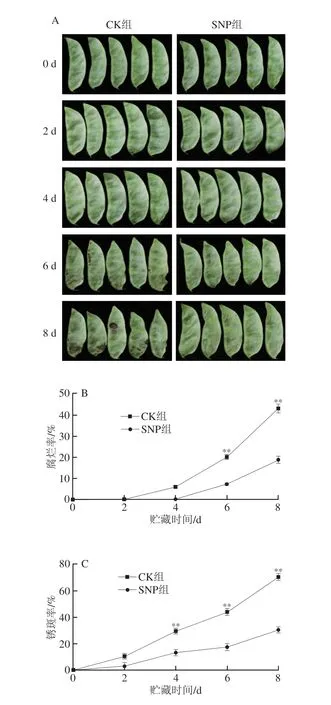
图1 SNP处理对扁豆外观品质(A)、腐烂率(B)和锈斑率(C)的影响Fig.1 Effect of SNP treatment on the appearance quality (A),decay rate (B) and rust spot rate (C) of hyacinth bean
如图1B所示,对照组扁豆在第4天有些许腐烂,腐烂扁豆仅占总体的6.01%,第8天时腐烂率达到43.08%,SNP组扁豆的腐烂出现时间相对延迟两天,第6天开始在豆荚头尾处出现腐烂,至贮藏末期腐烂率达到18.86%。如图1C所示,CK组在2 d时出现的锈斑多处于1~2级,会在豆荚表面呈现轻微的褐色斑点,但因出现锈斑的扁豆数量较多,所以锈斑率达到10.61%,不影响食用价值,第8天锈斑率达到70.44%,且以3级锈斑居多,有少量4级锈斑出现,荚面呈现大片褐色斑点,以豆荚头部尾部两侧以及豆粒处最为明显,扁豆完全失去商品价值;整个贮藏期间SNP组豆荚产生的锈斑在贮藏期内都处于1~2级,锈斑多呈现褐色小斑点,出现在豆荚两侧以及头尾处,8 d时锈斑率达到30.5%,荚面出现的点状锈斑较多,对商品价值造成了一定的影响。
2.2 SNP处理对扁豆色泽和总叶绿素含量的影响
果蔬的色泽变化对于消费者的直观感受有较大影响,拥有良好的色泽可以提升消费者的购买欲。SNP处理对扁豆贮藏期色泽的影响差异极显著(P<0.01)。在贮藏期间两组的a*值和b*值呈上升趋势(图2A、B)。两组a*值在前4 d的变化趋势相近,且上升幅度较大,4~6 d时SNP组的a*值上升趋势受到抑制,至第8天时,CK组的a*值较初值上升了41.44%,SNP组的a*值较初值上升了28.41%(图2A)。b*值的起始值为13.00,从第2天开始CK组b*值上升速率加快,第8天时b*值已增加到20.08,较初值增加了54.49%,第8天时SNP组的b*值较初值增加了30.07%(图2B)。两个组的L*值皆呈下降的趋势(图2C),但CK组L*值的下降速率明显要快于SNP组,L*值的初始值为52.46,第8天时CK组的L*值下降到35.46,SNP组的L*值下降到41.63。说明在贮藏期间使用SNP处理可以延缓扁豆的黄化褪色,维持扁豆的绿色和光泽。
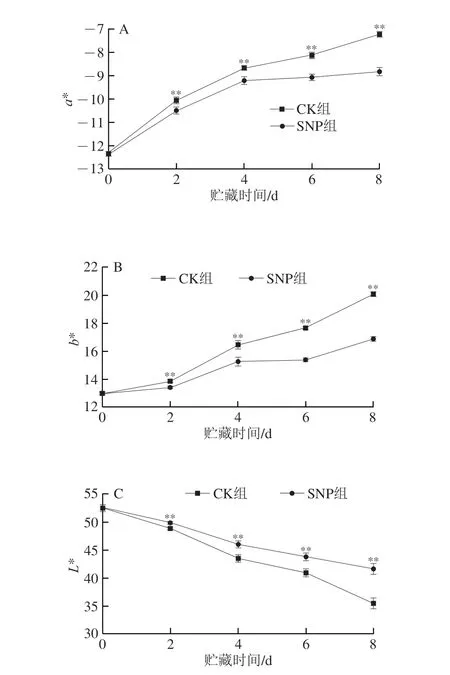
图2 SNP处理对扁豆a*(A)、b*(B)、L*(C)值和总叶绿素含量(D)的影响Fig.2 Effect of SNP treatment on the a* (A),b* (B) and L* (C) values and chlorophyll content (D) of hyacinth bean
叶绿素是植物光合作用的关键因子,它的存在对果蔬的颜色有极大的影响,其含量可以反映采后扁豆的颜色。如图2D所示,叶绿素含量的变化趋势为先升后降,CK组在第4天达到峰值(0.38 mg/g),4~6 d呈缓慢下降趋势,第8天时叶绿素含量急剧下降,此时的叶绿素含量为贮藏期最低值(0.23 mg/g)。SNP组的叶绿素含量在0~4 d处于上升状态,在第4天达到峰值0.41 mg/g,后期叶绿素开始降解,含量逐渐下降。说明SNP浸泡处理对叶绿素的降解有一定的抑制效果,可以使扁豆保持良好的颜色,维持扁豆的商品价值。
2.3 SNP处理对扁豆MDA含量和硬度的影响
MDA是细胞膜脂质过氧化的最终产物,其含量与细胞膜的完整性密切相关,可以反映细胞膜脂质过氧化的程度,直接影响细胞的衰老死亡,可以作为判断膜氧化损伤的指标,细胞膜的完整性间接影响果蔬的硬度[22-23]。贮藏期间扁豆的MDA积累量逐渐增加(图3A),在0~4 d时,CK组扁豆中MDA的积累量较少,第4天开始MDA含量上升幅度比较大,第8天时MDA的积累量达到1.44 μmol/g,SNP组的MDA含量一直低于CK组,至第8天时,SNP组的MDA积累量为1.01 μmol/g,较CK组低16.44%。如图3B所示,扁豆在第0天的硬度为5.84 N,CK组在第8天时硬度降低到0.79 N,SNP组硬度则降至2.35 N,在0~6 d,两组硬度的下降趋势较为一致,但在第8天时,CK组硬度下降速率加快,与初始值相比下降了86.41%,而SNP组的降幅受到抑制,第8天时与初始值相比只下降了59.68%。综上,SNP处理能够极显著抑制扁豆MDA的积累和硬度的下降(P<0.01)。
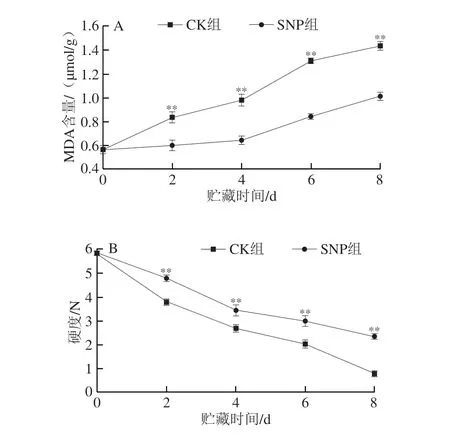
图3 SNP处理对扁豆MDA含量(A)和硬度(B)的影响Fig.3 Effect of SNP treatment on the MDA content (A) and hardness (B) of hyacinth bean
2.4 SNP处理对TSS质量分数的影响
果蔬中TSS含量是指提取物中溶解的糖、酸和维生素的总含量,主要是糖(包括葡萄糖、果糖、蔗糖等)的含量[24]。如图4所示,两组的TSS质量分数先增后降,但SNP组的TSS质量分数始终高于CK组。0~2 d,CK组和SNP组的TSS质量分数呈上升趋势,CK组在第2天的TSS质量分数与初始值相比增加了10.70%,SNP组则增加了16.93%,两组扁豆的TSS质量分数存在极显著差异(P<0.01)。在2~8 d,两组的TSS质量分数呈下降趋势,第4天的降幅比较明显,贮藏后期的降幅趋于平缓。TSS质量分数在整个贮藏过程中呈现上述变化,其原因可能是在各种酶的作用下,一些大分子物质在早期被水解为可溶成分,随后在呼吸作用的影响下,可溶成分逐渐被消耗[22]。
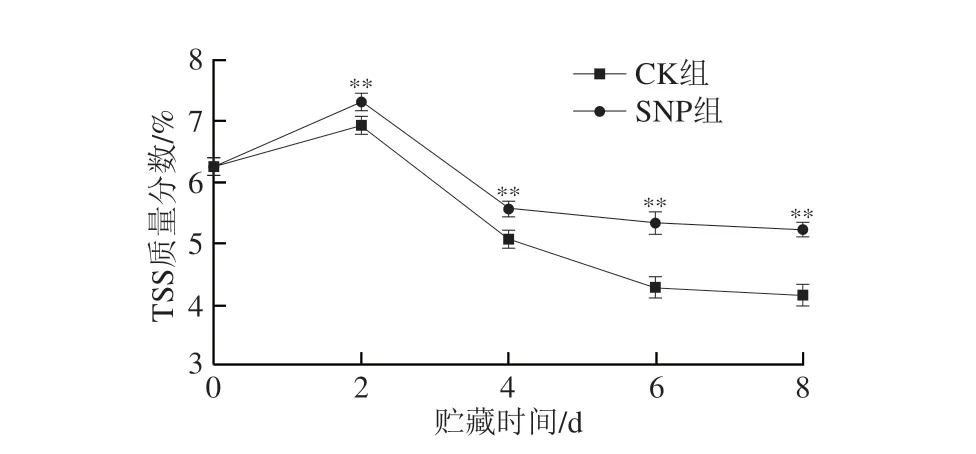
图4 SNP处理对扁豆TSS质量分数的影响Fig.4 Effect of SNP treatment on the total soluble solid content of hyacinth bean
2.5 SNP处理对扁豆总酚和类黄酮含量的影响
酚类化合物是果蔬中重要的成分,其与果蔬的成熟衰老、组织褐变、抗逆性等密切相关,酚类化合物具有抗氧化活性,可以阻止氢过氧化物转化为自由基或灭活脂质自由基,同时多酚物质还是酶促褐变的关键底物[25-26]。贮藏过程中,扁豆组织中总酚的含量逐渐增加,且SNP组的总酚含量始终高于CK组(图5A)。第2天时,CK组的总酚含量略微下降,较初始值下降了2.98%,2~4 d总酚含量上升的趋势相对稳定,而第8天时总酚增加量(与0 d相比)只有0.19 OD280nm/g;SNP组的总酚含量在0~4 d增加较为缓慢,只从初始值的2.15 OD280nm/g增加到2.21 OD280nm/g,4 d后总酚的含量则迅速上升,终点的总酚含量达到2.71 OD280nm/g,与初始值相比增加了26.41%。SNP处理显著提高了扁豆总酚的含量(P<0.05,P<0.01)。
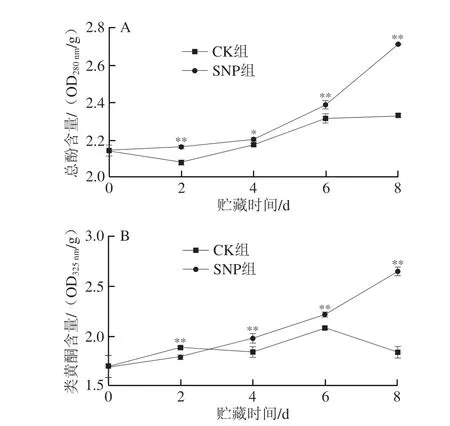
图5 SNP处理对扁豆总酚(A)和类黄酮(B)含量的影响Fig.5 Effect of SNP treatment on the total phenol (A) and flavonoid (B)contents of hyacinth bean
类黄酮属于酚类物质广泛存在许多植物组织中。如图5B所示,贮藏前期CK组的类黄酮含量高于SNP组,CK组的类黄酮含量在整个贮藏期不是很稳定,第2天时有小幅度的增加,第4天时类黄酮含量与第2天相比有下降趋势,之后的两个贮藏时间点又出现较明显的上升和下降;2 d之后,SNP组的类黄酮含量快速增加,且含量一直高于CK组,至贮藏末期,类黄酮的含量与初始值(1.70 OD325nm/g)相比增加了55.65%。整个贮藏期内,SNP处理扁豆类黄酮含量总体极显著高于对照组扁豆(P<0.01)。
2.6 SNP处理对扁豆内源代谢酶活力的影响
PPO和POD作为苯丙烷代谢途径末端的两个氧化酶,参与果蔬酶促褐变反应,可以氧化果蔬中酚类物质形成褐色物质。如图6A所示,在贮藏期间,两组PPO活力呈现先升高后降低的趋势,在0~2 d时,CK组和SNP组的PPO活力缓慢上升,两组的变化趋势相近且差异不显著,在贮藏至第4天,扁豆的PPO活力出现峰值,此时对照组和SNP组PPO活力分别为14.40 U/(g·min)和9.13 U/(g·min)。如图6B所示,CK组的POD活力一直处于上升趋势,而SNP组的POD活力呈先升后降的趋势,CK组在4 d之后上升速率加快,第8天时POD的活力由初始值的14.42 U/(g·min)达到28.47 U/(g·min),SNP组贮藏前6 d POD活力呈上升趋势,但变化不明显,第8天时有小幅度的下降,且整个贮藏期间SNP处理极显著抑制了扁豆POD活力(P<0.01)。
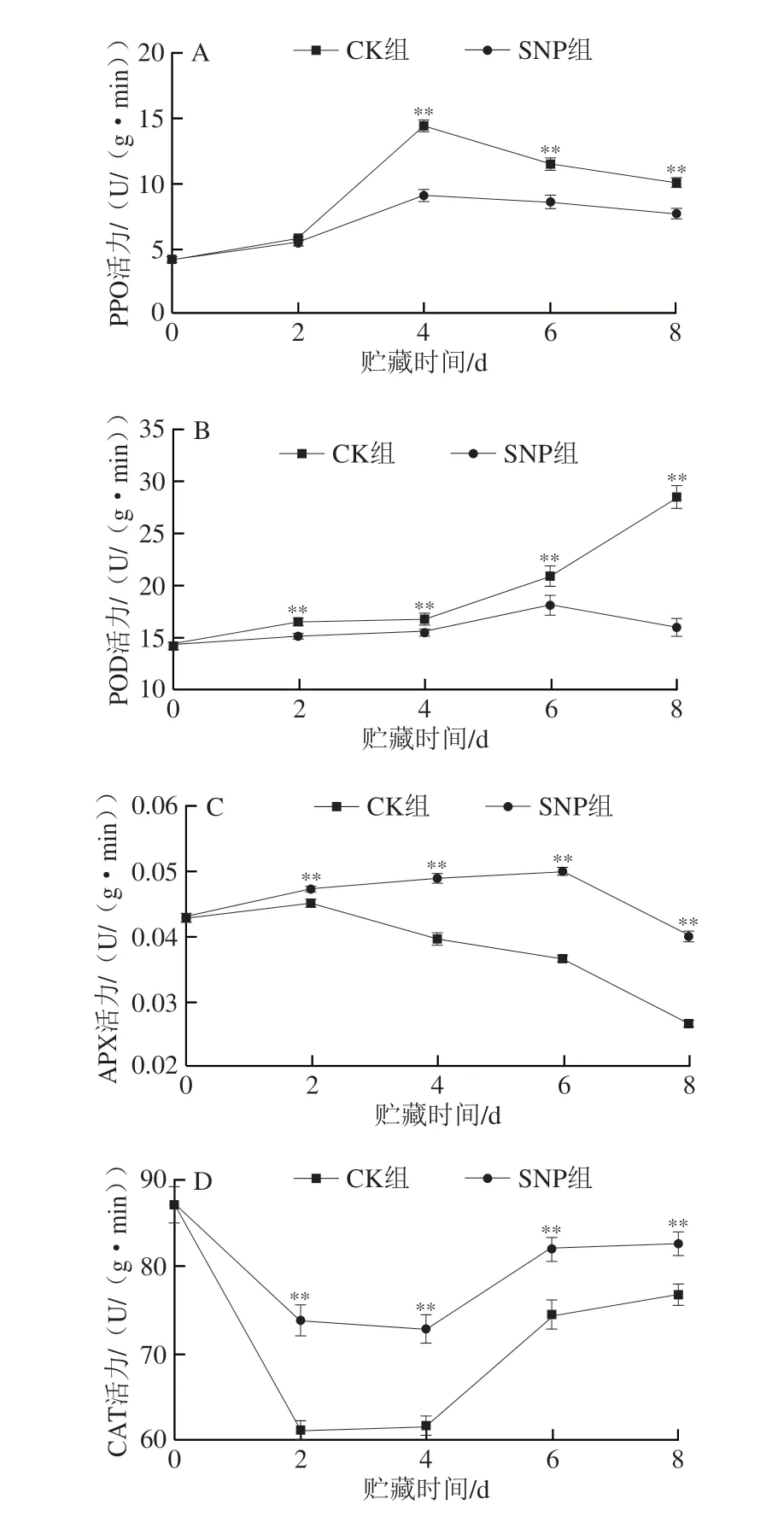
图6 SNP处理对扁豆贮藏过程中PPO(A)、POD(B)、APX(C)、CAT(D)和PAL(E)活力的影响Fig.6 Effect of SNP treatment on the PPO (A),POD (B),APX (C),CAT (D) and PAL (E) activities of hyacinth bean during storage
APX和CAT是果蔬体内重要的抗氧化酶类,可以有效地清除果实代谢过程中产生的活性氧,使活性氧维持在一个较低的水平,从而防止活性氧引起的膜脂过氧化及其他损伤,延缓果蔬的成熟衰老[27-28]。贮藏期间扁豆的APX活力先升后降(图6C),CK组扁豆的APX活力在第2天就开始下降,峰值为0.045 U/(g·min),2 d之后APX活力迅速下降,贮藏终点值较峰值下降了41.06%,SNP组的APX活力则是缓慢上升到第6天才开始下降,在峰值时的APX活力达到0.05 U/(g·min)。CAT活力呈现先降低后升高的变化趋势(图6D),在贮藏前两天CK组和SNP组的CAT活力都大幅度下降,分别下降了29.68%和15.25%,CK组从第2天开始上升,SNP组则是从第4天开始呈上升趋势,第8天时两组CAT活力的上升都趋于平缓。综上,SNP处理能够很好地维持APX和CAT活力。
PAL参与类黄酮的合成,在植物生长发育、果色形成、抗病、抗逆等方面发挥着重要作用,此外,PAL还可以诱导苯丙烷的生物合成,以应对生物和非生物胁迫,如病原体攻击、机械损伤、紫外线照射和光照等[29]。贮藏期间扁豆的PAL活力呈现先下降后上升的趋势(图6E),在贮藏前两天,对照组和SNP组的PAL活力略微下降,CK组和SNP组PAL活力最低时分别为0.166 U/(g·min)和0.176 U/(g·min),随后的贮藏期PAL活力开始逐渐上升,第8天时CK组和SNP组较最低值分别上升了14.55%和14.42%。贮藏期间,SNP组的PAL活力始终极显著高于对照组(P<0.01),说明SNP浸泡处理能够很好地维持PAL活力。
3 讨论
扁豆是呼吸跃变型蔬菜,采后贮运过程中容易出现成熟衰老现象严重影响了扁豆的市场价值。目前已经有许多研究表明NO可以通过调控抗氧化酶活性来达到延缓果蔬成熟衰老的目的,从而改善采后品质、延长货架期。本研究发现,与CK相比,SNP处理显著降低了腐烂率和锈斑率(图1),对色泽和叶绿素含量(图2)、硬度(图3b)、TSS质量分数(图4)都有较好的保持效果,这与范林林[15]、王云香[30]、Zhang Ruining[31]等的研究结果基本一致。腐烂和锈斑是豆类蔬菜最明显的外观劣变特征,其中锈斑的产生与PPO和POD密切相关。PPO和POD协同参与果蔬的酶促褐变反应,对扁豆荚面锈斑的产生有一定的影响,Zhang Ruining等[31]认为PPO和POD是与酚类代谢和水果褐变有关的重要酶,它们能够催化水果中的酚类氧化并将其转化为醌类,从而导致水果褐变,而NO可能抑制了PPO和POD的活性,这与本研究中PPO和POD活力(图6A、B)的分析结果相符。PAL是一种与植物抗病相关的重要防御酶,PAL活性的增加可能会增强果蔬对病原体感染的抵抗力,这与延缓果蔬腐烂和衰老密切相关,同时PAL作为催化苯丙烷代谢第一步反应的酶,与酚类物质的合成密切相关[32]。而总酚和类黄酮作为果蔬中的非酶抗氧化成分,与果蔬的成熟衰老、组织褐变、抗逆性等密切相关,是酶促褐变的关键底物[6,33]。本研究中,SNP处理能显著促进PAL活力(图6E)和总酚、类黄酮(图5)含量的增加,因此推测PAL活性的增强可以加速总酚、类黄酮等苯丙烷次生代谢产物产生,增强果实的抗逆性,进而抑制果实的褐变[34]。
有研究表明NO处理可以通过调节酶活性清除果蔬体内的活性氧(reactive oxygen species,ROS)来延缓其成熟衰老进程、抑制乙烯的生物合成[35]。CAT和APX是果蔬体内重要的抗氧化酶,可以参与ROS的代谢过程或者直接作为ROS清除剂,对果蔬的生理代谢起到调节的作用,从而达到延缓果蔬成熟衰老的目的。Zhao Yating等[28]采用NO处理延缓冬枣采后衰老,结果表明NO处理可通过维持较高水平的CAT和APX等相关ROS清除酶活性来提高ROS清除能力,从而抑制膜脂过氧化以及膜功能的丧失,最终延缓果实衰老过程,这与本实验中SNP处理扁豆所得到的结果一致(图6C、D)。细胞膜完整性和功能的丧失是脂质过氧化的结果,也是导致果实采后衰老的主要因素,而衰老应激下的结构和功能障碍及ROS过度积累与MDA有关[28,36]。脂质过氧化反应会产生MDA,而MDA的积累又会促进这一进程,从而破坏膜的正常功能,Shabanian等[37]研究SNP处理菊花得到了类似的结果。此外,因为细胞膜结构的破坏会导致PPO和POD更容易氧化处于液泡中的酚类物质,因此推测,MDA含量的变化与果实褐变和果实硬度也有一定的关联[34]。本研究中,SNP处理扁豆中MDA的积累受到抑制,这与前人的研究结果相符合。
4 结论
本实验采用外源NO处理扁豆,结果发现外源NO处理可以有效抑制扁豆的腐烂和锈斑产生,对扁豆的色泽和叶绿素含量有较好的保持作用,一定程度上可以抑制MDA的积累从而保持豆荚的硬度,对TSS的降解有一定的抑制作用,经SNP处理的扁豆类黄酮和总酚的含量也相对较高,此外,SNP处理还抑制了POD和POD活性,对PAL、CAT和APX活性则起到提升作用(图7)。综上,0.2 mmol/L SNP处理10 min可以有效延缓扁豆的成熟衰老,延长其货架期。
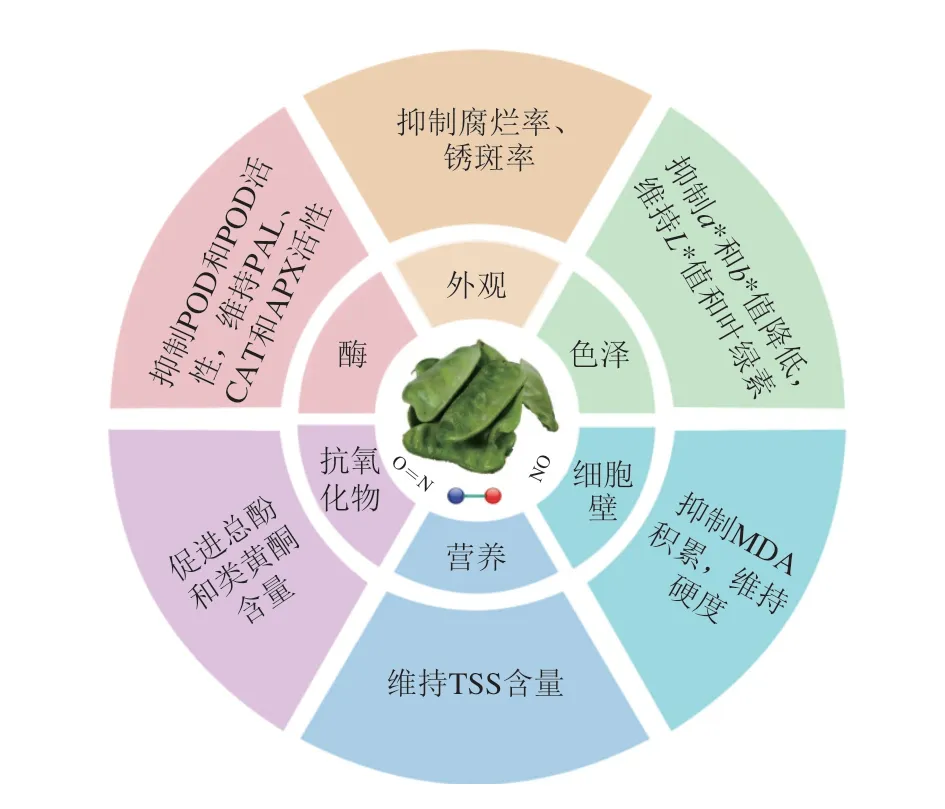
图7 外源NO影响扁豆采后生理特性的总结Fig.7 Summary diagram of effects of exogenous NO on postharvest physiological characteristics of hyacinth bean

