石斛基因组DNA提取方法比较研究
潘映秋 洪亮 卢启寰 李兆奎 夏慧丽


摘 要:目的:比较3种基因组DNA提取试剂盒对提取富含多糖多酚类物质的铁皮石斛和霍山石斛鲜叶及冻叶的提取效果。方法:对提取的DNA进行纯度及产率检测、电泳质量分析及ITS2 PCR扩增效率检测。结果:市售基于蛋白酶K消化法的试剂盒不适用于石斛DNA提取;基于改良CTAB法的试剂盒更适用于需要较高DNA模板量的石斛鲜叶的DNA提取;基于改良SDS法的试剂盒更适用于石斛冻叶的DNA提取,该法提取的鲜叶DNA完整性最佳,更适用于对DNA完整度要求较高的DNA大片段的分析研究。结论:基于改良CTAB法和改良SDS法的试剂盒提取的石斛鲜叶及冻叶的基因组DNA均适用于常规分子检测。
关键词:石斛;DNA提取方法;SDS法;CTAB法
石斛属为兰科植物,约有1 600多种[1],其中铁皮石斛和霍山石斛具有重要的药用和食疗价值,在浙江省、安徽省和云南省等地有着悠久的作为食品原料食用的历史,主要方法为即食、煲汤、入菜、榨汁、泡茶、传统方式泡酒等[2]。雁荡山铁皮石斛、宣城铁皮石斛、武义铁皮石斛、霍山石斛等近年来陆续成为国家地理标志保护产品。石斛种类繁多,多种同属植物形态差异不显著,但价格差距极大,导致铁皮石斛和霍山石斛市场上使用同属植物制成的伪品以次充好、掺假充真的情况屡禁不止[3-4]。因此,灵敏、快速、有效的石斛检测方法,对于规范石斛市场,保护石斛的药用和食用安全尤为重要。
随着分子生物学技术的快速发展,分子鉴伪以其高特异性、高灵敏度等优点在动植物源性成分鉴定中的应用日益广泛,基因组DNA的有效提取是成功开展分子鉴定的前提[5-6]。植物基因组DNA提取方法有很多,但不同植物存在多种不同比例的代谢物质,导致了同一提取方法在不同植物中的适用性存在差异[7-9]。相较其他植物,石斛属植物含有更高比例的多糖、多酚等代谢产物[10],多糖类物质特性类似DNA,在富含多糖的石斛属基因组提取的过程中不可避免地伴随着大量DNA损失,导致DNA产率下降,而酚类物质则可与DNA产生不可逆的结合,增加后续洗脱的黏度,导致DNA纯度下降,影响分子检测中酶的活性,进而导致后续检测的失败[11]。目前,已有不少针对石斛基因组DNA提取方法的研究报道,主要为建立在SDS法和CTAB法基础上的改良SDS法和改良CTAB法[12-14]。但这些方法需要自行配置多种溶液、耗时长、操作繁琐,同一方法经不同实验室改良,相互之间存在操作步骤和使用试剂的差异,无法进行标准化操作[15-17]。此外,大部分研究都是选择石斛鲜叶进行核酸抽提,但在实际检测过程中样品可能会涉及冻存甚至反复冻融,不同核酸提取方法对冻融样品的核酸提取效果亦有待研究探讨[18-19]。
目前,市售DNA提取试剂盒技术已非常成熟,经不断的改良,其提取DNA成本大大下降、操作步骤更简便、操作流程更规范、提取效率更高、试剂质量更可控,更能保障DNA提取质量的稳定性和可靠性。鉴于石斛DNA抽提受多糖、多酚等影响的特殊性且样品保存过程中可能会存在冻融情况,本研究以铁皮石斛和霍山石斛鲜叶及冻叶为材料,应用3种基于不同原理的DNA基因组提取试剂盒对其进行抽提,比较三者抽提石斛鲜叶和冻叶DNA的能力,旨在为石斛属基因组DNA提取提供更稳定、更便捷、更高效的试验方法,有助于為后续分子生物学研究提供稳定可靠的核酸来源,也为其他同类植物的DNA提取提供参考。
1 材料与方法
1.1 试剂与材料
1.1.1 主要试剂 基因组DNA小量制备试剂盒(UElandy)、新型快速植物基因组DNA提取试剂盒(Bioteke)、植物基因组DNA提取试剂盒(DHelix)、TaqTM Hot Start Version(Takara)、S3大片段卡夹(Bioptic)、S2标准卡夹(Bioptic);ITS2F(5-ATGCGATACTTGGTGTGAAT-3) 、ITS3R (5-GACGCTTCTCCAGACTACAAT-3),引物由生工生物工程(上海)有限公司负责合成。
1.1.2 材料 铁皮石斛和霍山石斛,分别采自浙江乐清和安徽霍山,经台州市药品检验研究院鉴定,取其叶用于DNA抽提。
1.2 仪器与设备
1.2.1 主要仪器 T100 PCR扩增仪(Bio-rad)、Lysera高通量组织研磨仪(Biotage)、Nanodrop One超微量核酸蛋白测定仪(Thermo)、Qsep100全自动核酸蛋白分析仪(Bioptic)、ST8R低温冷冻离心机(Thermo)。
1.3 试验设计
1.3.1 样品处理 取新鲜铁皮石斛和霍山石斛叶各10 g,其中5 g保存于-80℃冰箱备用;另5 g保存于-20℃冰箱,反复冻融3次备用。
1.3.2 DNA提取 分别称取铁皮石斛和霍山石斛鲜叶及冻叶各约100 mg,Lysera高通量组织研磨仪低温冷冻研磨成粉末,用于后续核酸抽提,每种石斛叶3种不同提取方法均制备3份平行样。核酸抽提分别使用UElandy基因组DNA小量制备试剂盒(M1)、Bioteke新型快速植物基因组DNA提取试剂盒(M2)和DHelix植物基因组DNA提取试剂盒(M3),参照试剂盒说明书步骤进行。
1.3.3 DNA纯度及产率检测 取2 μL DNA原液,使用Nanodrop One超微量核酸蛋白测定仪对其浓度进行检测,同时检测其在230、260、280nm处的吸光度,其中A260用于计算DNA浓度;A260/A280比值用于判断提取的DNA中是否含有多糖、蛋白、RNA等杂质;A260/A230比值用于判断提取的DNA中是否残留盐及小分子杂质。按式(1)进一步计算DNA产率。
DNA产率(μg/g)=DNA浓度(μg/μL)×稀释倍数×DNA样品体积(μL)/样品质量(g)(1)
1.3.4 DNA质量检测 根据DNA核酸浓度检测结果,将其稀释至10~20 ng/μL ,使用Qsep100全自动核酸蛋白分析仪,S3大片段卡夹电泳检测分析基因组DNA提取质量。
1.3.5 ITS2 PCR扩增效率检测 以不同方法提取得到的基因组DNA为模板,使用ITS2通用引物[20]进行PCR扩增。反应体系总体积为25 μL,其中 10×PCR Buffer (Mg2+ plus) 2.5 μL、dNTP Mixture (各2.5 mol/L) 1 μL、TaKaRa Taq HS (5 U/μl) 0.3 μL、DNA 10 ~ 50 ng、引物ITS2F和ITS3R各 0.5 μL,水补足至总体积25 μL。PCR扩增程序为:95℃ 预变性5 min;95℃ 20s、61℃ 30s、72℃ 30s,共40个循环;72℃ 延伸 3min。PCR扩增产物使用Qsep100全自动核酸蛋白分析仪S2标准卡夹电泳检测分析。
2 结果与分析
2.1 DNA纯度及产率检测
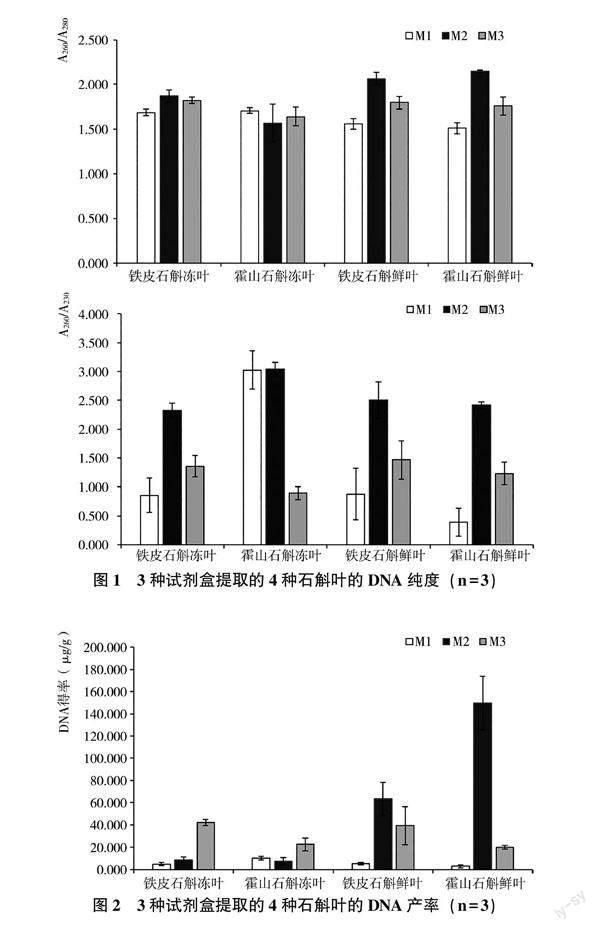
使用Nanodrop One超微量核酸蛋白测定仪对3种试剂盒提取的4种石斛叶进行浓度和纯度的检测,由图1 A260/A280结果可见,3种试剂盒提取的不同石斛叶的DNA所含杂质差别较大,其中M1法多糖、酚类及蛋白污染较为严重,A260/A280均低于1.8;M2法和M3法提取的DNA纯度较M1法更高。高质量的DNA A260/A280应介于1.8~2.0之间,小于1.8说明DNA可能存在多糖、酚类及蛋白污染,大于2.0则说明可能存在RNA污染;A260/A230应大于2.0,小于2.0说明可能存在残留盐及小分子杂质。由图1可见,M1法和M3法提取的DNA存在较多的小分子及盐类杂质,且同种方法在同一样品平行样之间的检测结果差异很大,说明这两种方法去除小分子及盐类杂质效果不理想;M2法提取的DNA纯度更高,提取效果也更稳定。由图2可见,不同方法对不同样品抽提得到的基因组DNA产率差异很大,其中M1法提取的冻叶和鲜叶的DNA产率很低;M2法提取的鲜叶DNA产率显著高于冻叶,其鲜叶DNA产率高于M1和M3法,而冻叶DNA产率则低于M3法;M3法提取的鲜叶DNA和冻叶DNA产率较为稳定,其中冻叶DNA产率较M1法和M2法更高,但鲜叶DNA产率低于M2法。
2.2 DNA质量检测
电泳可用于简便鉴定和评估抽提的DNA完整性,通过电泳图谱可以判断DNA有无降解及降解程度,在1 000bp以上观察到的主带越清晰,说明DNA完整性越好;若DNA在整条泳道中呈弥散状态,则说明DNA发生了降解。由图3可见,3种方法提取的冻叶DNA均存在较为严重的降解,且条带强度均偏弱,说明反复冻融对基因组DNA完整性破坏较大。M1法提取的鲜叶和冻叶DNA受提取效率低的影响,条带偏弱,且均存在不同程度的降解;M2法提取的鲜叶DNA也发生了一定程度的降解;M3提取的鲜叶DNA在1 000 bp以上可观察到清晰的主带,表明其提取的DNA完整性优于M1法和M2法。
2.3 ITS2 PCR扩增检测
以不同提取试剂盒提取的DNA为模板,对石斛ITS2区进行扩增(目标片段大小约为500bp),检测其扩增效果。如图4所示,M1提取的扩增条带均弱于M2和M3法,且部分样品无法检测到清晰擴增条带;M2法和M3法提取的冻叶和鲜叶DNA均可扩增得到清晰的ITS2目标条带,表明这两种方法抽提得到的DNA可用于后续分子检测。
3 结论与讨论
基因组DNA提取是分子生物实验的第一个环节,快速有效地提取DNA核酸是开展后续各种分子检测的前提和基础[21]。本研究比较了3种不同原理的基因组DNA提取试剂盒对富含多糖多酚类物质的石斛鲜叶和冻叶的提取效果。其中M1法使用的是基因组DNA小量制备试剂盒(UElandy),其原理是通过蛋白酶K消化去除蛋白杂质后,使用硅胶材质和高盐低pH值的结合膜柱过滤法进行DNA纯化抽提,最后应用低盐高pH值的洗脱液洗脱DNA;M2法使用的是新型快速植物基因组DNA提取试剂盒(Bioteke),该试剂盒是基于改良CTAB法前处理后,硅胶膜过柱纯化并洗脱得到DNA;M3法使用植物基因组DNA提取试剂盒(DHelix),该试剂盒原理是对样品进行SDS/KAC 前处理后,使用硅胶柱纯化洗脱得到DNA。
试验结果表明,基于蛋白酶K消化的M1试剂盒提取的石斛基因组DNA纯度、产率和后续PCR扩增效果均较差,不适用于富含多糖多酚类样品的核酸抽提。基于改良CTAB法的M2试剂盒提取的石斛基因组DNA纯度和产率均较高,特别是石斛鲜叶的DNA产物显著高于其他两种方法,更适用于需要较高DNA模板量的富含多糖多酚类的鲜叶样品。基于改良SDS法的M3试剂盒提取的石斛基因组DNA纯度较高,产率适中,其对冻叶DNA的提取产率较M1和M2法更高,更适用于富含多糖多酚类冻叶样品的核酸抽提;M3法提取的鲜叶DNA完整性最佳,更适用于后续对DNA完整度要求较高的大片段分析研究。M2法和M3法提取的石斛鲜叶及冻叶的基因组DNA均适用于后续常规分子检测。
通过比较3种基因组DNA提取试剂盒对铁皮石斛和霍山石斛鲜叶及冻叶的提取效果,发现虽然冻叶提取的DNA产率较低且降解较为严重,但在条件受限无法获得新鲜样品时候,仍可用于不涉及大片段DNA分析的常规分子检测;市售基于改良CTAB法和改良SDS法的试剂盒适用于石斛基因组DNA的抽提,其实验流程规范、操作简便、质量可控、易推广使用,提取的DNA能够满足后续分子实验要求,可推广应用于含多糖多酚类样品的基因组DNA提取。
参考文献
[1]XU X,ZHANG C,WANG N,et al. Bioactivities and Mechanism of Actions of Dendrobium officinale:A Comprehensive Review[J].Oxid Med Cell Longev,2022,2022:6293355.
[2]吕露阳,张志锋,王庆颖,等. 全草类药食同源中药安全性评价研究进展[J].中草药,2021,52(15):4722-4730.
[3]ZHU S,NIU Z,XUE Q,et al. Accurate authentication of Dendrobium officinale and its closely related species by comparative analysis of complete plastomes[J].Acta Pharm Sin B,2018,8(6):969-980.
[4]DONG X,JIANG C,YUAN Y,et al. Application of high-resolution melting analysis for authenticity testing of valuable Dendrobium commercial products[J].J Sci Food Agric,2018,98(2):549-558.
[5]FENG S,JIANG Y,WANG S,et al. Molecular Identification of Dendrobium Species (Orchidaceae) Based on the DNA Barcode ITS2 Region and Its Application for Phylogenetic Study[J].Int J Mol Sci,2015,16(9):21975-21988.
[6]景晓彤,黄勇,黄玉婷,等. 中成药DNA提取方法的研究进展[J].中国医药科学,2021,11(19):47-50.
[7]张馨元,赵超越,侯和胜,等. 4种中药材DNA提取方法的比较[J].中国生化药物杂志,2015,35(7):17-21.
[8]罗焜,马培,姚辉,等. 中药DNA条形码鉴定中的DNA提取方法研究[J].世界科学技术(中医药现代化),2012,14(2):1433-1439.
[9]王艳,成金乐. 改进的CTAB法提取32种中药破壁饮片DNA及物种鉴定[J].中国中医药现代远程教育,2018,16(22):89-91.
[10]张妙彬,潘丽晶,范干群,等. 富含多糖的转基因石斛基因组DNA提取方法(英文)[J].分子植物育种,2009,7(1):209-214.
[11]崔光红,唐晓晶,黄璐琦. 含淀粉及多糖类中药材DNA的提取方法研究[J].中国中药杂志,2006(16):1365-1367.
[12]肖鲲,葛晓军,李小琼,等. 改良CTAB法提取石斛总DNA[J].贵阳医学院学报,2007(2):213-214.
[13]李静,尹俊梅,任羽,等. SDS法提取石斛基因组DNA的研究[J].热带农业科学,2009,29(12):22-26.
[14]吴欣仪,陈建兵,陈利君,等. 一种利用改良CTAB法提取铁皮石斛茎基因组DNA的方法[Z].202211.
[15]向红先. 一种铁皮石斛基因组DNA的提取方法[Z].20196.
[16]林江波,王伟英,邹晖,等. 一种微量、高质量铁皮石斛基因组DNA提取方法[Z].20206.
[17]吴冬晴. 一种铁皮石斛基因组DNA的高效提取方法[Z].20208.
[18]包英华,白音,谭庆辉,等. 美花石斛基因组DNA提取方法的比较[J].热带亚热带植物学报,2007(2):147-151.
[19]郑云柯,胡翔宇,宋希强,等. 石斛属植物基因组DNA提取方法的对比[J].热带生物学报,2015,6(2):168-172.
[20]国家药典委员会. 中华人民共和国药典-四部[M].北京:中国医药科技出版社,2020.
[21]ZHENG K,CAI Y,CHEN W,et al. Development,Identification,and Application of a Germplasm Specific SCAR Marker for Dendrobium officinale Kimura et Migo[J].Front Plant Sci,2021,12:669458.
Comparison Study on Genomic DNA Extraction Methods for Dendrobe
PAN Ying-qiu,HONG Liang,LU Qi-huan,LI Zhao-kui,XIA Hui-li
(Taizhou Key Laboratory of Drug Composition and Adulteration Identification Technology,
Taizhou Food Inspection and Testing Center/Taizhou Institute of Drug Inspection,Taizhou 318000,China)
Abstract:ObjectiveTo compare the effectiveness of three kinds of genomic DNA extraction kits for fresh and frozen leaves of Dendrobium officinale and Dendrobium huoshanense rich in polysaccharides and polyphenols.MethodDNA purity and yield tests,DNA electrophoresis quality analysis,and ITS2 PCR amplification efficiency were analyzed. ResultThe commercially available kit based on proteinase K digestion was not suitable for dendrobe DNA extraction. The modified CTAB-based kit was more suitable for extracting DNA from fresh leaves requiring a higher template amount,while the modified SDS-based kit was more suitable for extracting DNA from frozen leaves,producing the highest quality fresh leaf DNA for experiments requiring high DNA integrity. ConclusionThe kits based on the modified CTAB Method and SDS Method were both suitable for conventional molecular detection of dendrobe genomic DNA from fresh and frozen leaves.
Keywords:dendrobe; DNA extraction method; SDS Method;CTAB Method
基金項目:浙江省市场监督管理局科研计划项目(项目编号:20210174)。
作者简介:潘映秋(1983—),女,硕士,主管药师,研究方向:食品药品质量安全检验检测。
通信作者:夏慧丽(1978—),女,博士,正高级工程师,研究方向:食品药品质量控制与风险评价。

