喉癌患者细胞凋亡抑制蛋白1的表达情况及预后影响因素▲
刘 婷 钱雅琴 宋若会 朱 玲
(1 合肥市第八人民医院耳鼻喉科,安徽省合肥市 238000;2 安徽中医药大学第一附属医院肿瘤科,安徽省合肥市 230000)
喉癌是临床上常见的一种原发于喉部的恶性肿瘤,以鳞状细胞癌最为常见[1]。目前研究认为,吸烟、饮酒、环境污染、病毒感染、放射线、性激素代谢紊乱、基因突变等是喉癌的致病因素[2]。手术、新辅助放化疗等是治疗喉癌的主要方法,其可以在一定程度上改善患者的病情[3],但中晚期喉癌患者治疗后的预后仍较差,病死率高[4]。因此,寻找一种能够早期诊断并预测喉癌患者预后的指标,对临床具有积极意义。细胞凋亡抑制蛋白1(cell-inhibitor of apoptosis protein 1,c-IAP1)是一种细胞凋亡抑制因子,主要存在于细胞核与细胞质中,可通过抑制Caspase-3等蛋白酶的活性来抑制细胞凋亡,促进细胞增殖[5]。研究发现,c-IAP1参与了多数恶性肿瘤的发生和发展[6],但c-IAP1对喉癌患者预后的预测价值如何,目前鲜见报告。为此,本研究通过检测喉癌患者癌组织与癌旁组织中c-IAP1的表达情况,分析c-IAP1表达水平与喉癌病理分级的关系,探讨c-IAP1对喉癌患者预后的预测价值,为临床研究提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2014年1月至2015年12月合肥市第八人民医院收治的60例喉癌患者的临床资料。其中男性54例、女性6例;年龄41~70(65.87±10.28)岁。纳入标准:(1)已被确诊为喉癌,经病理检查证实为鳞状细胞癌,分化程度明确;(2)临床病历资料信息完整;(3)喉癌组织与癌旁组织标本保存完好。排除标准:(1)合并感染性疾病、神经系统性疾病;(2)合并心、肝、肾等重要器官疾病;(3)失访;(4)术前接受过放疗、化疗、靶向治疗或其他抗肿瘤药物治疗。
1.2 方法
1.2.1 收集资料:收集所有研究对象的临床资料及术后5年的随访记录,包括性别、年龄、吸烟指数(每天吸烟支数×吸烟年数)、肿瘤大小、肿瘤部位、组织学分级、淋巴结转移情况、T分期、TNM分期及预后情况(将随访终点事件为复发或死亡判定为预后不良,无复发或死亡判定为预后良好)。
1.2.2 c-IAP1表达情况检测:从病理科获取患者术中喉癌组织与距离癌组织5 cm的癌旁组织标本,常规石蜡包埋组织后切片,采用免疫组织化学的ABC法检测c-IAP1的表达情况。具体步骤如下:将固定好的切片放在切片架上并置于46 ℃烤片机中,20 min后取出,再将切片依次置于二甲苯Ⅰ、二甲苯Ⅱ、二甲苯Ⅲ中,各10 min,取出后再依次置于100%酒精Ⅰ、100%酒精Ⅱ、95%酒精、80%酒精、70%酒精中,各2 min,取出后放入蒸馏水中2 min,并使用0.01 mol/L的PBS冲洗3次,2 min/次。将脱蜡、水化后的载玻片放入3%的过氧化氢中,室温条件下孵育10 min,阻断内源性过氧化物酶的活性,取出载玻片后使用0.01 mol/L的PBS冲洗3次,2 min/次。进行抗原热修复后使用0.01 mol/L的PBS冲洗3次,2 min/次。然后在切片上滴加按1 ∶100比例稀释的兔抗人c-IAP1,置于4 ℃冰箱孵育过夜,取出后再置于37 ℃电热恒温培养箱复温45 min,取出后用0.01 mol/L的PBS冲洗3次,2 min/次。再分别滴加增强剂、二抗、二氨基联苯胺显色后,置于显微镜下观察细胞染色情况。在400倍光学显微镜下,c-IAP1阳性表达的细胞呈棕黄色,阳性反应颗粒主要位于细胞核与细胞质中。随机选择8个视野,每个视野观察100个细胞,计数阳性细胞。根据观察结果对阳性细胞进行评分,其中阳性细胞数为0时不计分,阳性细胞数占比≤25%记1分,占比为26%~50%记2分,占比为51%~75%记3分,占比>75%记4分。同时对细胞染色强度进行评价,无着色记0分,浅黄色记1分,棕黄色记2分,棕褐色记3分。将阳性细胞评分与细胞染色强度评分相加作为c-IAP1表达情况的判断标准,其中0~3分为低表达,4~7分为高表达[7]。
1.3 统计学分析 采用SPSS 19.0软件进行统计学分析。计数资料以例数和百分比表示,组间比较采用χ2检验;正态分布的计量资料以(x±s)表示,组间比较采用两独立样本t检验或方差分析;采用多因素COX回归模型分析喉癌患者预后的影响因素。以P<0.05为差异具有统计学意义。
2 结 果
2.1 喉癌组织与癌旁组织中c-IAP1表达情况的比较 喉癌组织中c-IAP1高表达率为73.33%(44/60),低表达率为26.67%(16/60)。癌旁组织中c-IAP1高表达率为6.67%(4/60), 低表达率为93.33%(56/60)。喉癌组织中c-IAP1高表达率高于癌旁组织(χ2=50.562,P<0.001)。
2.2 不同预后患者喉癌组织中c-IAP1表达情况的比较 至随访终点,60例患者中有26例(43.33%)复发、16例(26.67%%)死亡,且死亡患者在随访终点前均经相关检查证实为肿瘤相关性死亡,最终本组病例中,预后不良42例(70.00%,42/60),预后良好18例(30.00%,18/60)。复发患者中c-IAP1高表达率为84.62%(22/26),c-IAP1低表达率为15.38%(4/26);死亡患者中c-IAP1高表达率为100%(16/16),c-IAP1低表达率为0。预后不良患者喉癌组织c-IAP1高表达率高于预后良好患者(χ2=21.039,P<0.001)。见表1。

表1 不同预后患者喉癌组织中c-IAP1表达情况的比较[n(%)]
2.3 影响喉癌患者预后的单因素分析 单因素分析结果显示,不同肿瘤大小、肿瘤部位、组织学分级、淋巴结转移情况、临床分期、吸烟指数的喉癌患者预后不良发生率比较,差异均具有统计学意义(均P<0.05);不同性别、年龄的喉癌患者预后不良发生率比较,差异均无统计学意义(均P>0.05),见表2。
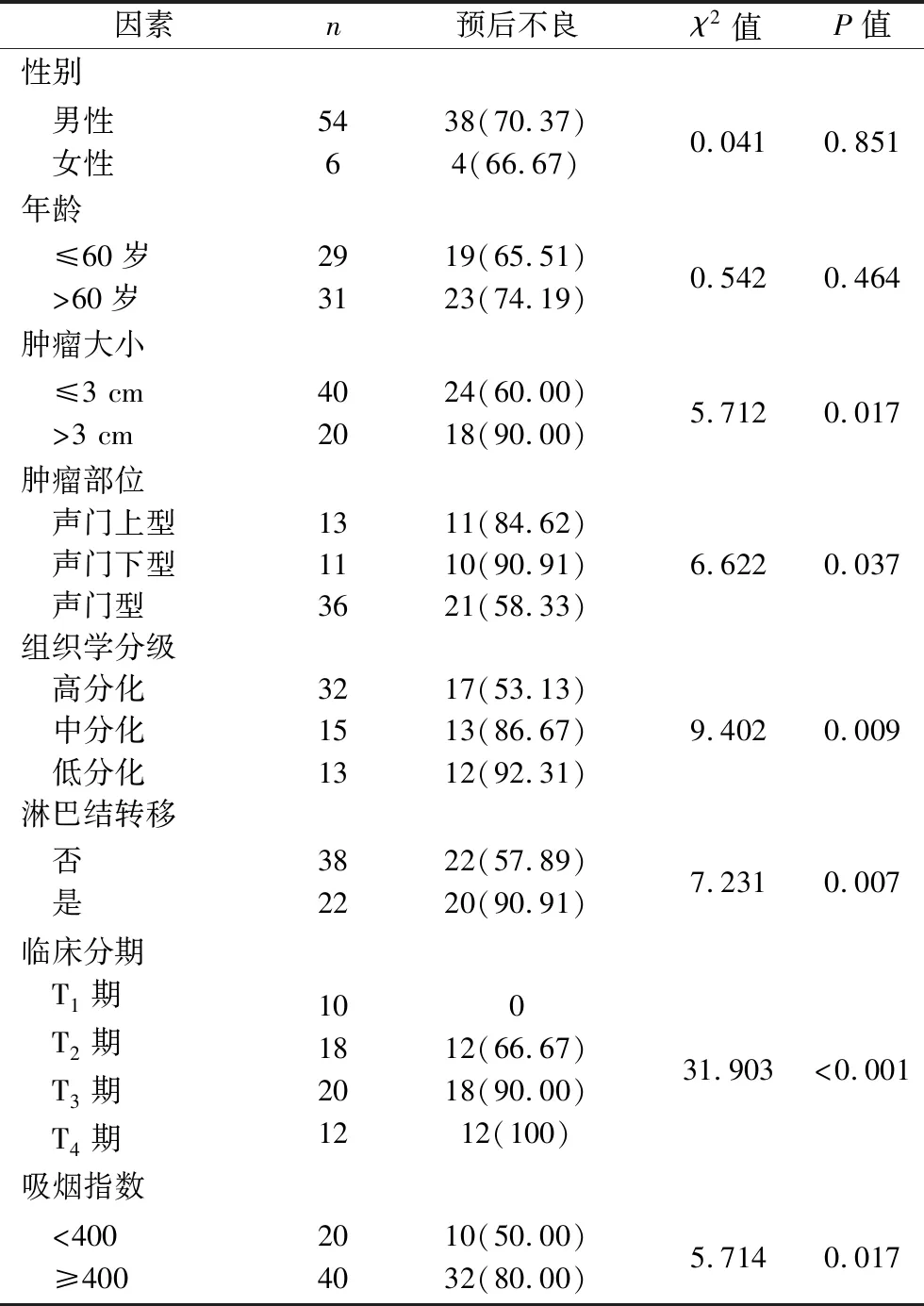
表2 影响喉癌患者预后的单因素分析[n(%)]
2.4 影响喉癌患者预后的多因素分析 以患者预后情况为因变量(预后良好=0,预后不良=1),以单因素分析中差异有统计学意义的变量及喉癌组织c-IAP1表达情况为自变量,进行多因素COX回归分析,赋值情况见表3。结果显示,喉癌组织c-IAP1表达情况、组织学分级、肿瘤大小、淋巴结转移情况、临床分期是喉癌患者预后的影响因素(均P<0.05),见表4。

表3 自变量的赋值情况

表4 影响喉癌患者预后的多因素COX回归分析
3 讨 论
喉癌是临床常见的恶性肿瘤之一,主要以鳞状细胞癌为主,患者常伴有声嘶、呼吸困难、吞咽困难等临床症状,严重影响其健康与生活质量。目前,治疗喉癌的方式主要有手术、放化疗、分子靶向治疗等[8-9],其中手术切除是首选方式之一,在尽可能保留喉功能的情况下彻底切除肿瘤组织。但肿瘤过大、机体情况较差、术后不配合放化疗的患者,局部复发率较高[10-13]。寻找可以早期诊断、评估预后的生物学标志物对提高喉癌患者疗效,改善预后有重要意义。
正常的细胞凋亡是机体消除有害细胞[14]、防止细胞过度增殖[15]的一种生理过程,而细胞凋亡的调控是机体维持正常细胞更新与增殖的关键[16]。c-IAP1是凋亡抑制蛋白家族中的重要成员之一,是一种具有抗凋亡活性的蛋白质,主要通过抑制Caspase活性及参与调节核因子κB的作用来抑制细胞凋亡[17]。已有研究表明,c-IAP1在肝癌组织、宫颈癌组织等组织中均呈高表达,且c-IAP1高表达与肿瘤的TNM分期、淋巴结转移情况、组织学分级等因素密切相关[18]。本研究结果显示,喉癌组织中c-IAP1高表达率高于癌旁组织,提示c-IAP1可能参与了喉癌的发生。还有研究表明,喉癌组织中c-IAP1阳性表达率高于癌旁组织,且其表达水平与病情严重程度呈正相关[19],本研究结果也发现,预后不良患者喉癌组织中c-IAP1高表达率高于预后良好患者(P<0.05),说明c-IAP1参与了喉癌的发生与进展,且可能与患者预后有关。
死亡受体通路、线粒体通路、内质网通路是细胞凋亡的三条通路,三者关系密切[20],并与p53、B细胞淋巴瘤2家族、凋亡抑制蛋白家族、胞内信号转导构成复杂的网络,精细调控细胞凋亡通路;而c-IAP1可通过抑制Caspase家族成员介导的蛋白酶级联反应抑制上述三条凋亡通路的表达[21]。当c-IAP1在肿瘤组织中呈高表达时,肿瘤细胞凋亡被抑制,细胞的增殖与凋亡平衡被打破,肿瘤细胞寿命延长、数量增加、生长迅速,导致预后不良。本研究的COX回归分析结果也显示,c-IAP1表达情况、组织学分级、肿瘤大小、淋巴结转移情况、临床分期是影响喉癌患者预后的影响因素(均P<0.05)。提示c-IAP1表达情况或可用于喉癌患者的预后评估。
综上所述,喉癌患者癌组织中c-IAP1阳性表达率升高,喉癌组织c-IAP1表达情况、组织学分级、肿瘤大小、淋巴结转移情况、临床分期是影响喉癌患者预后的影响因素。检测喉癌组织中c-IAP1的表达情况对评估喉癌患者预后具有一定的指导意义。

