氢氟酸对发酵前后玉米秸秆有机质结构的影响
宋鑫,胥汉杰,雷梣岑,张玉,李芳芳*
(1.昆明理工大学环境科学与工程学院,昆明 650500;2.云南省土壤固碳与污染控制重点实验室,昆明 650500)
土壤有机质(Soil organic matter,SOM)是由不同降解程度的植物、动物以及微生物残余物组成的混合有机体系[1]。植物残体包含多种生物分子组成,如纤维素、半纤维素、木质素、蛋白质、脂质和单宁酸[2]。在这些植物源性分子中,木质素通常被认为是植物向土壤输入有机碳的关键来源,其对于SOM 的积累具有重要作用[3]。植物凋落物和土壤沉积物中许多有机质的组成信息来自于分子水平上对特定植物或微生物成分的化学分析[4]。木质素单体结构特征显著、性质较稳定,在土壤中周转时间较长,因而常被用作分子生物标志物来示踪土壤有机质的来源、降解和积累[5]。目前,木质素主要包含三类单体:V 代表香草基单元体,S 代表紫丁香基单元体,C 代表肉桂基单元体[6]。研究中常用碱性氧化铜水解法将木质素分解成其基本单元,再借助这些化合物的比值来示踪SOM 的降解和来源,例如,木质素单体V 和单体S 中对应的酸和醛的比值增加表明其侧链氧化程度增加[7-9]。然而近些年来,研究者发现木质素的化学稳定性及其难降解性被过分高估。在SOM 稳定机制中,更多的研究指向矿物对SOM 保护的重要性[10-11]。值得注意的是,SOM 与矿物结合形成的有机无机复合体,虽然提高了SOM 的稳定性,但这可能会使得结合态有机质的提取变得更为困难,甚至导致这部分有机质无法被萃取和检测,从而干扰了稳定SOM 的定性及定量分析[12]。
在过去的几十年中,由于铁铝氧化物等磁性矿物会阻碍仪器测定的灵敏度,因此,研究者常用2%或者10%的氢氟酸(HF)作为核磁共振碳谱(13C NMR)分析固态有机质结构组成和分子生物标志物时的前处理试剂[12-13]。HF 处理土壤样品或者污泥沉积物可以消除磁性矿物的干扰,释放出更多有机碳,进而提高SOM 中官能团在13C NMR 谱图中的响应和分子生物标志物的提取率[13-14]。另外,在HF 处理过程中,有机质结构也可能被改变,从而不再具备原始有机质的代表性[15]。HF 处理是浓缩复杂地质体中有机物的重要实验方法,对于环境样品的生物标志物、核磁共振等表征检测都有重要的意义。但HF处理对于有机质结构的影响尚不清楚。研究表明,3 种不同种类的木质素和针铁矿吸附后,盐酸处理提取到的木质素的酸醛比[(Ad/Al)s、(Ad/Al)v]显著增加,来源参数S/V、C/V没有发生改变,说明侧链氧化程度增加,但SOM 的母源结构没有变化[16]。然而,Rumpel等[17]指出不同浓度的HF 处理后土壤中木质素分子组成发生了变化,(Ad/Al)v、(Ad/Al)s升高,S/V降低,表明经过HF处理后木质素的氧化程度更高,丁香基酚含量降低。此外,也有研究报道矿物去除后木质素的来源参数没有发生改变,但是木质素大量流失[18-19]。这些争议是因为以往研究主要关注于酸洗前后固体组成的变化而缺失了酸洗液中有机质信息。酸处理一方面可能是HF溶解了矿物,导致部分极性强的SOM 的释放,如氧化程度高的木质素片段溶于水,另一方面可能是HF 水解了蛋白、多糖等特定SOM 的结构,使更多小分子有机物溶出,这可能依赖于SOM的组成和性质差异。
有机碳的积累和分解不仅取决于其含量,还取决于有机碳的化学成分,反过来化学组分又控制着有机碳的功能[20]。因此,本研究采用微生物发酵前后的玉米秸秆模拟土壤中降解程度不同的有机质,再用不同浓度(0、2%、10%)的HF 对其进行酸处理,借助13C NMR 和木质素分子生物标志物信息,识别HF 处理后不同降解程度有机质组成和性质的变化,并直接证明HF能否改变有机质的结构,同时结合元素分析、傅里叶红外光谱(FIRT)和稳定碳同位素比值判断HF对碳分馏的影响,从而综合判断不同浓度HF 处理后固体和酸洗液中木质素结构的变化情况,为土壤中木质素,特别是矿物保护强的木质素的提取提供理论支撑。
1 材料与方法
1.1 样品处理及保存
本实验按照菌剂∶葡萄糖∶水=1∶5∶100(m∶m∶m)的比例配制发酵液,发酵液静置6~8 h,等待微生物充分激活后,将发酵液逐层均匀喷洒在玉米秸秆上,控制发酵原料湿度在50%~60%,然后用泡沫箱子密封发酵20 d左右,得到发酵后的玉米秸秆[21]。将发酵完成后的玉米秸秆样品采集回实验室,玉米秸秆样品自然风干后于60 ℃下烘干。再将样品研磨粉碎,过20目筛。为了满足表征的需求,取少量样品进一步过70目筛。样品均避光保存在常温下,待下一步实验。
1.2 HF预处理
称取一定质量的发酵前后的玉米秸秆于离心管中,并按照样品和酸液1∶2(m∶V)的比例加入配制好的HF 溶液,拧紧瓶盖,放入摇床中,每隔2 h 离心1次,设置离心机参数4 000 r·min-1,15 min,离心后收集上清液,再重新加入酸溶液重复洗6~7 次,同时收集保存酸洗液[22]。HF 的配制:以10%HF 溶液为例,加250 g 的浓HF(40%质量浓度的HF 溶液),750 g 去离子水制成1 kg 酸溶液。将发酵前的固体玉米秸秆有机质命名为BS;发酵前的酸洗液命名为BL;发酵后的固体玉米秸秆有机质命名为AS;发酵后的酸洗液命名为AL。
将收集到的上清液依次倒入存放有活化好的XAD-8、XAD-4 离子交换树脂的试管中。再用甲醇将离子交换树脂中吸附的有机质反向洗脱出来,分别得到疏水有机质和过渡亲水有机质,最后将洗脱液一起倒入活化好的阳离子交换树脂试管中,再吸附其中的阳离子,收集流出后的溶液[23],进行蒸发、冷冻干燥,得到的样品用于后续表征。
1.3 实验方法
元素分析测定:所有固体样品研磨过70 目筛,使用元素分析仪专用的锡舟,加入2.0 mg 左右的样品,将包好的样品放入元素分析仪中进行样品测定。将氦气和氧气阀门分别打开,均调至250 kPa,确保氦气流量为140 mL·min-1,氧气流量为100 mL·min-1。选择CHNS 模式(燃烧炉和还原炉温度分别为950 ℃和1 060 ℃)测定C、H、N、S 的含量,选择O 模式(燃烧炉温度在1 060 ℃)测定O的含量。
FTIR 测定[24]:将干燥的样品和溴化钾按照1∶200(m∶m)的比例在玛瑙研钵中磨碎压片,然后用压片机再进行压片,取出放入仪器(Varian 640-IR)的测定窗口中,设置扫描波长范围4 000~400 cm-1,以8 cm-1精度扫描20次,以表征样品官能团的性质。
13C NMR 测定[25]:固体样品在600 Hz 核磁光谱(JE⁃OL ECZ600R)下进行核磁扫描,参数设置为x_Freq=150.90 Hz、x_sweep=400 ppm,contact time=3 ms、relax⁃ation dalay=2 s。
木质素的提取:碱性氧化铜水解法[26-27]。称取0.5 g样品于反应釜中,再加入15 mL 2 mol·L-1的氢氧化钠溶液,通氮气0.5 h 除氧,并迅速盖上盖子,在170 ℃烘箱条件下反应2.5 h。冷却后,将上清液转移至离心管中,并在3 500 r·min-1转速下离心15 min。离心后的上清液另外转移到新的50 mL 离心管中,用锡箔纸包好避光,加入6 mol·L-1的盐酸使其pH 调至1 附近,静置1 h。静置后再次离心,取上层清液于分液漏斗中进行萃取,有机相转入锥形瓶中。同时向锥形瓶中加入无水硫酸钠吸水,静置后将锥形瓶中的液体转至圆底烧瓶中,蒸发浓缩至1 mL 左右,用2 mL乙酸乙酯润洗,转移到15 mL 液相瓶,氮吹干后定容,衍生化上机检测。
1.4 GC-MS定量分析
提取的木质素利用气相串联质谱仪(Agilent,GC7890A,MS5975C)进行定量分析。升温程序为:初始温度65 ℃,保持2 min;以6 ℃·min-1的速率上升至300 ℃,并在300 ℃下保持20 min。载气为氦气,进样体积为1 μL,分流比为2∶1。离子源和四极杆温度分别为230 ℃和150 ℃,质量扫描范围为50~650 Da,容积延迟时间为8 min[10]。采用外标法定量。
1.5 数据处理
数据处理采用Excel 2010,制图采用Origin 2020和Excel 2010。本研究使用SPSS 26.0进行单因素分析(One-way ANOVA)。
2 结果与分析
2.1 酸处理下发酵前后玉米秸秆的样品表征
不同浓度HF处理发酵前后的玉米秸秆有机质元素分析见表1。不同浓度HF 处理下,BS 中C 含量基本维持在40%左右。与对照组(0%HF)相比,随着HF 浓度的增加,BS 中N 含量增加17.48%~21.68%,O含量增加8.47%~16.67%,导致其C/N 降低,O/C 增加。与BS相比,AS经不同浓度的HF处理后,N含量明显增加,C含量也有一定幅度增加,导致C/N明显降低。AS中的H含量和O含量在不同浓度HF处理间的变化都不明显,因而O/C 和H/C 的变化不明显。酸洗过程中玉米秸秆质量损失(QS)为19.84%~24.19%,其中0%HF处理有机质的损失更多。
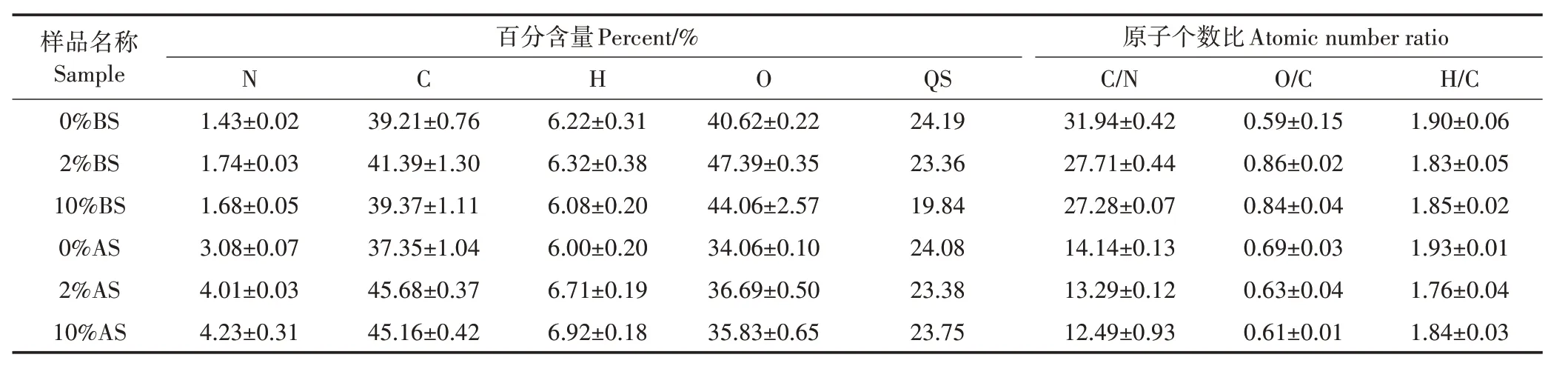
表1 不同酸处理下样品的元素分析Table 1 Elemental analysis of different concentrations HF treatment
为了进一步探究不同浓度HF处理对秸秆有机质结构的影响,本实验借助FITR 和13C NMR 直观分析了有机质的官能团变化,其结果如图1 和图2 所示。与BS 相比,AS 没有产生新的官能团吸收峰,只是吸收峰强度存在差异。不同浓度HF 处理后,固体样品和酸洗液中的有机质官能团存在差异,固体样品有机质在3 290 cm-1和1 560 cm-1附近振动,有机质主要在1 460 cm-1附近振动。进一步对比固体样品13C NMR 发现,酸洗前后的主峰都集中在75 ppm 和105 ppm。通过计算13C NMR 中官能团的相对贡献发现,酸洗后玉米有机质中官能团的相对贡献降低,但是没有产生新的位移,说明酸洗并不会改变有机质结构,更可能是使部分溶出性有机质流失。相对发酵前,发酵后玉米秸秆有机质的烷基对有机质官能团的贡献由10%增加到20%,烷氧烃的相对贡献从70%下降到50%左右,表明烷氧碳等易降解组分随着发酵进程优先被降解,而难降解的有机质相对富集。

图1 不同浓度HF处理后固体玉米秸秆有机质和酸洗液中红外光谱图Figure 1 FIRT spectrum of solids and supernatant after HF treatment with different concentrations
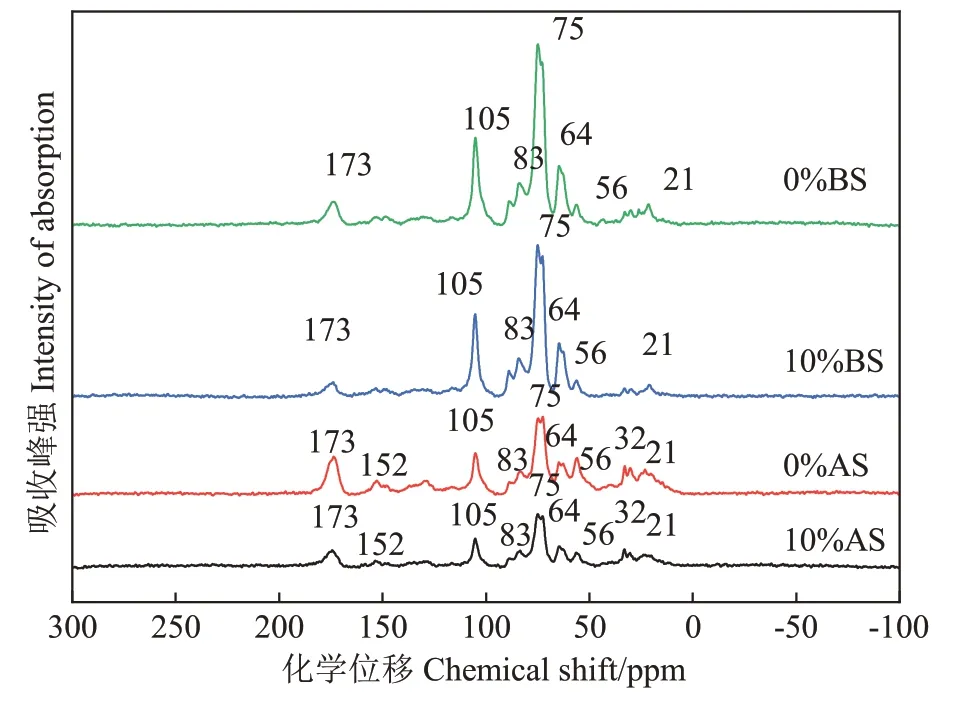
图2 不同浓度HF处理后固体玉米秸秆有机质的核磁图Figure 2 13C NMR of organic matter of solid corn straw treated with different concentrations of HF
2.2 酸处理下发酵前后玉米秸秆有机质中木质素含量和参数的变化
不同浓度HF处理的发酵前后玉米秸秆有机质中木质素的总量及参数变化如图3所示。BS和AS有机质中木质素总量分别为(18.81±7.44)mg·g-1和(12.01±1.75)mg·g-1。AS 中V、S、C 单体及其总量与BS相比变化均不显著,但是S和C单体含量明显高于V 单体。氧化程度相同的玉米秸秆有机质,即BS 和AS,经0、2%和10%HF 处理后,木质素的总量没有发生显著的减少。此外,发酵前后玉米秸秆有机质中香草基木质素的(Ad/Al)v和来源参数(S/V 和C/V)都没有显著增加。
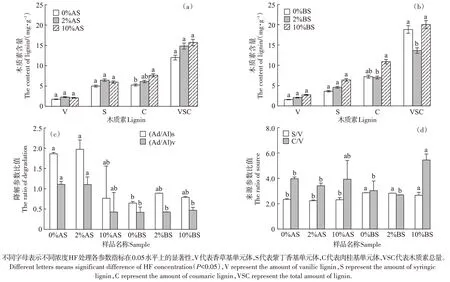
图3 酸处理后发酵前后固体样品中木质素总量及参数变化Figure 3 The changes of the total amount and structure of lignin in the solid before and after HF treatment
与0%HF 的酸洗相比,酸处理后的上清液中溶出性木质素含量更低,尤其是AL 的木质素含量降低得更为明显。从表2 可知,不同浓度HF 处理后酸洗液中的木质素总量远低于固体样品。与0%HF 处理相比,2%HF 和10%HF 处理的上清液中木质素含量都很低,说明HF 基本不会改变有机质的结构进而导致其溶出,而更多的是水溶液导致的溶出。由于上清液中肉桂基单元体含量较低,未检测出,因而未对其降解参数和来源参数进行分析。

表2 酸洗上清液中木质素含量及结构的变化Table 2 Changes in the lignin content and structure of the HF-washed supernatant
2.3 酸处理下发酵前后玉米秸秆有机质同位素变化
结合上文光谱学信息可知,上清液中有机碳的含量较低,故实验中只分析了不同浓度酸处理后固体秸秆的同位素信息,结果见图4。不同浓度酸处理后发酵前后固体玉米秸秆有机质的δ13C有显著差异,其中发酵前玉米秸秆有机质的δ13C为-12.83‰±0.25‰,发酵后玉米秸秆有机质的δ13C 是-13.63‰±0.09‰。值得注意的是,发酵后的玉米秸秆有机质的δ13C显著降低。然而,相同氧化程度的玉米秸秆有机质经不同浓度HF 处理后的δ13C 并没有显著性差异,说明酸处理不会使有机质发生分馏,氧化程度不同的玉米秸秆有机质经不同浓度HF 处理后OM 结构不会发生改变,只是发酵后降解程度高的有机质更容易流失。
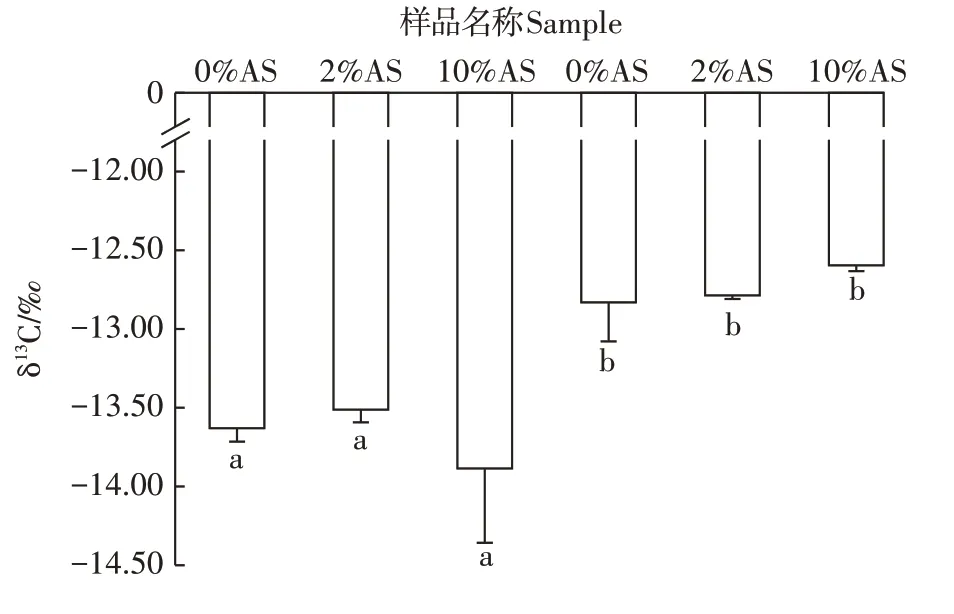
图4 酸处理对发酵前后固体玉米秸秆的同位素比值变化Figure 4 The δ13C value of maize straw before and after fermentation treat with HF
3 讨论
3.1 发酵前后的玉米秸秆有机质的性质变化
发酵前后的玉米秸秆有机质存在一定的差异。表1 显示,AS 的N 含量和C 含量显著增加,O 含量显著降低,但是其C/N 明显降低。一方面可能是发酵过程中微生物的降解作用释放了更多氨基化合物等含氮素的物质,另一方面O元素的流失导致C元素的相对富集,相比之下N的积累强于C的富集,因而导致发酵后C/N 降低[28]。根据图4 稳定碳同位素分析可知,BS 的δ13C 值为-12.83‰±0.25‰,AS 的δ13C 值为-13.63‰±0.09‰,发酵后的玉米秸秆δ13C 值更加偏负,这与Lynch 等[29]报道的玉米秸秆堆肥后的δ13C 由-12.8‰±0.6‰变为-14.1‰±0.0‰相吻合。本研究中13C 贫化主要是因为短期发酵过程中微生物优先利用13C含量更高的多糖和蛋白质[30]。但是更多的文献报道有机质降解过程会使13C 富集,这主要归因于凋落物或者有机质的降解过程中微生物优先分解12C以及微生物残体对于13C的贡献[31-33]。另外,也有研究报道随着降解时间的增加,整体的δ13C 呈先贫化再富集的趋势,这可能是降解初期微生物优先利用13C高的易降解组分,后期矿物抑制了凋落物的降解导致了13C 富集[34]。随着热裂解技术(Py-GC/MS)的发展,San-Emeterio等[35]发现木质素、纤维素、蛋白质、脂质等特异性化合物中13C 都显著富集,这归因于降解过程中微生物对特定化合物中12C的优先利用。可见有机质的组成会改变δ13C,后期研究中可以考虑利用特异性化合物中的单体同位素识别有机质的降解。另外,发酵前后的玉米秸秆有机质FTIR 和13C NMR 都没有新的位移,但是AS 的吸收峰明显减弱,这可能是发酵过程中有机碳损失造成的[36]。对比AS 和BS,AS 的木质素总量有一定的降低,且AS 的降解程度大于BS,这也进一步证实了AS的溶出性更大。
3.2 不同浓度酸处理对玉米秸秆有机质的影响
图1 和图2光谱学数据显示,不同浓度HF处理后玉米秸秆有机质组成和结构不会发生改变,这与研究报道的HF 处理不会改变有机质的13C NMR 具有一致性[37]。研究表明2%HF 处理会导致有机碳损失8%~17%,但是这些损失的有机碳不会对13C NMR 中化学结构信息造成显著的影响[38]。同样,本研究发现酸洗过程会导致有机质的流失,结合酸处理前后13C NMR信息和玉米秸秆有机质的质量损失分析,酸洗上清液中主要是易降解组分(如酰胺、氨基糖等),酸处理发酵前后的固体玉米秸秆有机质中都主要包含芳香族化合物和碳碳双键类的化合物,但是不同浓度HF 处理不会导致有机质结构的改变[39-40]。不同浓度酸处理发酵前的玉米秸秆有机质中C含量基本保持不变。然而,酸处理发酵后玉米秸秆有机质的C含量明显增加,O 含量降低,导致发酵后的玉米秸秆有机质中C元素相对富集。氧化程度相同的玉米秸秆有机质,经不同浓度的HF 处理后其δ13C 并没有发生显著的改变,HF 处理不会改变玉米秸秆有机质的碳同位素组成,这与研究报道的酸处理不会明显改变δ13C 和δ15N信号值的结果具有一致性[17]。
不同浓度HF 处理发酵前后的玉米秸秆有机质后,木质素分子生物标志物信息显示(图3)HF不会显著改变其降解参数,分子层面显示HF 处理后玉米秸秆中木质素的降解程度相同。相反,有研究报道10%HF 处理不同深度的土壤有机质后,其来源参数和降解参数发生了改变,分子层面有机质结构发生了改变[17]。酸处理前后分子生物标志物出现不一致的情形极有可能是矿物对有机质保护所致。同样,Li等[41]报道酸处理提高了游离态脂类化合物分子生物标志物的萃取,但是矿物去除前后其降解参数CPI 差异较大,甚至出现相反的趋势。Chang 等[42]利用1 mol·L-1HCl/10%HF 去除土壤矿物后,苯多羧酸(Ben⁃zene-polycarboxylic acids,BPCAs)分子标志物的萃取量显著升高。综上所述,矿物严重阻碍了分子生物标志物的提取和识别,后续研究中有必要用温和的酸先对矿物进行去除。
4 结论
(1)不同浓度HF 处理不会改变SOM 的结构,但HF 酸洗会导致溶出性有机碳的流失,尤其是发酵后高氧化程度的玉米秸秆有机质。为获得高氧化程度有机质,实验过程应选择适宜浓度酸对固体样品进行前处理,并对酸洗液进行浓缩纯化,表征分析其理化性质,更好地评价整体有机质的组成变化。
(2)结合稳定碳同位素和分子标志物信息,HF处理不仅可以揭示矿物结合态有机质组分信息,而且还能提高分子标志物(木质素、脂类、BPCAs)的萃取率。酸处理前后分子标志物的信息变化为理解矿物对有机质的保护机制和不同土壤有机碳的周转提供了研究思路。

