规范化营养干预对食管癌放疗患者疗效及营养状况的影响
钱夏婧 房郑旭莹 陆意
食管癌是中国常见消化道恶性肿瘤,过去10 年里,在主要肿瘤死因中位居第4 位,占全部恶性肿瘤死亡的9.26%[1]。放射治疗(简称放疗)是目前治疗食管癌的主要有效安全的手段之一。食管癌Ⅱ~Ⅲ期或Ⅳ期患者,可行根治性和姑息性放疗或术前新辅助同步放化疗。食管癌解剖位置特殊,疾病本身造成的进食困难或治疗引起的消化道毒副反应等均会直接影响患者营养物质的摄入,造成体质量丢失和营养不良[2],最终导致患者住院周期延长、治疗费用提高及疗效减弱。2021 年起宁波市医疗中心李惠利医院批准设立了全国肿瘤患者营养指导中心建设项目,积极推进了本院营养治疗的规范化进程。本研究收集近年来我院收治的食管癌放疗患者临床资料,探讨规范化营养干预对患者疗效及营养状况的影响,现报道如下。
1 对象和方法
1.1 对象 选择2019 年12 月至2021 年12 月宁波市医疗中心李惠利医院收治的100 例食管癌放疗患者,其中规范化营养干预(观察组)和自主饮食(对照组)各50 例。纳入标准:(1)经病理学证实为食管癌,拟行放疗;(2)Ⅱ~Ⅳ期初治的食管癌;(3)心、肺、肾、骨髓、胃肠道功能正常,无放疗禁忌证;(4)年龄18~80岁,卡诺夫斯基健康状况量表(Karnofsky performance status scale,KPS)评分≥70 分。排除标准:(1)有其他肿瘤病史;(2)意识不清或认知障碍;(3)无营养不良或营养风险;(4)治疗期间有严重不良反应者;(5)治疗过程中患有其他重大疾病者;(6)治疗过程中由于各种原因而失访者。相较对照组,观察组治疗前Hb、白蛋白、总蛋白等营养相关指标更差(均P<0.05);两组患者性别、年龄、疾病分期、主观整体营养状况量表(scored patient-generated subjective global assessment,PG-SGA)评分、BMI、KPS 评分、放疗期间是否有联合治疗(同步化疗、免疫、化疗联合免疫)等基本情况比较,差异均无统计学意义(均P>0.05),见表1。本研究经本院医学伦理委员会审查通过(批准文号:伦审2022 研第332 号)。所有患者或家属知情同意。
1.2 方法
1.2.1 治疗方法 所有患者均采用调强适形放射治疗,根据美国癌症联合委员会(American joint committee on cancer,AJCC)或国际抗癌联盟(union for international cancer control,UICC)制定的肿瘤-淋巴结-远处转移(tumor node metastasis,TNM)分期标准(采用2017年第8 版)以及KPS 评分决定剂量。部分患者在放疗过程中根据疾病分期及KPS 评分采取放疗联合化疗、放疗联合免疫治疗或3 者联合等联合治疗。
1.2.2 营养干预方法 对照组为2020 年8 月前未开展规范化营养治疗的患者,在放疗及出院后随访3 个月期间采用自主饮食,包括常规的饮食摄入和患者自主选择是否添加自备非医学肠内营养制剂或由医院提供的安素、瑞能等医学肠内营养制剂,不进行营养需求量的计算;对进食困难无留置肠内营养管或胃造瘘的患者,选用传统固定配方的营养袋,包括氨基酸、葡萄糖、脂肪乳、脂溶性维生素、水溶性维生素及微量元素等营养成分,进行肠外营养支持。如患者需求,对其进行营养相关知识宣讲及营养咨询。观察组为2020 年8 月后开展规范化营养治疗行规范化营养干预的患者,放疗首次入院由护士根据营养风险筛查2002量表(nutritional risk screening 2002,NRS 2002)对患者进行初次营养筛查,医师核对后若得分≥3 分者,进行PG-SGA 评分,根据营养不良的评分等级,由医师、护士、营养师组成营养干预小组给予患者个体化营养方案,包括目标营养供给量(日常饮食及肠内肠外营养支持)为热量20~25 kcal/(kg·d)[最低15 kcal/(kg·d)]和蛋白质1.0~1.5 g/(kg·d)[最低0.6 g/(kg·d)]。首选肠内营养支持(口服或管饲);若7 d 内或预计7 d 内不能达到目标能量摄入量的60%,联合使用肠外营养;有肠内营养支持禁忌证的患者采用全肠外营养支持。肠内营养制剂首选瑞能,如果耐受不良或合并糖尿病、肝肾功能障碍等慢性疾病,则根据病情酌情选择合适的制剂。每周检测相关营养指标,每4 周内进行至少1 次NRS 2002 及PG-SGA 评分,再根据营养状态进行营养治疗调整,其中膳食及肠内营养支持总量达需要量的60%以上可逐渐减少或停止肠内营养支持。若首次放疗入院评估NRS 2002<3 分,则无需干预并自主饮食,在住院放疗期间每周进行1 次NRS 2002 评分,若评分≥3 分,则同前进行营养干预。放疗结束后,采用放疗科专科门诊及营养科门诊或电话随访,每月1 次,共3 个月。其中患者营养知识的了解主要通过营养干预小组的查房宣教及病区营养小手册分发获取,除此以外,宣教模式还包括在非疫情期间,每周定期举行科内营养沙龙对患者普及营养知识;疫情期间,患者则通过参与各种医师及营养师的线上直播及营养科公众号知识推送获取营养知识。具体规范化营养治疗流程见图1。

图1 营养规范化治疗流程
1.3 观察指标
1.3.1 营养指标评估 (1)首次入院测定NRS 2002 评分及PG-SGA 评分;计算BMI,测定NRS 2002评分,1次/周;放疗后及放疗后3个月分别测定NRS 2002评分。(2)检查Hb、白蛋白、总蛋白等实验室指标,1次/周。
1.3.2 不良反应评估 评估患者放疗过程中出现急性放射损伤的情况,包括放射性食管炎、放射性肺炎、肺部感染、治疗后骨髓抑制、治疗中断等放疗相关不良反应。放疗不良反应评价按照美国肿瘤放射治疗协作组织制定的急性放射损失分级标准进行毒性反应评价。
1.3.3 治疗疗效评价 根据RECIST 1.1 版进行肿瘤疗效评估。本项研究为放疗的靶病灶评估:(1)完全缓解为靶病灶消失;(2)部分缓解为靶病灶直径比基线水平减少30%;(3)疾病进展为靶病灶直径相对增加至少20%;(4)疾病稳定为靶病灶减少的程度没达到部分缓解,增加的程度也没达到疾病进展,介于两者之间。
1.4 统计学处理 采用SPSS 26.0 统计软件。正态分布计量资料用表示,组间比较采用两独立样本t检验,偏态分布计量资料用M(P25,P75)表示,组间比较采用非参数检验;计数资料用频数和构成比表示,组间比较采用χ2检验或Fisher 确切概率法。采用二元logistic 回归分析营养治疗疗效的影响因素。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者放疗前、后及放疗3 个月后营养指标比较 观察组放疗后白蛋白、总蛋白、男性Hb 均优于对照组,差异均有统计学意义(均P<0.05);放疗3 个月后,两组各项营养指标比较,差异均无统计学意义(均P>0.05),见表2。治疗及随访期间动态评估NRS 2002 发现,相较于对照组,观察组放疗前(基线)的NRS 2002 评分更差,差异有统计学意义(P<0.05)。但在放疗后及放疗3 个月后NRS 2002 评分观察组较对照组下降幅度均更快,差异均有统计学意义(均P<0.01),见表3。

表2 两组患者放疗前、后及放疗3 个月后营养指标比较
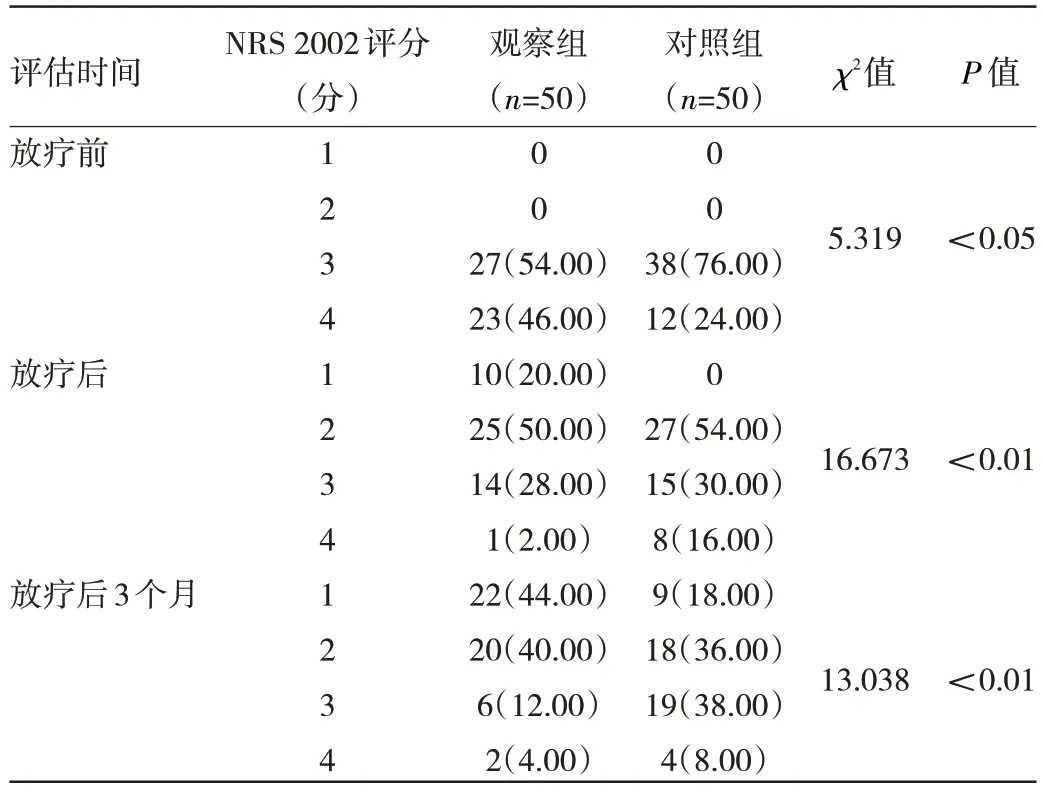
表3 治疗及随访期间NRS 2002 动态评估[例(%)]
2.2 观察组和对照组营养治疗疗效相关影响因素的二元logistic 回归分析 以NRS 2002 评分(<3 分赋值为1,≥3 分为0)为因变量,以年龄(<65 岁赋值为1,≥65 岁为0)、性别(男赋值为1,女为0)、KPS 评分(≤70分赋值为1,≥80 分为0)、基线PG-SGA 评分(≥9 分赋值为1,<9 为0)、分期(Ⅱ~Ⅲ期赋值为1,Ⅳ期为0)、有无联合治疗(有赋值为1,无为0)为自变量进行二元logistic 回归分析,结果显示<65 岁的人群在放疗期间进行营养规范化治疗的受益更好(P<0.05);在放疗结束后3 个月继续进行营养治疗的患者中,放疗期间有联合治疗的患者是在后续营养规范化治疗中受益更好的人群(P<0.05),见图2。
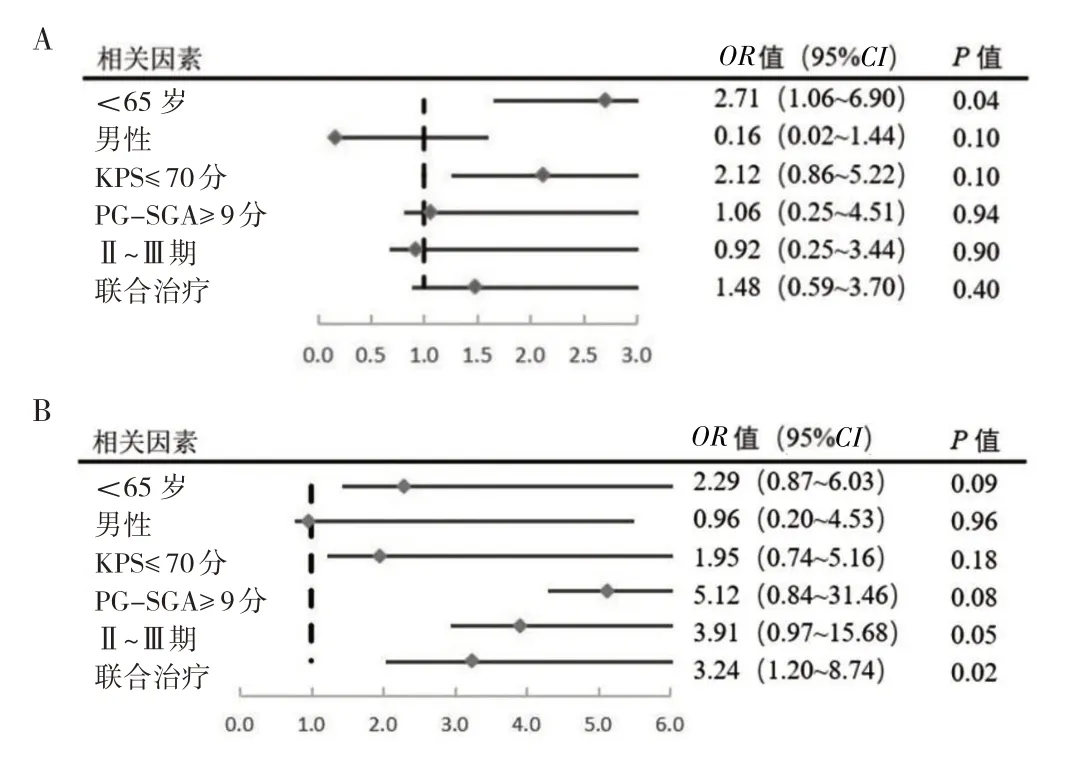
图2 营养指标相关影响因素的二元logistic 回归分析(A:放疗结束后;B:放疗结束3 个月后)
2.3 两组患者治疗期间不良反应发生率的比较 两组患者在骨髓抑制、放射性食管炎、放射性肺炎、感染、中止放疗的发生率比较,差异均无统计学意义(均P>0.05),见表4。
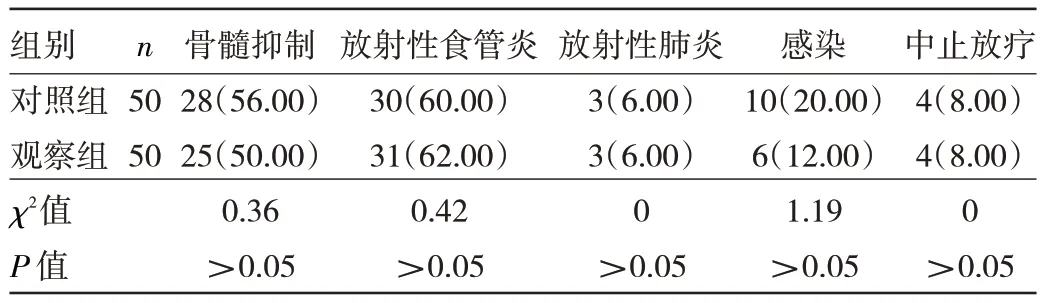
表4 两组患者治疗期间不良反应发生率比较[例(%)]
2.4 两组患者近期疗效的比较 观察组肿瘤的客观缓解率高于对照组,在两组患者中均未出现病灶进展,部分患者评估为病情稳定,差异无统计学意义(P>0.05),见表5。

表5 两组患者近期疗效的比较
3 讨论
食管癌是消化道肿瘤中最常见的癌种之一,针对Ⅱ~Ⅲ期或者Ⅳ期食管癌患者,放疗联合或者不联合其他治疗手段是当前主要的治疗策略。约有40%~80%的恶性肿瘤患者存在营养不良,其中消化道肿瘤患者营养不良更为常见[3],而营养不良带来的影响,如不良反应增加、肿瘤治疗周期延长、摆位误差增大、肿瘤治疗完成率下降及治疗疗效减弱,对放疗肿瘤患者的治疗和预后不利[4]。Clavier 等[5]对食管癌放疗患者营养状况与预后相关性进行研究分析发现,营养良好、营养中等和营养不良的患者,中位生存时间分别为29.5、19.7 和12.0 个月。营养状况良好的患者体力状态和生命质量均优于营养不良的患者,而不良反应发生率则低于营养不良的患者[6]。因此,针对食管癌患者进行规范化的营养治疗对其营养状况的改善及治疗疗效提高都具有重要意义。
本研究通过入院筛查、营养干预、营养会诊、出院随诊、门诊随访等一系列规范化流程,动态评估了患者治疗期间营养状态。治疗期间医师、护士、及营养师三方科学制定患者个体化的营养治疗方案,恰当选择患者营养途径[7-9],优先使用符合肿瘤患者代谢需求的营养制剂,对可能影响患者的营养状态的伴随症状的观察分析并及时处理,对营养治疗不耐受或不良反应的分析与处理,定期评估营养干预后患者血常规、血生化等实验室指标,并关注体重变化,最后达到目标需求量的至少60%以上。除此以外,出院后患者通过随访及线上的营养知识普及来保证院外的持续营养管理[10-11]。结果发现,即便治疗前的营养指标基线明显差于对照组,在经过治疗期间全程规范化营养管理后,观察组的实验室营养指标(白蛋白、总蛋白、男性Hb)差值在放疗结束后明显优于对照组,而在放疗结束后3 个月两组实验室营养指标未见明显统计学意义,可见营养治疗的关键干预节点是在放疗期间。NRS 2002 动态筛查发现,观察组的营养状态均比对照组有明显好转,即便在基线状态差的前提下。放疗结束后两组患者体质量变化比较无统计学意义,原因主要是治疗期间,治疗组部分患者因营养不良导致肢体水肿,治疗过程中通过积极补充营养同时联合消肿利尿治疗造成的,但白蛋白及总蛋白水平有明显提升。人体成分分析发现,这些患者的细胞外水分下降,整体蛋白质水平提升,提示尽管出现体质量下降,但整体营养状态却有明显改善。本研究还发现Hb 指标仅放疗结束后两组男性Hb 比较有统计学意义,可能由于Hb 水平不但受患者营养状况的影响,抗肿瘤治疗同样会导致贫血。但结合基线Hb 比较发现,观察组男性Hb 在放疗结束及放疗结束后3 个月均缓慢升高,女性Hb 放疗结束后有小幅下降,放疗结束后3 个月回升。而在对照组中,所有目标人群Hb 在放疗结束及结束后3 个月均低于治疗前,其中女性下降幅度更大。对年龄、性别、KPS 评分、PG-SGA 评分、有无联合治疗、肿瘤分期等的进一步分析发现,全程规范化营养干预对年龄<65 岁、联合治疗的患者疗效更好。而不良反应发生率和近期疗效比较,两组未见明显差异。综上所述,全程规范化营养干预不但能有效改善食管癌患者放疗后的营养水平,尤其是对年龄<65岁、联合治疗的患者,而且在一定程度上影响不良反应的发生率及近期疗效。
研究发现食管癌的放疗期间进行营养干预对患者营养状况的改善有明显提升[12-13]。如吕家华等[14]分析了食管癌同步放化疗患者的临床资料后发现,营养干预组放疗中及放疗后体质量丢失明显降低,Hb、血清白蛋白水平显著改善,与本研究结果一致。Haneda等[15]发现强化营养支持可显著提高围术期食管癌患者术后的营养指数水平,尤其对术前营养状况较差的患者,其改善预后效果更明显。本研究中,观察组基线营养状态较对照组差,通过规范营养干预,两组治疗耐受性未见明显差异,治疗后营养状态观察组要好于对照组。提示营养干预对患者的治疗和预后起到积极作用[16-19]。
营养治疗已逐渐成为肿瘤治疗的重要组成部分和肿瘤支持治疗的核心要素[20]。全程规范化营养干预对临床提供了很好的参考价值。但本研究也存在一定的局限性,首先,研究为回顾性研究,收集评估的营养学指标不够全面,未涵盖前白蛋白、血肌酐、人体成分分析仪检测指标等。此外本研究随访时间较短,不能设定更多的研究终点,如总生存期、生活质量变化等;除此以外,研究对象经过相应标准筛选后,最终导致样本量有限,基线水平无法做到无显著差异,因此可能引起统计偏差。本研究的结果应通过进一步的前瞻性研究,设置好更多的观察指标,并结合多元化的评分量表,包括健康调查简表,更好了解患者心理及生理功能变化,来验证营养治疗对肿瘤患者的意义。

