神经生长因子对小鼠颌骨骨髓间充质干细胞增殖、迁移、分化及凋亡的影响
王雅迪,刘一涵,张鹤扬,徐振华,刘水蓉,江小霞,贺慧霞解放军医学院,北京 0085;解放军总医院第一医学中心口腔科,北京 0085;军事医学研究院军事认知与脑科学研究所,北京 00850
颌骨骨髓间充质干细胞(jaw bone marrow mesenchymal stem cells,JBMMSCs) 从颌骨中分离,是一类具有高度增殖、迁移活性及分化潜能的成体干细胞,可在一定诱导条件下向成骨细胞(通过膜内成骨直接形成骨)、脂肪细胞、软骨细胞(通过软骨内成骨形成骨和软骨)、神经细胞等分化[1-3]。JBMMSCs 起源于神经外胚层,在颌面部胚胎发育期由颅神经嵴细胞从神经管迁移到颅骨前区,形成面部和前颅骨的一些骨骼和软骨[4]。有研究表明,JBMMSCs 在增殖及成骨分化方面的能力显著优于骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs),且具有临床上取材容易、与颌骨同源等优势,成为目前修复颌骨缺损领域研究的热点[5]。神经生长因子(nerve growth factor ,NGF)是神经营养因子中的一类,它能促进中枢神经元和外周神经元生长发育,修复损伤的神经系统,同时在骨代谢、成骨分化中有促进作用[6-8]。近年来,有研究证实NGF 能促进中胚层来源的长骨骨髓间充质干细胞的成骨分化及骨形成,但NGF 对外胚层来源的JBMMSCs 生物学特性的影响尚未见报道。因此,本文探究NGF 对JBMMSCs 增殖、迁移、分化及凋亡的影响,以期为其临床应用奠定实验基础。
材料与方法
1 主要试剂和仪器 α-MEM 培养基(Gibco,美国),胎牛血清(依科赛生物,中国),胰蛋白酶(Bio Frox,美国),地塞米松、抗坏血酸C、β-甘油酸钠、NGF (Peportech,美国),FITC 标记的抗体CD45,APC 标记的抗体CD29、CD90,CCK-8试剂盒(碧云天,中国;Sigma,美国),碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(Sigma,美国)、反转录试剂盒(TOYOBO,美国)、qRTPCR 试剂(上海生工生物,中国)、RIPA 裂解液(索莱宝,中国)、BCA 蛋白定量试剂盒(上海贝博生物科技公司,中国),MCM-2、Ki67、Bax、Bcl-2、OCN、OPN、RUNX2、BMP2 抗体(Abcam,美国)。细胞培养箱(Thermo,美国),离心机(Thermo,美国),流式细胞仪(BD,美国),倒置显微镜(Olympus,美国),FTC-3000P 实时荧光定量 PCR仪(Funglyn Biotech Inc,美国),酶标仪(Thermo,美国),凝胶成像系统(Bio-rad,美国)。
2 JBMMSCs 原代培养 使用C57BL/6 N 小鼠提取原代JBMMSCs。将新生1 d 的C57BL/6 N 小鼠处死,75% 乙醇浸泡5 min。无菌条件下取下颌骨,剪约1 mm3的组织块,胰酶消化约20 min,弃胰酶,加入α-MEM 完全培养基(含10%胎牛血清的α-MEM 基础培养基),于37 ℃、5% CO2、100%饱和湿度培养箱中培养。每3 d 换液1 次,细胞80% ~ 90%融合时传代[9]。
3 分组及处理 实验分为实验组和对照组,实验组用含50 ng/mL NGF 的α-MEM 完全培养基培养JBMMSCs[10],对照组用α-MEM 完全培养基培养。
4 CCK-8 检测细胞增殖 JBMMSCs 以4 × 103/孔的细胞密度接种于96 孔板,24 h 后更换为含或不含NGF (50 ng/mL)的α-MEM 完全培养基。分别在0 d、1 d、3 d、5 d、7 d 时,每孔加入10 µL CCK-8 溶液,继续孵育2 h,用酶标仪检测450 nm波长处各孔OD 值。
5 碱性磷酸酶染色 JBMMSCs 以3 × 104/孔的细胞密度接种于24 孔板中,24 h 后更换为含或不含NGF (50 ng/mL)的α-MEM 完全培养基,每3 d 换液1 次,诱导7 d 后,PBS 洗涤3 次,4%多聚甲醛溶液固定15 min,根据ALP 试剂盒说明配置染液,室温避光孵育4 h 后,PBS 洗涤3 次,使用BIX 显微镜观察,ImageJ 软件分析各组ALP 染色的光密度。
6 qRT-PCR 检测增殖、成骨分化及凋亡相关基因表达 JBMMSCs 以3 × 105/孔的细胞密度接种于六孔板中,分组培养3 d 后[11],根据说明书使用总RNA 提取试剂盒提取细胞总 RNA,分光光度计检测mRNA 浓度及纯度。然后使用Hifair® Ⅱ1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus) 试剂盒去除基因组DNA 并反转录1 µg mRNA。在NCBI 数据库查找Ki67、MCM-2、Bcl-2、Bax、ALP、OPN、RUNX2、BMP2及内参GAPDH 的基因序列,Primer5 软件设计引物(引物序列见表1),由生工生物工程股份有限公司 合 成,使 用Hieff® qPCR SYBR Green Master Mix 进行qPCR,每个反应使用同一cDNA 样品进行3 次重复。扩增程序:预变性95℃ 5 min,1 个循环;变性 95℃ 10 s,退火/延伸60℃ 30 s,40 个循环。采用2-ΔΔCt法计算Ki67、MCM-2、Bcl-2、Bax、ALP、OPN、RUNX2、BMP2 相对于内参基因GAPDH 表达量。
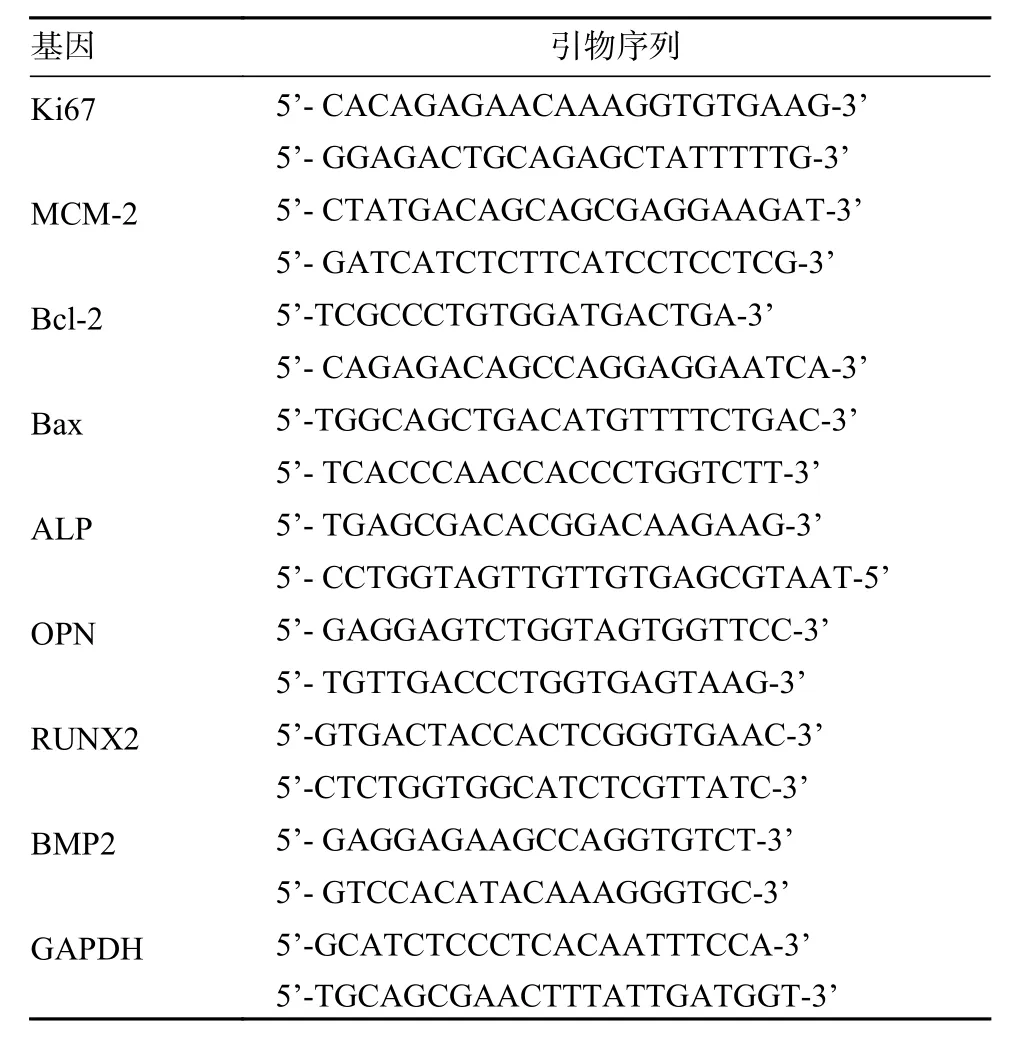
表1 增殖、凋亡及成骨相关基因引物序列Tab. 1 Primer sequences for genes related to proliferation,apoptosis, and osteogenesis
7 Western blot 检测增殖、成骨分化及凋亡相关蛋白表达 JBMMSCs 以3 × 105/孔的细胞密度接种于六孔板中,分组培养3 d 后,加入RIPA 裂解液裂解细胞、提取蛋白,测定蛋白含量后将20 µg 蛋白样本加入SDS-PAGE 进行电泳,随后电转移至PVDF 膜,5% 脱脂牛奶室温封闭PVDF 膜1 h,1∶1000 稀 释 的Ki67 、MCM-2 、Bax 、Bcl-2、OCN、BMP2、OPN、RUNX2 及β-actin 一抗4℃孵育PVDF 膜过夜;次日洗PVDF 膜3 次后室温孵育 1∶2 000 稀释的二抗1 h,再次洗PVDF 膜3 次,在凝胶成像系统中显影得到蛋白条带,根据灰度值分析蛋白表达量。
8 免疫荧光染色(immunofluorescence,IF)观察增殖及成骨分化相关蛋白表达 JBMMSCs 以3 × 104/孔的细胞密度接种于内含细胞爬片的24 孔板中,分组培养3 d 后,将细胞置于PBS 中漂洗3 次,每次5 min,弃去PBS,加入4%多聚甲醛固定10 ~15 min 后漂洗3 次,使用快速封闭液(阳光英锐) 封闭1 ~ 5 min 后加入Ki67 (ab15580)、ALP(M0806-10)、OCN (ab133612)单 克 隆 抗 体(稀释1∶200) 4℃孵育过夜,移去抗体后PBS 漂洗3 次,每次5 min。加入二抗(ab150105,Abcam;稀 释1∶200) 室 温 避 光 孵 育60 min,随 后用PBS 漂洗3 次,每次5 min,滴加含有DAPI 的封片剂,将细胞爬片盖于载玻片上。使用Olympus荧光显微镜观察。
9 细胞划痕实验 JBMMSCs 以3 × 105/孔的细胞密度按分组接种于六孔板中,置于37℃、5% CO2条件下培养,待细胞密度达80% ~ 90%时进行实验。在板底画一条横线,用10 µL 无菌枪头在孔内垂直横线划痕,PBS 轻柔洗去刮下的悬浮细胞,加入无血清培养基中培养,分别在划痕0 h、12 h、24 h 时于倒置显微镜下观察,并用ImageJ软件测量划痕面积。
10 统计学方法 采用 SPSS 23.0 软件对实验数据进行统计分析,计量资料符合正态分布以x¯±s表示,组间差异比较采用t检验,双侧检验,P<0.05 为差异有统计学意义。
结 果
1 NGF 显著提高颌骨骨髓间充质干细胞的增殖能力 本研究使用的JBMMSCs 符合国际细胞治疗 学 会 规 定 标 准[10]。使 用50 ng/mL NGF 刺激JBMMSCs 0 d、1 d、3 d、5 d、7 d,CCK-8 检测结果显示:随刺激时间的延长,OD 值不断升高,且3 d 与5 d 时与对照组比较有统计学差异且3 d时更显著(图1A),因此选择刺激3 d 进行后续研究。qRT-PCR、Western blot 结果显示:50 ng/mL NGF 显著提高Ki67、MCM-2 在mRNA 和蛋白水平的表达量(图1B,图1C)。免疫荧光结果显示:对照组只有少数JBMMSCs 表达Ki67,实验组NGF刺激后,表达Ki67 的细胞数量显著增多(图1D)。
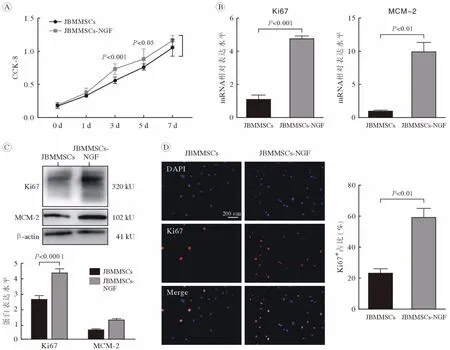
图1 NGF 显著提高JBMMSCs 增殖能力A:CCK-8 检测NGF 对JBMMSCs 增殖能力的影响(n=6);B:qRT-PCR 检测增殖相关基因Ki67、MCM-2 的表达;C:Western blot 检测增殖相关蛋白Ki67、MCM-2 的表达;D:IF 检测NGF 刺激后JBMMSCs 的Ki67 阳性表达变化Fig.1 NGF significantly increased the proliferation ability of JBMMSCs A: Effect of NGF on proliferation of JBMMSCs detected by CCK-8 assay (n=6); B: mRNA expression levels of proliferation related genes Ki67, MCM-2 by qRT-PCR; C: Protein expression levels of proliferation related genes Ki67, MCM-2 by Western blot; D: Immunofluorescence staining of Ki67 (red) in JBMMSCs and JBMMSCs-NGF
2 NGF 促进颌骨骨髓间充质干细胞迁移 通过细胞划痕实验探究NGF 对JBMMSCs 迁移能力的影响,分别在0 h、12 h、24 h 时在倒置显微镜下观察各孔中细胞迁移情况,用ImageJ 软件测量划痕面积。结果显示:随着观测时间的延长,各组细胞迁移率均增加,而实验组的迁移率(12 h:40.67% ± 0.8%;24 h:95.28% ± 0.9%),在12 h、24 h 时均显著高于对照组(12 h:37.37% ± 0.4%;24 h:85.23% ± 0.80%)(图2),提示NGF 有促进JBMMSCs 迁移的作用。
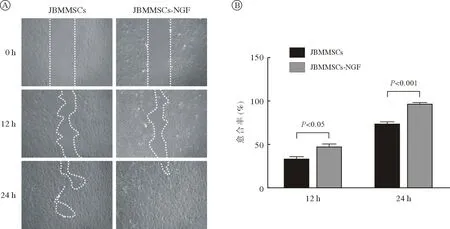
图2 NGF 促进JBMMSCs 迁移(n=6)A:细胞划痕实验镜下观察;B:划痕实验定量结果Fig.2 NGF promoted the migration of JBMMSCs (n=6)A: Observation of cell scratch test under microscope; B: The results were quantified by cell scratch test
3 NGF 促进颌骨骨髓间充质干细胞成骨分化成骨诱导7 d,ALP 染色结果显示:对照组胞质呈现蓝紫色,NGF 组JBMMSCs 胞质染色加深,呈深蓝色,表明ALP 活性增强(图3A)。qRT-PCR结果显示:成骨标志物ALP、OPN、RUNX2、BMP2 表达量较对照组显著增加(图3B)。Western blot 结果与PCR 结果一致(图3C)。IF 染色显示,对照组少量JBMMSCs 表达ALP、OCN,而NGF刺激组ALP、OCN 着色细胞数量显著增多,定量分析结果也表明ALP、OCN 阳性细胞数量显著增加(图3D)。提示50 ng/mL NGF 刺激7 d 可以显著提高JBMMSCs 的成骨分化能力。
图3 NGF 促进JBMMSCs 成骨分化(n=6)A:ALP 染色结果; B:qRT-PCR 检测成骨相关基因ALP、OPN、RUNX2、BMP2;C:Western blot 检测成骨相关蛋白ALP、OPN、RUNX2、BMP2;D:IF 检测NGF 刺激后JBMMSCs 的ALP、OCN 阳性表达变化Fig.3 NGF promoted osteogenic differentiation of JBMMSCs (n=6)A: ALP staining results; B: mRNA expression levels of osteogenic differentiation related genes ALP, OPN, RNUX2, BMP2 by qRTPCR; C: Protein expression levels of osteogenic differentiation related genes ALP, OPN, RNUX2, BMP2 by Western blot; D: Immunofluorescence staining of ALP (red) and OCN (red) in JBMMSCs and JBMMSCs-NGF
4 NGF 抑制颌骨骨髓间充质干细胞凋亡能力qRT-PCR 及Western blot 结果显示:50 ng/mL NGF刺激后,JBMMSCs 中具有显著抑制细胞凋亡作用的Bcl-2 的mRNA 及蛋白水平表达量增加,而重要的促凋亡基因Bax 的表达量显著下降(图4),提示50 ng/mL NGF 具有抑制JBMMSCs 凋亡的作用。
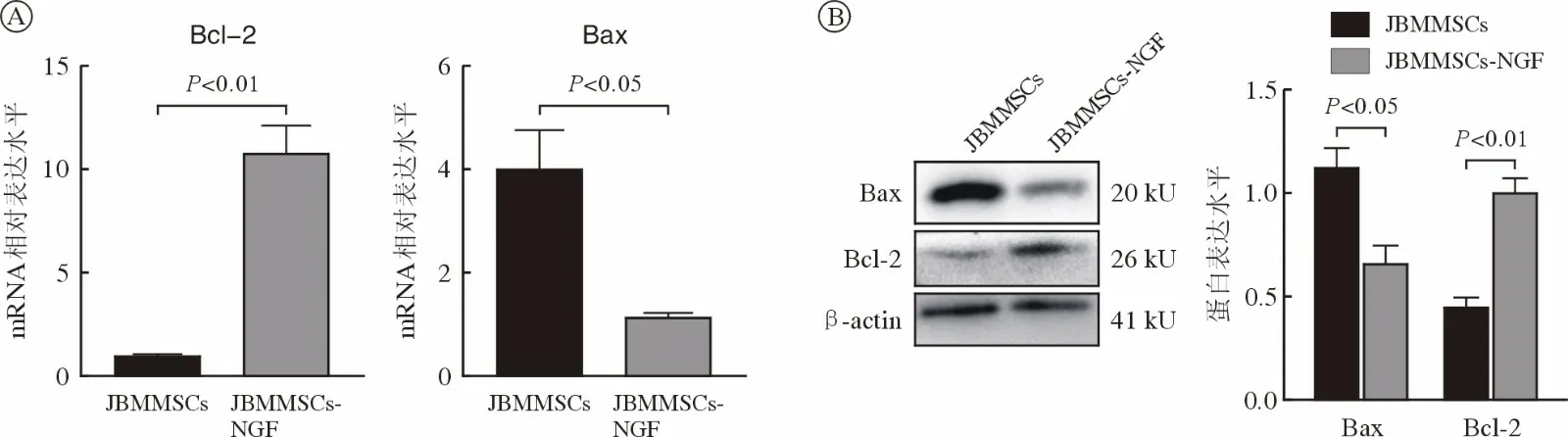
图4 NGF 抑制JBMMSCs 的凋亡能力(n=6)A:qRT-PCR 检测凋亡相关基因Bcl-2、Bax;B: Western blot 检测增殖相关蛋白Bcl-2、BaxFig.4 NGF inhibited apoptosis of JBMMSCs (n=6)A: Apoptosis related genes Bcl-2 and Bax were detected by qRT PCR; B: Proliferation related proteins Bcl-2 and Bax were detected by Western blot
讨 论
骨是一种动态改建的、受神经支配和血管化的组织,具有损伤后再生的固有能力。目前,严重的骨丢失及临界缺损需要通过外科手术恢复骨形态及功能[12-17]。有研究发现,骨损伤导致神经纤维损伤后,其周围骨组织的自然愈合及骨形成时间会显著延长[3]。这表明神经系统与骨组织代谢密切相关。而大量研究表明,在骨缺损修复过程中,移植骨髓间充质干细胞在受损组织中的生存能力较差,单纯骨髓间充质干细胞无法表现出明显的治疗效果[13]。因此,为了有效修复颅颌面骨缺损,缩短愈合时间,改善疗效,探究神经系统与骨稳态之间的关系具有重要意义。
神经生长因子是神经营养因子家族的一员,由Levi-Montalcini 在20 世纪50 年代首次发现,他将小鼠肿瘤移植到鸡胚胎中,产生NGF 来刺激交感神经和感觉神经的细胞和纤维的增殖,发现NGF 在调节神经肽和神经递质的产生以及周围中枢神经系统神经元的增殖、生存、生长中起着至关重要的作用[14]。有研究发现,NGF 的主要功能之一是通过促进细胞增殖、抑制细胞凋亡来刺激其生存和生长[15]。本实验前期研究探究了不同浓度NGF 对JBMMSCs 增殖的影响,筛选出促进该细胞增殖的最佳浓度(50 ng/mL)。本研究在此基础上进一步研究了该浓度对JBMMSCs 不同生物学特性的影响,为NGF 在骨缺损修复中作用及其机制研究奠定基础。本研究发现,JBMMSCs 的增殖能力随时间推移不断提高,而NGF 刺激则有效提高了其增殖能力,这与Fang 等[16]的研究结果相似。后者CCK-8 检测发现过表达NGF 可增加BMSCs 的增殖能力,促进其黏附和迁移,而敲低NGF 则相反;并发现NGF 是通过NGF/TrkA 信号通路激活Nrf2 促进BMSCs 的增殖、迁移和黏附。本实验进一步发现,NGF 刺激JBMMSCs 后3 d 增殖最为显著,为后续研究NGF 的刺激时间提供了参考。Wang 等[17]对NGF 促进细胞增殖的机制进行了较为深入的研究, MTT 实验显示,使用NGF 刺激Muller 细胞12 h 和24 h 后显著提高其增殖能力,该作用也被TrkA、ERK1/2 和PI3K/AKT 抑制剂阻断。在本实验中,qRT-PCR 和Western blot 分别从mRNA 和蛋白水平检测了增殖标志物Ki67、MCM-2 的表达,此外IF 结果也显示,在NGF 刺激后,更多的JBMMSCs 表达Ki67阳性,从蛋白水平证实NGF 可有效启动JBMMSCs细胞进入增殖周期。
组织中细胞凋亡是组织改建的细胞学基础,也是细胞的重要生物学特性之一。Wei 等[18]发现30%的神经系诱导干细胞在移植到缺血大鼠脑后3 d 内死亡。相似的,Sortwell 等[19]研究表明,大量移植细胞在移植后可能死亡,而凋亡是这些细胞死亡的主要方式。因此,探究如何提高干细胞的抗凋亡能力,有效减少其凋亡,对组织的再生、改建具有重要的意义。本实验通过qRTPCR 检测了重要凋亡标志物Bcl-2 的表达变化,结果显示NGF 刺激后的JBMMSCs 抑制凋亡的能力显著提高,而Bax 的mRNA 表达则显著下降,说明其凋亡减少,Western blot 也显示相同结果。Wang 等[20]也开展了NGF 对BMSCs 凋亡检测,所不同的是该学者将NGF 应用于酪胺改性玻尿酸水凝胶(HT) 结合BMSCs 治疗外伤性脑损伤,在HT + NGF + BMSCs 组用Western blot 检测凋亡相关蛋白Bax、Bcl-2 的表达,结果显示,与HT +BMSCs 组相比,凋亡因子Bax 在实验组中显著降低,而抗凋亡因子Bcl-2 的表达则均有增加,表明NGF 植入可有效抑制神经元的凋亡[21]。本研究中细胞划痕实验结果发现,12 h 时实验组和对照组细胞划痕宽度较初始时均有缩窄,实验组的迁移率为40.67%,较对照组高;24 h 时实验组的迁移率为95.28%,比对照组高10.05%。这表明NGF刺激后细胞迁移速度在不同时间点均有加快,而24 h 时迁移速度显著提高,提示50 ng/mL NGF 能促进JBMMSCs 迁移,有利于骨组织的修复。
有研究发现,NGF 可通过其高亲和力的受体原肌球蛋白受体激酶A (TrkA)诱导骨骼肌神经再生,进而对骨修复后期的血运重建和骨基质沉积发挥促进作用[22-23]。这是其不同于其他生长因子的关键之处,即直接促进成骨细胞分化和通过促进支配骨骼神经再生、血管化从而间接促进骨再生。近期有研究发现,在骨与软骨分化前发生NGF 反应性轴突侵犯,而手术去除神经,从而抑制了轴突的生长,显著延缓了骨与软骨的形成[7],从机制上讲,去神经后,前成骨细胞中的TGF-β信号激活,转变为FGF 信号,由NGF 介导的表达TrkA 的轴突长入并驱动骨损伤后骨和软骨的异常分化。相似的,NGF 通路在小鼠骨修复过程中起重要协同作用,由于部分感觉纤维数量减少、血管重建钝化最终导致了骨损伤修复的延迟骨化[8]。Rivera 等[24]的研究发现,胫骨骨折修复过程中NGF 及其受体TrkA 的内源性表达在软骨期达到峰值,同时在软骨内局部注射NGF 后促进了成骨标志物的表达和Wnt 通路的激活,体内实验证实局部注射NGF 后软骨减少而骨体积增加,骨愈合能力改善。本研究通过体外细胞实验发现,NGF 对JBMMSCs 的刺激大大增加了其ALP 活性,ALP活性是反映成骨细胞分化水平的一个重要指标,其活性越高,说明成骨细胞分化越明显[25]。
综上所述,本研究检测NGF 对小鼠JBMMSCs增殖、凋亡、迁移及成骨分化的影响,明确NGF在增殖、迁移及成骨分化过程中发挥正向作用,同时可有效抑制其凋亡,为NGF 应用于颌骨缺损、骨代谢性疾病所致的骨质不佳、骨量不足进行骨修复和再生治疗提供一定的理论和实验依据。
作者贡献王雅迪:实验设计,实验指标检测,实验仪器操作,实验数据处理及分析,论文撰写,文章校对;刘一涵:文章校对;张鹤扬:实验仪器操作;徐振华:文章校对;刘水蓉:文章校对;江小霞:实验设计,文章校对;贺慧霞:实验设计,文章校对。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:xolovewang@163.com。

