蒸汽爆破预处理联合壳聚糖酶制备壳三糖
郭超然,赵红军,苏海鹏,黄海燕,孙建安,毛相朝
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
在自然资源和环境方面,世界正面临前所未有的挑战[1]。近年来,绿色高效的生产方式取得了很大的进展,特别是在可持续利用生物质生产有价值产品的领域[2],而其中的生物技术具有环境友好性、高催化效率、底物专一性好和催化条件温和等优势,是一种非常有前景的方法[3]。
壳寡糖已广泛应用于制药、食品、农业、化妆品等领域[4-5],如在人体健康领域,其具有抗肿瘤、降低胆固醇、增强免疫力等功能,而在农业领域,可用作生物农药发挥抗虫害作用[6]。研究表明,壳寡糖的生物功能与聚合度(degree of polymerization,DP)密切相关[7]。例如,壳三糖能明显改善HepG2 细胞胰岛素抵抗作用,而壳二糖和壳四糖无明显改善效果[8]。但是目前缺乏特定的单一聚合度壳寡糖的制备方法,壳聚糖酶(EC 3.2.1.132)可以酶解壳聚糖生成壳寡糖,大多数壳聚糖酶已被证明是通过内切方式产生不同聚合度的壳寡糖混合物[9]。因此,利用壳聚糖酶从壳聚糖特异性制备特定聚合度的壳寡糖引起了研究人员的关注。
壳聚糖具有广泛且高度有序的氢键网络,使其在水中的溶解度较差,酶解效率较低[10]。因此,通常需要预处理手段降低壳聚糖结晶度以提高壳聚糖酶对壳聚糖的可及性,从而促进壳聚糖的酶解[11]。目前广泛使用的是利用稀酸溶液溶解壳聚糖的方法,但这造成了环境的污染、产物生物活性降低、纯化难度大、成本高等问题,在应用上存在一定的局限性。因此,需要探索绿色的粉状壳聚糖预处理手段,以减轻环境压力和提高生产有效性。在预处理手段中,蒸汽爆破因其环境友好性以及其快速破坏结晶生物质的潜力引起了人们的关注[12]。在这一物理化学过程中,生物质暴露于高压(0.5~2.5 MPa)饱和蒸汽中,随后瞬间释放压力和降低温度,破坏材料结晶结构,克服生物质降解的关键障碍,从而促进进一步水解,成为更高价值的产物[13]。蒸汽爆破已成为一种有创新性、环保、经济和高效的生物质处理技术,如采用蒸汽爆破技术可提高木质纤维素生物质的酶消化率、促进木聚糖提取和木质素释放等[14-16],但未见有蒸汽爆破应用于壳聚糖上的报道。
此外,枯草芽孢杆菌(Bacillus subtilis)因其生物安全性(generally recognized as safe,GRAS)以及良好的生化和生理特性而被认为是理想异源蛋白表达宿主菌株[17]。由于相对较高的生长速度、清晰的遗传背景以及在工业发酵中的稳定性,枯草芽孢杆菌成为适用于大规模工业生产的首选菌株。因此,在枯草芽孢杆菌中高效表达壳聚糖酶对其工业化应用具有重要意义。已有研究在大肠杆菌中成功表达了来自Butyrivibrio sp.MC2013 的壳聚糖酶Csn-But[18]。为了实现壳三糖的高效制备,本研究在枯草芽孢杆菌中对壳聚糖酶Csn-But 进行高效异源表达,采用蒸汽爆破预处理联合酶催化提高酶解效率,并通过控制底物浓度来实现产物聚合度的调控。以期为难以降解的不溶性生物材料的环境友好型生物催化转化开辟新途径。
1 材料与方法
1.1 材料
KOD 高保真酶(5 U/μL):日本TOYOBO 公司;DNA 无缝连接试剂盒:南京诺唯赞生物科技有限公司;DNA 凝胶纯化试剂盒、质粒提取试剂盒:美国QIAGEN 公司;不同分子量(Mw)壳聚糖:上海麦克林生化有限公司;不同聚合度(DP2~DP6)壳寡糖标准品:青岛博智汇力生物科技有限公司;薄层色谱(thin layer chromatography,TLC)板:德国Merck 公司。
大肠杆菌DH5α 感受态细胞:北京擎科生物科技有限公司;枯草芽孢杆菌WB800 感受态细胞为中国海洋大学食品科学与工程学院食品生物技术实验室自制,分别用于载体的构建和壳聚糖酶的异源表达。
壳聚糖酶Csn-But(GenBank:MK482734)的DNA序列由北京华大基因科技有限公司进行密码子优化并合成。
1.2 仪器与设备
高压灭菌锅(JI80TW):致微(厦门)仪器有限公司;超净工作台(BCM-1000):苏州净化设备有限公司;便携式均质机(HB-958b):中山市上品电器有限公司;蒸汽爆破装置(QB-200B ICSE):河南温柔新材料科技有限公司;恒温摇床(QYC2112):上海福马设备有限公司;电泳仪(DYY-6C):北京六一仪器公司;冷冻离心机(5804R):德国艾本德股份公司;高效液相色谱仪(LC-20AT)、液相色谱-质谱联用仪(1290 Infinity II UHPLC/6460 QqQ MS):美国安捷伦公司;酶标仪(MULTISKANF FC)、傅里叶变换衰减全反射红外光谱仪(Nicolet iS10):美国赛默飞世尔科技公司;扫描电镜(TESCAN VEGA3):日本日立公司。
1.3 壳聚糖酶Csn-But 的异源表达
以密码子优化的壳聚糖酶DNA 序列作为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,设计上游引物(5'-GTAACACATGCCTCAGCTGCAATGCGTAAAGAAAAAAACAAA-3')和下游引物(5'-CAGTGGTGGTGGTGGTGGTGTTTAGCGATAGCTTTCA-3')。PCR 扩增反应体系:25 μL 2×Buffer,10 μL H2O,10 μL 脱氧核糖核酸(deoxy-ribonucleoside triphosphate,DNTP),上下游引物各1.5 μL,1 μL KOD 高保真酶,1 μL 目的片段(1 ng/μL)。PCR 反应程序:预变性(94 ℃10 min)、40 个扩增循环(98 ℃10 s,58 ℃30 s,68 ℃80 s)、最终延伸(68 ℃10 min)。扩增产物经琼脂糖凝胶电泳鉴定后对目的片段进行回收,目的片段与载体pP43NMK(+)通过DNA 无缝连接酶连接后,通过42 ℃热激法转化至大肠杆菌DH5α 感受态细胞中,通过琼脂糖凝胶核酸电泳和DNA 测序进行阳性克隆验证。选择测序正确的重组质粒通过电转化法转入枯草芽孢杆菌WB800 感受态细胞,在LB 培养基(卡那霉素抗性)中于220 r/min,30 ℃发酵30 h。在8 500×g 转速条件下,4 ℃离心20 min 后,保留上清液,即为粗酶液。
1.4 壳聚糖酶活性测定
通过3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法检测还原糖的含量来测定壳聚糖酶活性[19]。200 μL 反应体系包含pH5 的2%胶体壳聚糖和20 μL粗酶液,在55 ℃孵育15 min 后,加入300 μL DNS 试剂,沸水浴10 min 显色。12 000×g 离心2 min 后,在540 nm处测定上清液吸光值,利用D-氨基葡萄糖的标准曲线计算还原糖含量。1 单位(U)的壳聚糖酶活性定义为在上述标准条件下每分钟产生1 μmol 还原糖所需的酶量。所有试验均进行3 次。
1.5 蒸汽爆破处理粉状壳聚糖
试验参考文献[20]的方法,取等量(100 g)的粉状壳聚糖样品在QB-200B ICSE 蒸汽爆破装置中用不同蒸汽压力(0、1.6、1.8、2.0、2.2 MPa 和2.4 MPa)进行蒸汽爆破处理4 min,然后迅速减压。蒸汽爆破处理后的样品60 ℃干燥至恒重。
1.6 表征蒸汽爆破处理的粉状壳聚糖
扫描电镜:样品喷金后,在扫描电子显微镜下观察。在20.0 kV 电压下,分别在500×和5 000×两个放大倍率下进行捕获。
傅里叶变换衰减全反射红外光谱(attenuated total reflection Flouriert ransformed infrared spectroscopy,ATR-FTIR):模式范围为4 000~400 cm-1,分辨率为4 cm-1,扫描100 次。
1.7 酶解蒸汽爆破处理的粉状壳聚糖
采用便携式均质机在pH5 柠檬酸缓冲液中对不同蒸汽压力预处理的样品进行均质,以保持均匀性。水解反应体系包含6.66 U/mL Csn-But、2%壳聚糖、20 mmol/L pH5 柠檬酸缓冲液,在55 ℃下分别水浴24 h 和48 h(反应过程中持续搅拌)后,沸水浴10 min终止反应,DNS 法测定还原糖含量,并根据还原糖含量评估最佳蒸汽压力条件。Csn-But 水解最佳处理效果的壳聚糖,并在不同时间点(0、30 min 和1、2、4、8、12、18、24、48、72 h)取样检测还原糖含量,得到最佳预处理条件下的水解曲线。所有试验均进行3 次。
1.8 特定聚合度壳寡糖的可控制备
1.8.1 壳聚糖酶Csn-But 水解壳寡糖产物分析
壳聚糖酶Csn-But 以壳寡糖[(GlcN)2~(GlcN)6]为底物在最适反应条件下反应不同时间(0.5、1.0、2.0、4.0 h)后,立即沸水浴10 min 终止反应。在异丙醇∶氨水=2∶1(体积比)作为展开剂的薄层色谱板上分离。用0.1%茚三酮溶液溶解在乙醇中喷涂,然后在110 ℃下加热5 min 显色。
1.8.2 底物浓度对产物聚合度的影响
将Csn-But(6.66 U/mL)在55 ℃下水解不同浓度(2%、4%和6%)的经过2.4 MPa 压力蒸汽爆破处理的粉状壳聚糖48 h,过程中持续搅拌。反应经沸水浴10 min 后终止,12 000×g 离心2 min 后,通过0.22 μm聚醚砜滤膜过滤得到壳寡糖样品,在以下条件下采用高效液相色谱-电喷雾电离-质谱进行分析:正离子模式,流动相为乙腈∶水=2∶1(体积比),扫描速度为5 200 u/s。在全扫描质谱分析中,记录m/z 5~1 000 范围内数据。
1.9 数据处理
采用Origin 软件数据进行分析。结果用平均值±标准差表示,每个样品重复测定3 次。
2 结果与分析
2.1 壳聚糖酶Csn-But 在枯草芽孢杆菌中的高效异源表达
目的基因Csn-But 通过同源无缝连接载体pP43NMK 后,成功转入大肠杆菌DH5α 中并进行扩增,将提取的质粒通过电转化法成功转入到枯草芽孢杆菌WB800 中进行表达。为了评价Csn-But 的表达水平,测定了重组枯草芽孢杆菌胞外和胞内壳聚糖酶活性。胞内壳聚糖酶活性和胞外相比,可忽略不计。在胞外酶活测定中,枯草芽孢杆菌表达的Csn-But 活性为89.78 U/mL,高于大肠杆菌中表达Csn-But 的活性(19.08 U/mL),表明枯草芽孢杆菌是合适的壳聚糖酶Csn-But 高效表达工程菌株[21]。
2.2 壳聚糖经过蒸汽爆破处理后的结构变化分析
利用扫描电镜观察蒸汽爆破预处理后粉状壳聚糖的形态变化,壳聚糖扫描电镜图像见图1。
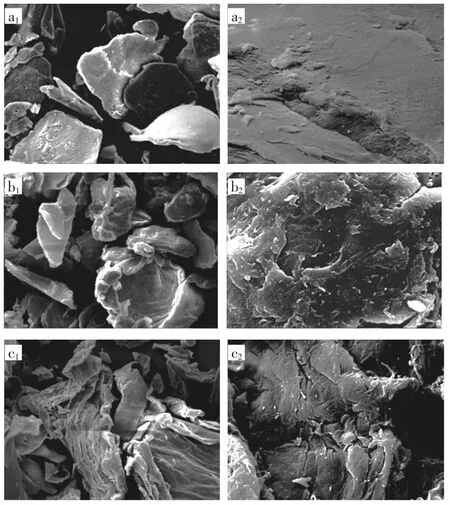

图1 壳聚糖扫描电镜图像Fig.1 SEM images of powdery chitosan
由图1 可知,蒸汽爆破处理引起了明显的形态学变化。如图1a1和图1a2所示,未处理的粉状壳聚糖表面致密有序,结构相对光滑和平整,这限制了壳聚糖酶的可及性[22],使酶无法直接高效酶解粉状壳聚糖。样品在经过蒸汽爆破处理后呈现出粗糙和无序的形态,并且蒸汽爆破后样品的粗糙度随着蒸汽爆破压力的增加而增强。由图1b1和图1b2可知,经1.6 MPa 处理的样品表面出现轻微卷曲裂纹和纤维网络松动的特征。如图1d1和图1d2所示,当压力增加到2.0 MPa 时,处理后的样品出现纤维组织的紧密裂纹。由图1f2可知,经2.4 MPa 蒸汽爆破处理后,壳聚糖表面显示多刺的纤维状细枝排列且表面明显被撕裂。综上所述,蒸汽爆破预处理对壳聚糖的结构带来脉冲冲击,导致分离和暴露的纤维含有多个空腔和撕裂,这与纤维素经蒸汽爆破处理后变化相似[23]。
ATR-FTIR 对不同压力蒸汽爆破处理后样品的表征,结果见图2。
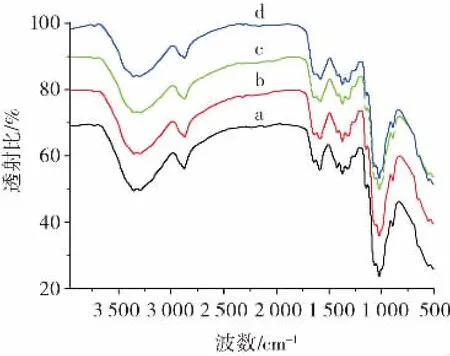
图2 未处理和蒸汽爆破处理粉状壳聚糖的傅里叶变换衰减全反射红外光谱Fig.2 ATR-FTIR spectra of powdery chitosan untreated and treated with steam explosion
由图2 可知,壳聚糖的所有特征峰(O—H、C—H和C—O 拉伸振动)均被观察到,其中3 277 cm-1处的吸收峰为氢键OH 拉伸或NH 振动[24-25],说明蒸汽爆破预处理后壳聚糖的化学键未被破坏。其中壳聚糖的光谱在2 871 cm-1处出现C—H 拉伸振动,在1 651cm-1处出现的波段对应于酰胺I 的C O。在1 599 cm-1和1 378 cm-1附近观测到的特征振动带一般属于酰胺II的N—H 弯曲振动和酰胺III 的C—N 拉伸振动[26]。不同压力下蒸汽爆破处理的样品在3 400~3 200 cm-1范围内,由于氢键O—H 拉伸和N—H 振动导致条带强度减弱,酰胺II 的特征峰强度降低,说明氨基间氢键断裂。随着处理强度从0 增加到2.4 MPa,处理后的粉状壳聚糖样品中对称NH3+弯曲区域1 418 cm-1附近的带强度减小,这可能是NH3+分子间氢键的损失。这些结果表明,蒸汽爆破处理后壳聚糖的化学键没有被破坏,但有效地破坏了氢键网络。
2.3 Csn-But 对蒸汽爆破处理的粉状壳聚糖酶解
为了进一步评估蒸汽爆破预处理的效果,用壳聚糖酶Csn-But 对预处理样品进行酶解,其结果见图3。
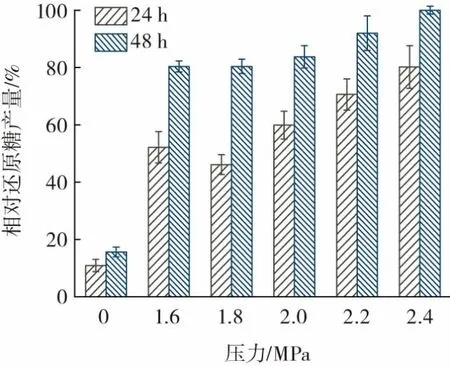
图3 不同蒸汽爆破压力条件下粉状壳聚糖的酶解Fig.3 Enzymatic hydrolysis of powdery chitosan under different steam explosion pressures
由图3 可知,蒸汽爆破预处理可促进粉状壳聚糖的转化,当压力从1.6 MPa 提高到2.4 MPa 时,壳聚糖酶Csn-But 的酶解性能显著提高。相比于对照组(0 MPa),2.4 MPa 压力蒸汽爆破处理组的粉状壳聚糖酶解48 h的还原糖含量提高了5.4 倍,证明蒸汽爆破预处理粉状壳聚糖有助于粉状壳聚糖的直接转化,从而实现了壳寡糖绿色环保生产,突破传统酸处理法造成的水资源消耗和产物酸味严重的瓶颈。
壳聚糖酶Csn-But 水解蒸汽爆破处理粉状壳聚糖的进程曲线见图4。
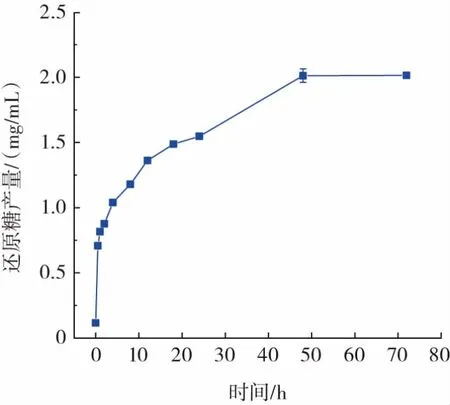
图4 壳聚糖酶Csn-But 水解蒸汽爆破处理粉状壳聚糖的进程曲线Fig.4 Time course profile of chitosanase Csn-But hydrolyzing powdery chitosan treated with steam explosion
由图4 可知,在初始阶段(0~12 h),还原糖含量迅速增加,48 h 后达到相对平衡,最高含量为2.0 mg/mL。
2.4 壳三糖的可控制备
2.4.1 壳聚糖酶Csn-But 水解模式分析
通过TLC 分析Csn-But 以各种聚合度寡糖为底物的水解产物,结果见图5。

图5 Csn-But 与聚合度2~6 壳寡糖反应Fig.5 Csn-But reacting with(GlcN)2-6
由图5 可知,分别以壳二糖[(GlcN)2]、壳三糖[(GlcN)3]和壳四糖[(GlcN)4]为底物与壳聚糖酶反应2 h,没有其他产物生成,说明该酶不能水解壳二糖、壳三糖和壳四糖。而壳五糖[(GlcN)5]被水解生成壳二糖和壳三糖,壳六糖[(GlcN)6]被有效水解为DP2~DP4 的壳寡糖,水解试验结果证实Csn-But 为内切型切割模式的壳聚糖酶。随机内切的切割模式有助于获得高聚合度壳寡糖,可因底物浓度等反应因素所抑制或调节而发生改变[27]。
2.4.2 产物聚合度的调控
底物浓度是影响产物组成的重要因素。通过壳聚糖酶Csn-But 水解不同浓度(2%、4%、6%)蒸汽爆破预处理的粉状壳聚糖可控生产特定聚合度壳寡糖。水解产物的组成见图6。

图6 不同壳聚糖浓度2%、4%、6%的水解产物Fig.6 Hydrolysates obtained from different chitosan contents of 2%,4% and 6%
由图6a 可知,Csn-But 水解低浓度(2%)蒸汽爆破预处理的粉状壳聚糖产生壳二糖(m/z 363.1)、壳三糖(m/z 524.2),壳四糖(m/z 685.1)和四聚体(m/z 727.1)与来自2%底物的水解产物相比,水解高浓度底物形成的产物组成有明显变化。由图6 可知,随着底物浓度的增加,虽然产物混合物的聚合度没有变化,但壳二糖和壳四糖的比例逐渐降低,壳三糖逐渐成为主要的产物。由图6c 可知,在6%底物浓度下,壳三糖成为产物的主要成分。单一聚合度壳三糖的生产也将大大降低壳寡糖精制后期产品分离纯化的时间和操作成本。以往的研究也表明,通过调控酶解过程,可控制生产特定聚合度的壳寡糖,如在不同底物浓度下,当酶添加量较低时,可以得到壳二糖作为优势产物[27]。
3 讨论与结论
壳聚糖酶Csn-But 在生物安全性(GRAS)菌株枯草芽孢杆菌中实现高效表达。此外,Csn-But 酶解2.4 MPa 蒸汽爆破预处理粉状壳聚糖壳寡糖含量提高了5.4 倍。酶切模式分析表明壳聚糖酶Csn-But 为内切型壳聚糖酶,并且有望通过控制蒸汽爆预处理底物的浓度来实现单一聚合度壳三糖的生产。与传统方法相比,这种绿色预处理技术可以减少原本酸处理导致的环境污染和产品分离难题。蒸汽爆破预处理粉状壳聚糖的转化率较低,需要进一步优化和控制蒸汽爆破过程,提高酶的转化率。

