复合益生菌抗斑马鱼感染及对炎症的抑制作用
◎ 郭亚娟,喻 勤,严建刚,高业成,李晓敏,毛新亮
(1.完美(广东)日用品有限公司,广东 中山 528400;2.广东完美生命健康科技研究院有限公司,广东 中山 528400)
益生菌对人体有多种健康作用,其作用机制有干扰潜在病原体、改善屏障功能、免疫调节等[1]。研究表明,大肠杆菌、阴道加德纳氏菌和白色假丝酵母是导致阴道炎的主要病原菌[2-3],而益生菌在改善女性常见阴道感染方面具有显著效果,口服益生菌具有降低阴道炎复发率的作用[4],但这些实验多在小鼠、人体上实施,试验周期长、成本昂贵。而斑马鱼具有繁殖快、周期短等特点,且其胚胎和幼鱼透明,转基因鱼的使用更有助于荧光显微镜对特定免疫细胞,如中性粒细胞进行体内可视化观察[5],已广泛用于病原微生物感染模型的研究[6-7]。本文利用斑马鱼模型,研究嗜酸乳杆菌La-14和鼠李糖乳酪杆菌HN001复合益生菌对常见阴道炎致病菌及炎症的抑制作用。
1 材料与方法
1.1 实验动物
野生型AB品系斑马鱼,自然交配繁殖。年龄为受精后4~5 d,用于肠腔分布试验、对斑马鱼无可见有害作用水平的测定以及抗感染试验;转基因中性粒细胞绿色荧光MPX品系斑马鱼,自然交配繁殖,年龄为受精后4 d,用于改善炎症功效试验。用28 ℃养鱼用水(每200 mg速溶海盐用1 L反渗透水溶解,pH值为6.5~8.5,硬度为50~100 mg·L-1CaCO3,电导率为450~550 μS·cm-1)饲养斑马鱼,杭州环特生物科技股份有限公司养鱼中心提供,实验动物使用许可证号为SYXK(浙)2012-0171,饲养管理符合国际AAALAC认证(认证编号:001458)的要求。
1.2 材料与试剂
萃妍益生菌固体饮料(主要成分为赤藓糖醇、低聚果糖、嗜酸乳杆菌La-14、蔓越莓粉、透明质酸钠、鼠李糖乳酪杆菌HN001)由完美(广东)日用品有限公司提供,乳酸菌总数不低于1.0×1010CFU·g-1,用标准稀释水配制浓度为200 mg·mL-1的母液,现配现用。
大肠杆菌(Escherichia coli)冻干菌种,编号为GDMCC 1.708=ATCC 35401,来源于广东省微生物菌种保藏中心;白色假丝酵母(Candida albicans)冻干菌种,编号为GDMCC 2.194=ATCC 10231,来源于广东省微生物菌种保藏中心;阴道加德纳氏菌(Gardnerella vaginalis)冻干菌种,编号为GDMCC 1.1347=ATCC 14018,来源于广东省微生物中心。
CM-DiI(红色荧光):批号2277732,美国赛默飞世尔科技(中国)有限公司;CM-DiI(绿色荧光):批号2174897,美国赛默飞世尔科技(中国)有限公司;磷酸缓冲盐溶液(PBS):批号70115000,中国Biosharp公司;二甲基亚砜(DMSO):批号BCCD8942,瑞士Sigma公司;甲基纤维素:批号B2006074,中国上海阿拉丁生化科技股份有限公司。
1.3 仪器与设备
SZX7显微镜,日本OLYMPUS公司;Vert.A1 CCD相机,上海土森视觉科技有限公司;AZ100电动聚焦连续变倍荧光显微镜,日本Nikon公司;IM-300显微注射仪,日本Narishige公司;PC-10拉针仪,日本Narishige公司;CP214精密电子天平,美国OHAUS公司;TD5A台式大容量低速离心机,长沙英泰仪器有限公司;DensiCHEK Plus电子比浊仪,美国生物梅里埃公司;6孔板,无锡耐思生物科技有限公司。
1.4 实验方法
1.4.1 复合益生菌在斑马鱼肠腔分布实验
随机选取100尾受精后5 d的野生型AB品系斑马鱼置于培养皿中。用红色荧光CM-DiI标记复合益生菌,并溶于养鱼用水中,浓度为2 000 μg·mL-1,培养皿容量为30 mL,并于2 h、4 h、24 h分别随机选取3尾斑马鱼,用荧光显微镜拍照。根据斑马鱼肠腔荧光情况,判断复合益生菌是否活着到达其肠腔内。
1.4.2 复合益生菌抗斑马鱼感染实验
参考付式杰等[8]方法并进行适当修改,具体操作方法如下。根据前期浓度摸索结果,复合益生菌对正常斑马鱼的无可见有害作用水平(No Observed Adverse Effect Level,NOAEL)为1 000 μg·mL-1,以NOAEL剂量的1/4、1/2和1设定低、中、高剂量组,即复合益生菌质量浓度为250 μg·mL-1、500 μg·mL-1和1 000 μg·mL-1。
(1)抗大肠杆菌感染实验。将受精后4 d的野生型AB品系斑马鱼置于6孔板中,每孔(实验组)随机放置30尾。将复合益生菌按照预设浓度溶解在养鱼水中,模型对照组斑马鱼仅用养鱼用水处理,每个孔体积为3 mL。28 ℃连续处理18 h后,各实验组均注射用红色荧光CM-Dil标记的大肠杆菌到斑马鱼肠腔内,换液继续28 ℃处理3 h,建立斑马鱼大肠杆菌感染模型,根据斑马鱼肠腔是否有红色荧光判断造模是否成功。
(2)抗白色假丝酵母联合阴道加德纳氏菌感染实验。将受精后4 d的野生型AB品系斑马鱼置于6孔板中,每孔(实验组)随机放置30尾。将复合益生菌按照预设浓度溶解在养鱼水中,模型对照组斑马鱼仅用养鱼用水处理,每个孔体积为3 mL。28 ℃连续处理18 h后,各实验组均注射用红色荧光CM-DiI标记的白色假丝酵母和绿色荧光CM-DiI标记的阴道加德纳氏菌到斑马鱼肠腔内,并换液继续28 ℃处理3 h,建立斑马鱼白色假丝酵母联合阴道加德纳氏菌感染模型,根据肠腔内是否有红色荧光和绿色荧光判断造模是否成功。
以上实验结束后,每组随机挑选10尾斑马鱼用荧光显微镜拍照,用NIS-Elements D 3.20高级图像处理软件分析并采集数据,分析斑马鱼肠腔内致病菌的荧光强度F以及抑菌率,用于评价复合益生菌抗感染功效。抑菌率计算公式为
1.4.3 复合益生菌改善斑马鱼炎症实验
参考付式杰等[8]方法并进行适当修改,具体操作方法如下。将受精后4 d的转基因中性粒细胞绿色荧光MPX品系斑马鱼置于6孔板中,每组(正常对照组、模型对照组和低、中、高剂量组)随机放置30尾,共150尾。将复合益生菌溶解在养鱼水中,浓度与1.4.2复合益生菌抗斑马鱼感染实验相同,正常对照组和模型对照组斑马鱼仅用养鱼用水处理,每个孔体积为3 mL。28 ℃连续处理18 h后,除正常对照组外,其余各实验组均注射大肠杆菌到斑马鱼肠腔内,建立斑马鱼炎症感染模型,并换液继续28 ℃处理3 h。实验结束后,每组随机挑选10尾斑马鱼用荧光显微镜拍照,用NIS-Elements D 3.20高级图像处理软件分析并采集数据,分析斑马鱼肠腔内中性粒细胞数量(N)和炎症抑制率,用于评价复合益生菌炎症抑制率。炎症抑制率计算公式为
1.4.4 数据统计分析
各组实验结果采用“均值±标准差”表示结果,使用SPSS 26.0软件进行统计和单因素方差分析,各用Dunnett’s-t检验进行统计,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 复合益生菌在斑马鱼肠腔分布实验
复合益生菌是一种活菌制剂[9],所以评价其是否可活着到达肠腔就非常有必要。如图1所示,斑马鱼经水溶给予CM-Dil红色荧光标记的复合益生菌2 h、4 h和24 h后,其肠腔的荧光逐渐增强,说明2 h时,复合益生菌已经进入斑马鱼肠腔,4 h时肠腔已布满益生菌,24 h时复合益生菌含量较4 h更明显。从实验结果可知,复合益生菌可活着到达斑马鱼肠腔,并在肠腔稳定存活。CHEN等[10]研究水溶给予斑马鱼乳双歧杆菌实验,同样发现在水溶喂食2 h后,益生菌可进入肠腔,6 h、24 h可充满整个肠腔,且可存活24 h以上,实验结果与本实验一致。

图1 斑马鱼肠腔内复合益生菌荧光示意图
2.2 复合益生菌抗斑马鱼感染作用
斑马鱼肠腔内大肠杆菌、白色假丝酵母、阴道加德纳氏菌荧光情况见图2,图中实线轮廓是主要分析区域。用NIS-Elements D 3.20高级图像处理软件分析图2并采集数据,分析复合益生菌对致病菌的抑菌率,具体结果见表1。由表1可知,与模型对照组相比,斑马鱼经水溶给予复合益生菌24 h后,致病菌的荧光强度均有所降低。复合益生菌对大肠杆菌、白色假丝酵母和阴道加德纳氏菌均具有抑菌能力,其中对大肠杆菌的抑菌效果较好,250 μg·mL-1低浓度组已显示抑菌作用,抑菌率为31.39%(P<0.05),随着浓度升高,抑菌率有升高趋势,最高为35.56%(P<0.01),但组间无统计学差异。然而,在白色假丝酵母联合阴道加德纳氏菌感染实验中,只有高剂量组1 000 μg·mL-1具有抑菌作用,对白色假丝酵母菌、阴道加德纳氏菌的抑菌率分别为33.34%(P<0.05)、37.20%(P<0.05),但总体抑菌率与对大肠杆菌的抑菌率接近。

表1 斑马鱼肠腔内致病菌荧光强度以及复合益生菌对致病菌的抑菌率结果表

图2 斑马鱼肠腔内致病菌荧光强度典型图
BERTUCCINI等[11]研究嗜酸乳杆菌La-14和鼠李糖乳酪杆菌HN001在体外对阴道加德纳氏菌、大肠杆菌的抑菌效果,结果显示其有较强的抑菌作用,与本实验结果相同,但体外研究结果显示其对大肠杆菌的抑菌能力随着浓度升高而增强,与本实验结果有差异,可能是由于斑马鱼肠腔面积限制了复合益生菌的定植,待达到一定效果时,即使增加浓度也无法提高抑菌率。
2.3 复合益生菌改善斑马鱼炎症作用
斑马鱼肠腔内中性粒细胞分布情况见图3,图中实线轮廓是主要分析区域。用NIS-Elements D 3.20高级图像处理软件分析并采集数据,分析斑马鱼肠腔内中性粒细胞数量,具体结果见表2。

表2 斑马鱼肠腔内中性粒细胞数量以及复合益生菌对斑马鱼肠腔炎症抑制率结果表
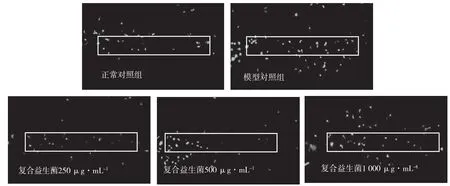
图3 斑马鱼肠腔内中性粒细胞荧光强度典型图
中性粒细胞是一种多核白细胞,可通过多种机制消除病原体,在炎症过程中将迁移并聚集在炎症部位,是首先到达炎症部位的白细胞,其数量变化可用来评估炎症反应强弱[12]。由表2可知,正常对照组肠腔内中性粒细胞数量极显著低于模型对照组(P<0.001),说明建模成功,250 μg·mL-1、500 μg·mL-1和1 000 μg·mL-1组的炎症抑制率分别为53.00%(P<0.01)、81.00%(P<0.001)、84.00%(P<0.001),随着浓度升高,炎症抑制率有上升趋势,但实验组之间差异不显著。这与复合益生菌抗大肠杆菌感染效果一致,推测其有可能是通过抗大肠杆菌感染达到抗炎功效。
3 结论
嗜酸乳杆菌La-14和鼠李糖乳酪杆菌HN001复合益生菌具有较高的安全性,且可以活着到达斑马鱼肠腔,并发挥抗大肠杆菌感染、白色假丝酵母联合阴道加德纳氏菌感染作用以及改善大肠杆菌引起的炎症,但具体机制仍需进一步研究。

