不同水平包膜丁酸钠对刺参(Apostichopus japonicus)生长性能、消化酶活性、非特异性免疫和抗病力的影响
高永刚,赵 浩,徐玉珊
(1.荣成市海洋经济发展中心,山东 威海 264300;2.中国海洋大学,山东 青岛 266061;3.荣成市海洋与渔业监测减灾中心 山东 威海 264300)
刺参(Apostichopusjaponicus),因其丰富的营养价值成为我国北方地区重要的水产养殖品种之一[1]。近二十年来,随着人民生活水平不断提高,刺参的市场需求也不断扩大,刺参养殖业也得以快速发展起来[2-3]。但随着集约化养殖方式的不断扩大[4],刺参免疫力下降、病害频发等问题日益严重。同时,传统使用的抗生素被国内国际官方机构列入禁用清单[5],因此,探求更高效、更安全的新型饲料添加剂尤为重要。
丁酸具有维持机体肠道上皮细胞正常形态、调整菌群微生态平衡、促进损伤修复的特性。通过在饲料中加入适量丁酸,可以提高饲料酸度,进而降低机体肠道内的pH值大小,从而有效地促进胃肠道消化酶分泌[6-7],继而起到促进生长、提高机体免疫力的作用。本文选取丁酸钠作为添加物,但由于丁酸钠具有特殊气味和不稳定的化学特性,为便于饲料加工和刺参采食,试验采用生物包被技术制备而成的包膜丁酸钠(MSB),以减少流失等产生的试验误差。目前,在饲料中添加丁酸钠的研究主要集中在畜禽养殖生产方面,如仔猪[8-10]、荷斯坦牛[11]、蛋鸡[12]等,在水产动物的报道集中在鱼类品种[13],在刺参饲料中添加丁酸钠的相关研究鲜有报道。因此,本试验旨在通过刺参饲料中添加不同水平包膜丁酸钠,分别测定各组刺参的特定生长率、消化酶活性、肠道生长状况和免疫酶活性等指标,以探究丁酸钠在刺参饲料之中添加效果和适宜的添加水平,为包膜丁酸钠在水产一线的推广及应用提供理论依据。
1 材料与方法
1.1 试验设计与饲养管理
本试验在山东省威海市荣成市好当家集团有限公司南海育苗基地苗种研究所的养殖实验车间开展。试验设计五个处理组、一个对照组,每个处理组3个重复(整个试验共计18个处理),每个处理组分别投喂相应水平梯度试验饲料。
所有试验用刺参首先要经过7 d暂养以适应环境温度和饲料。暂养期间水质条件: 水温(16.0±0.5) ℃, 溶氧>9.6 mg/L, 氨氮水平<0.05 mg/L。暂养饲料使用配置的基础饲料。暂养结束以后,所有刺参禁食24 h。驯化结束后,选取大小相仿、健康活跃、状态优良、质量均匀的刺参360头,随机分配于18个0.70 m×0.5 0 m×0.50 m养殖箱(养殖容积约为180 L)中。养殖周期为60 d,期间昼夜不断,持续冲氧,水温(16±0.5)℃,盐度30‰左右,溶氧度>9.98 mg/L,pH值7.6~8.2;每天上午10点准时换水1/3,下午3点准时投喂一次,并控制投喂量为刺参体重的5%。
1.2 饲料配方和制备
从饲料生产车间选取适当的饲料原料,设计试验基础饲料配方如表1。

表1 试验饲料配方以及营养成分(%,干物质基础)
在基础饲料上添加不同水平(1.0、2.0、3.0、4.0、5.0 g/kg)的包膜丁酸钠(由青岛百美佳生物科技有限公司提供, 有效包膜丁酸钠成分为74.13%),同时设置0 g/kg为对照组。同时以微量纤维素作为饲料添加剂调节组分(微量纤维素不具有功能性饲料添加剂的功能)。
将饲料原料依据品目分别粉碎过100目筛,得到的微量成分采取逐级扩大的试验配方的比例定量混合均匀,放入V型搅拌机中充分混合30 min。加水混匀, 经颗粒饲料机制成直径为2.5 mm的硬颗粒, 将得到的颗粒饲料用烘干机在40 ℃条件下烘干至饲料水分含量10%左右,放在双层封袋之中,放置于在-20 ℃冰箱中保存。
1.3 样品采集与处理
试验结束后,将各组刺参禁食24 h,再进行各组分的采样和分析。
1.3.1 生化样品的采集 每个水箱随机选取10头刺参,用解剖剪将腹面剪开,取出呼吸树、肠道,用生理盐水冲洗以去除其中的食物残渣, 用定性滤纸擦净后置于1.5 mL离心管中。用无菌注射器采集体腔液后装入1.5 mL离心管内,迅速将取得的样品放入液氮速冻后, 于-80 ℃条件下保存,用于消化酶活性和非特异性免疫活性酶的测算。每个水族箱内刺参全部采集混合后作为一个重复样本,紧接着进行体成分的采集。
1.3.2 体成分采集与测定 将取完生化样品的刺参腹面完全剪开以去除剩余的体腔液, 在相同部位取一块体壁(1 g 左右), 置于1.5 mL离心管中。剩余体壁冷冻保存以备常规成分及氨基酸分析等测定使用。试验所用玻璃器皿和解剖工具均在180 ℃灼烧5 h以去除RNAase后进行操作。
1.3.3 生化样品处理 分别选取每个样品中的0.3~0.5 g体壁或肠道样品,剪碎,加入4倍体积的冰冷生理盐水(0.86%),制成20%匀浆,在4 ℃条件下10 000 g离心20 min,取出上清液分装待测。体腔液样品则先置于4 ℃冰箱中解冻后, 再用超声波粉碎仪进行细胞破碎, 然后4 ℃条件下376 g离心10 min, 收集上清体腔液及底层体腔细胞分装待测。
1.4 生长指标的测定与计算
试验开始和结束,分别对养殖箱内的刺参逐个进行称重并计数,再根据下列公式计算刺参相关生长指标。
增重率:WGR=(Wt-W0)/W0×100%;
存活率(SR,%):SR=Nt/No×100%;
特定生长率(SGR,%/d):SGR=(lnWt-lnW0)/t×100%;
脏壁比:RV=Wv/Wb×100%;
饲料系数:FCR=M/(Wt+Ws-Wo);
式中:Wo和Wt分别为试验开始和结束时刺参的重量;N0和Nt分别为试验开始和试验结束时每个养殖箱内刺参的数量;Ws则为养殖过程中死亡的刺参质量;t为试验周期;Wv为内脏质量,g;Wi为肠道质量,g;Wb为体壁质量,g;M为养殖过程中的投饲量。
1.5 消化酶的测定
冷冻样品在冰上解冻,并用0.9%的生理盐水进行匀浆。将得到的匀浆液在4 ℃,10 000 g条件下,进行20 min离心操作。静置后取得上层清液进行酶活性测定,所有匀浆液样品4 ℃下保存并在24 h内测定。蛋白酶活力采用福林酚方法测定,淀粉酶及脂肪酶活力采用南京建成生物工程研究所试剂盒测定。严格参照操作说明,保证所有待处理样品在24 h内测定完毕。
1.6 非特异性免疫酶活性的测定
把冷冻样品在冰上解冻,在4 ℃,3 000 g条件下离心20 min。上清液转移到1.5 mL离心管中,4 ℃条件下保存,选取超氧化物歧化物酶(SOD)活性、过氧化氢酶(CAT)活性、溶酶菌(LSZ)活性、碱性磷酸酶(AKP)和酸性磷酸酶(ACP)活性为本试验非特异性免疫酶活性的指标,采用南京建成生物工程有限公司的试剂盒进行测定,严格参照操作说明,保证所有待处理样品在24 h内测定完毕。
1.7 攻毒试验
1.7.1 制备菌悬液 将致病菌灿烂弧菌(VibriosPzendidu)置于37 ℃下培养48 h,得到的细菌液用5 mL灭菌海水进行洗菌冲洗,制成细菌悬液,取l mL经过不同的梯度稀释后用血球计数板计数,最后调整至l扩109CFU/mL。
1.7.2 攻毒试验 在60 d养殖试验结束后,对所有取样后的剩余刺参个体,依次注射浓度为109CFU/mLV.Pzendidu菌液0.5 mL进行攻毒试验,水温控制在16 ℃。将刺参放回原试验水箱,保持连续不断通氧养殖,持续时间为15 d。攻毒期间其它养殖条件不变,不进行饲料投喂,每日观察并记录刺参的死亡情况,最后统计死亡率。
1.8 数据统计分析与记录
通过 SPSS 22.0 软件进行试验数据统计分析。所有数据在满足方差齐性和正太分布检验后,进行单因素方差分析和 Tukey’s 多重比较分析,显著性水平为P<0.05。数据以平均值±标准误差(Mean±S.E.M)来表示。
2 试验结果
2.1 对刺参生长性能的影响
不同水平的包膜丁酸钠(MSB)对刺参生长性能的影响见表2。随着饲料中MSB添加量的增加,刺参的增重率和特定生长率出现先提高后降低的趋势,在MSB添加水平为3.0 g/kg时达到最大,显著高于对照组(P<0.05),但与2.0 g/kg组差异不显著(P>0.05);MSB添加水平为1.0、4.0、5.0 g/kg时刺参增重率和特定生长率与对照组差异不显著(P>0.05)。对于脏壁比,在饲料中添加MSB水平为2.0、3.0 g/kg时的刺参脏壁比显著低于对照组(P<0.05),而当MSB添加水平为1.0、4.0、5.0 g/kg刺参的脏壁比与对照组差异不显著(P>0.05)。

表2 不同水平包膜丁酸钠(MSb)对刺参生长性能的影响
如图1所示,对于饲料系数,在饲料中添加MSB对刺参饲料系数的影响呈现先降低后增高的趋势,添加水平为2.0 g/kg时刺参饲料系数达到最低,显著低于试验组(P<0.05),与添加水平为3.0 g/kg时不具有差异性(P>0.05)。
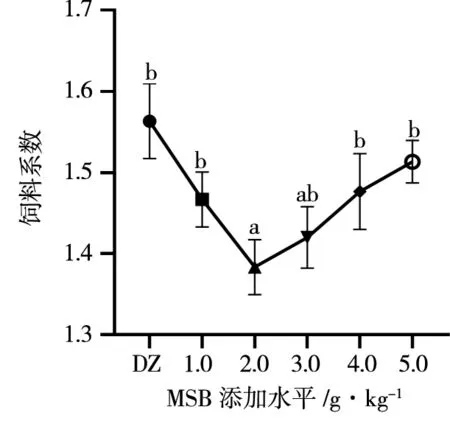
不同字母代表处理间差异显著(P<0.05),下同。
2.2 对刺参肠道消化酶活性的影响
如图2所示,MSB在饲料中添加不同水平而对刺参消化道中消化酶的活性影响不同。对于蛋白酶,饲料中添加不同水平MSB均不同程度地提高了刺参蛋白酶活性;添加水平2.0 g/kg时刺参的蛋白酶活性最高,显著高于对照组(P<0.05);包膜丁酸钠(MSB)添加水平为1.0、5.0 g/kg时与对照组之间差异不显著(P>0.05)。对于淀粉酶,MSB添加水平为2.0、3.0、5.0 g/kg的淀粉酶活性显著高于对照组(P<0.05),而彼此之间不具有统计学上的差异(P>0.05)。对于脂肪酶,MSB添加水平为3.0 g/kg时,刺参的脂肪酶活性最高,显著高于对照组(P<0.05);MSB添加水平为1.0 g/kg时脂肪酶活性与对照组差异不显著(P>0.05)。
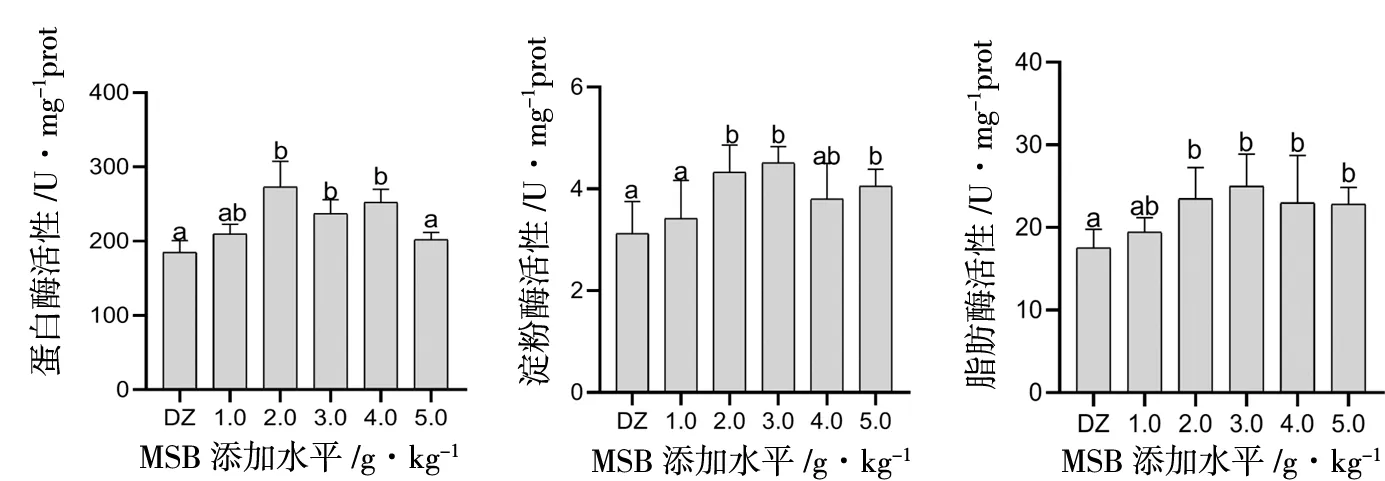
图2 饲料中添加不同水平的包膜丁酸钠(MSB)对刺参淀粉酶活性、脂肪酶活性和蛋白酶活性的影响
2.3 对刺参非特异性免疫酶活性的影响
在饲料中添加不同水平的MSB对刺参免疫酶活性的影响见图3。随着饲料中的MSB添加水平的提高,刺参SOD活性呈现出逐渐升高后又下降的趋势,总体较对照组均有不同程度的提高,其中在添加水平为3.0 g/kg时达到最高,显著高于对照组(P<0.05)。MSB添加水平为2.0 g/kg时过氧化氢酶活性为最高,显著高于对照组(P<0.05)。随着MSB的添加水平提高,刺参溶菌酶活性呈现期初略微下降,待添加水平超过2.0 g/kg后开始提高的趋势,当添加水平提升到4.0 g/kg时,溶菌酶的活性抵达峰值并且显著高于对照组(P<0.05)。饲料中添加不同水平MSB刺参的碱性磷酸酶(AKP)和酸性磷酸酶(ACP)活性呈现先提高后下降的趋势。

图3 饲料中添加不同水平包膜丁酸钠对刺参超氧化物歧化酶、
2.4 对刺参抗病力的影响
泼洒灿烂弧菌(VibriosPzendidu)后,被感染的刺参摄食量下降,体色变浅发白,体壁发软,体表腐皮增多直至最后死亡。图4显示为刺参的累计死亡率,除对照组和添加包膜丁酸钠(MSB)水平为1.0 g/kg组从第一天开始出现化苗,其余处理组均从泼洒后的第二天开始死苗。在整个攻毒周期内,对照组的刺参死亡率始终高于试验组,在第9天达到了稳定的69.0%;添加水平为4.0 g/kg时刺参累计死亡离从第5天起开始显著低于其他的试验组,在第8天达到稳定的35.67%,显著低于对照组(P<0.05);添加水平为5.0 g/kg时,前期的死亡率得到有效控制,处于较低值,在第4天骤然上升,最后稳定在了57.33%,与对照组差异不显著(P>0.05)。添加水平在2.0 g/kg时较其他试验组相比,最早达到稳定的44.67%,与对照组差异显著(P<0.05)。
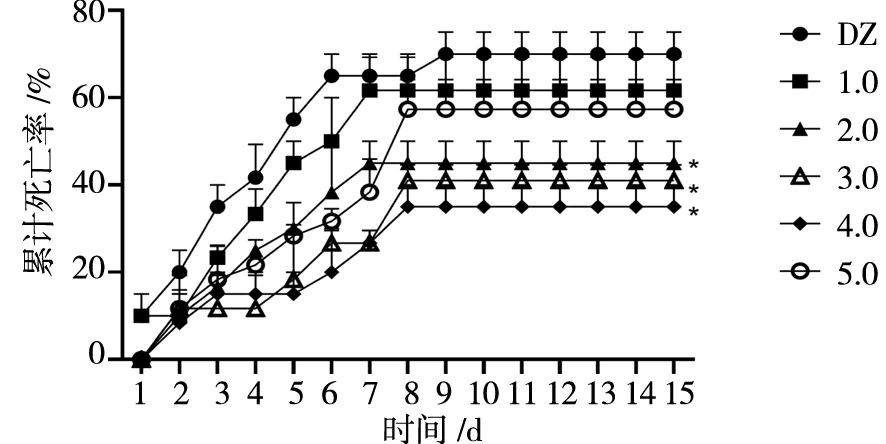
*表示与对照组差异显著(P<0.05)
3 讨论
3.1 对刺参生长性能的影响
丁酸钠具有提高动物生长性能的作用,在畜禽、水生动物养殖生产过程中都有了一定的研究报道。在畜禽方面,徐振飞等[14]发现肉仔鸡配合日粮中添加300 mg/kg包膜丁酸钠能显著提高肉仔鸡生产性能;在水产动物上,杨良辉等[15]发现添加丁酸钠是保障罗非鱼良好生产性能的首选;张淞林等[16]发现饲料中添加1.0‰的丁酸钠,美洲鳗鲡增重率提高了37%,饲料系数降低了26%;孙浪等[17]发现在饲料中丁酸钠添加量为2.5 g/kg时,鲫鱼增重率、特定生长率、蛋白质效率和肥满度分别提高了25.76%、16.46%、28.91%和8.37%。本试验结果与上述报道相类似,在饲料中添加一定剂量的包膜丁酸钠可以促刺参生长,随着丁酸钠添加量的增加,不同处理组刺参的增重率、特定生长率有先增后减的趋势,添加水平为3.0 g/kg丁酸钠处理组刺参的增重率、特定生长率达到最大,显著高于对照组(P<0.05),此时饲料系数为最低,此时的生长和营养利用效率最高。但当丁酸钠高于3.0 g/kg时刺参的生长情况逐渐变差,这可能与其抑制了刺参的肠道发育水平和降低了刺参对营养物质的消化吸收率有关,不再具有诱导刺参生长的作用。
脏壁比是内脏质量与体壁质量的比值大小,它反映出刺参的体壁作为有效生长部分所占的比例,比例越小说明个体的体壁长势越好。在本试验中,当包膜丁酸钠添加水平为2.0、3.0 g/kg时,脏壁比明显低于对照组和其他处理组。这说明当包膜丁酸钠添加水平介于此时,刺参的体壁处于较好的生长状态,总体有更好的生长趋势。由此可得知,适量的包膜丁酸钠可保证刺参的快速生长。
3.2 对刺参肠道酶活性的影响
消化酶是水生动物生长的关键因素,刺参的消化系统对摄入的营养物质消化和吸收能力依赖于肠道中微生物的种类以及数量,建立良好的肠道酶环境,可以高效地提高生物的生产性能及其饲料利用。
关于丁酸钠可以诱导肠道消化酶活性的作用机理近年来在畜禽、水产生产上有过相应的报道。在畜禽方面,相关研究表明在仔猪日粮中添加丁酸钠能改善断奶仔猪肠道黏膜形态结构,促进消化器官的生长发育[8],影响肠道酶活性[9]以及有效降低腹泻率[10]等。在水产养殖方面,研究表明鲫饲料中丁酸钠添加量达到2.5 g/kg时,鲫干物质与蛋白质表观消化率、前肠绒毛高度、肠道CREB基因和CDX2基因的相对表达量分别提高8.36%、6.21%、34.22%、51.11%和42.13%[17]。在该试验中,在饲料中添加不同水平的包膜丁酸钠后结果显示消化酶活性都发生了相应的变化。饲料中包膜丁酸钠水平为2.0、3.0、5.0 g/kg时刺参淀粉酶显著高于对照组(P<0.05)。添加水平2.0 g/kg时刺参的蛋白酶活性最高,显著高于对照组(P<0.05)。饲料中包膜丁酸钠水平为2.0、3.0、4.0 g/kg时刺参脂肪酶活性显著高于对照组(P<0.05)。此试验结果说明在饲料中添加一定剂量范围内包膜丁酸钠可显著提高刺参的肠道消化酶活性,从而提高刺参对营养物质的吸收利用效率。
3.3 对刺参非特异性免疫力的影响
刺参属于低等的棘皮动物,自身不具备复杂多样的高级免疫系统,更多的是依靠着非特异性免疫来增强对疾病的抵抗力,维持机体正常的生理状态,其中:超氧化物歧化酶(SOD)是水产动物体内的一种重要的抗氧化物酶,它可以有效去除动物体内产生的多余的超氧化物自由基,保护细胞免受损伤。CAT能分解过氧化氢,减轻机体过氧化程度。丁酸钠通过调节机体免疫和抗氧化功能来增强机体清除自由基的能力,减少组织和细胞损伤,研究发现在饲料中添加0.1%的丁酸钠提高了美洲鳗鲡抗氧化能力和过氧化氢酶(CAT)25%和15%[5]。在饲料中添加400 mg/kg微囊丁酸钠显著提高了团头鲂的肝胰脏中 T-SOD 活性[10]。在草鱼中添加适量丁酸钠上调了过氧化氢酶(CAT)活性[8],提高了抗氧化损伤能力。本试验结果与上述研究结果相似。在饲料中添加包膜丁酸钠水平为2.0、3.0 g/kg时刺参SOD、CAT活性显著高于对照组(P<0.05)。除添加水平为1.0 g/kg时,各处理组的刺参SOD活性较对照组都有不同程度的提高,这说明在饲料添加包膜丁酸钠能够提高刺参抗氧化能力,提高刺参免疫力。
溶菌酶(LSZ)是水生动物中先天性免疫调节中的一个重要的免疫反应指标。在团头鲂(罗玲,2018)饲料中添加适量丁酸钠显著提高了溶菌酶(LSZ)活力。本试验中,除添加包膜丁酸钠水平为1.0 g/kg处理组外,其它各组刺参LSZ活性均显著高于对照组(P<0.05),总体呈现先增高后下降的趋势,与张晓晓等[18]研究结果相类似。
酸性磷酸酶(ACP)和碱性磷酸酶(AKP)在动物解毒系统中起到重要的作用,而且与一些营养物质的消化吸收有重要关系。酸性磷酸酶是生物体中巨噬细胞的标志酶[19],它是体内巨噬细胞活性程度的指标[20],AKP是重要的解毒系统。本试验中,添加水平为3.0 g/kg和2.0 g/kg时刺参的碱性磷酸酶(AKP)与酸性磷酸酶(ACP)活性分别达到最大值,显著高于对照组(P<0.05),总体而言,在饲料中添加不同水平的包膜丁酸钠提高了刺参的碱性磷酸酶(AKP)与酸性磷酸酶(ACP)活性。
3.4 对刺参抗病力的影响
攻毒试验是反映机体免疫力最直观的方式。相关研究报道显示,将刺参置于浓度106cells/mL的灿烂弧菌海水中能够使刺参患腐皮综合症而致死[20]。本试验中采用注射方式对刺参进行攻毒,通过测定攻毒后各处理组中的刺参累计死亡率来评价添加不同水平包膜丁酸钠对刺参抗病力的影响。试验结果表明,通过比较各组刺参最终存活数、累计死亡数得出包膜丁酸钠可提高刺参对于灿烂弧菌的免疫抗病能力,并且在开始阶段包膜丁酸钠对刺参的抗病力随添加水平的增加而提高,但当添加水平达到2.0%时,刺参死亡率反而上升,这同潘丽俊等[21]研究包膜丁酸钠对球虫感染兔的结果相类似,此时高水平的丁酸钠失去了提高刺参的抗病能力的作用。这表明在饲料中添加适量的包膜丁酸钠在一定程度上可以改善动物机体的抗菌、抗病、免疫能力。但应当注意到,丁酸钠对于刺参抗病力的影响效果也会因不同的试验对象、不同的外界环境条件和不同的试验流程设计等变化而不同。
3.5 包膜技术的使用效果
水产动物特殊的生存环境导致目前丁酸钠此类添加剂在水产养殖中的应用受到限制,研究发现在饲料添加剂中广泛应用包膜技术可以有效减轻丁酸钠在水体中的溶淋作用[22],使得丁酸钠在消化道中获得了缓释,更好地发挥效用。在本试验条件下,随着丁酸钠添加水平的提高,刺参的增重率和特定生长率呈现先提高后降低的趋势。
4 结论
在刺参饲料中添加适量的包膜丁酸钠可以提高刺参的生长性能、肠道消化酶活性和非特异性免疫酶活性,以生长性能为参考,饲料中包膜丁酸钠的适宜添加量为2.0~3.0 g/kg。在考虑经济成本的情况下,刺参日粮中添加2.0 g/kg包膜丁酸钠为最佳剂量。

