呼吸道合胞病毒下呼吸道感染患儿血清miR-19a-3p和SOCS1的表达及临床意义
赵敏 韩英俊 李峥 刘亚坤 谭华清
急性下呼吸道感染(acute lower respiratory tract infection,ALRI)是全球儿童发病和死亡的主要原因之一,呼吸道合胞病毒(respiratory syncytial virus,RSV)是婴儿ALRI的常见病因,也是婴儿出生1年后住院的常见病因之一[1]。RSV是一种全球性感染的、副粘病毒科呼吸道单链RNA病毒,可分为两种不同的亚型:RSV-A和RSV-B[2]。临床表现为流涕、鼻塞、咽痛、干咳等症状,严重者可影响到其它系统疾病,甚至造成患者死亡,在全球范围内,RSV导致约3300万例5岁以下儿童发生ALRI,导致320万例患儿住院和5.96万例患儿死亡[3]。早产儿、慢性早产肺病(chronic lung disease of prematurity,CLDP)或先天性心脏病(congenital heart disease,CHD)儿童易发生重度RSV,且在儿科人群中,RSV可导致长期后遗症,例如喘息和哮喘[4]。目前还没有安全有效的使用产品应用于RSV的临床治疗,对RSV感染的患儿快速识别并采取有效的预防措施可降低全球患儿的发病率和死亡率[4]。因此,寻找相关生物标志物识别RSV,对临床中RSV的诊疗有重要意义。微小RNA(micro-RNA)是一种包含20~22个核苷酸的小的非编码RNA,可参与多种生理和病理生理过程,如细胞凋亡、增殖和分化等,其中miR-19a-3p可以调节细胞增殖、凋亡和炎症反应[5]。细胞因子信号传导抑制蛋白(suppressor of cytokine signaling,SOCS)是一种细胞蛋白,可以抑制许多细胞类型的细胞因子信号转导,且SOCS1在调节炎症方面具有重要作用[6]。但目前miR-19a-3p、SOCS1在RSV中的研究鲜有报道,因此本实验旨在探究RSV患儿血清中miR-19a-3p、SOCS1的表达水平,为RSV的临床研究提供基础数据。
资料与方法
一、临床资料
选取2019年1月—2022年1月在本院儿科接收的呼吸道感染患儿180例为研究对象。纳入标准:(1)临床确诊为呼吸道感染[7];(2)临床资料完整。排除标准:(1)合并支气管畸形、恶性肿瘤、肺结核、支气管异物、先天性心脏病、胸廓畸形、免疫缺陷、营养不良等疾病者;(2)肝肾功能不全者;(3)并发呼吸衰竭、心力衰竭者;(4)脑血管病患儿及缺血缺氧性脑病者。180例研究者中,将咽拭子RSV-RNA结果呈阳性的患儿(80例)作为RSV感染组,将RSV-RNA结果呈阴性的患儿(100例)为对照组。根据入院时Lowell评分[8]进一步将RSV感染组分为重度组(Lowell评分≥10分,54例)和轻度组(Lowell评分<10分,26例)。本研究经医院伦理委员会审核批准(20180428)。
二、方法
1 临床资料收集 采集研究者的性别、年龄、临床表现(发热、气促、喘息、呕吐腹泻等)、胸部影像学表现(纹理增多、散在斑片状影、大片阴影等)等临床特征资料。
2 血清细胞炎性因子的检测 白介素-1β(Interleukin-1β,IL-1β)、白细胞介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)试剂盒购自武汉博士德生物公司,严格按照试剂盒说明书进行操作。依据说明书程序依次加入样品后,使用酶标仪测量450 nm的吸光度值,计算血清中上述因子水平。
3 miR-19a-3p、SOCS1 mRNA表达检测 取患儿体检时早晨空腹静脉血5 mL,血清保存于-80℃待测。使用TRIzol试剂(Thermo Fisher公司)提取血清中的总RNA,并用PrimeScript RT-PCR试剂盒(Thermo Fisher公司)反向转录。计算A260/A280比率以评估RNA质量和纯度。在推荐的热循环设置下,使用480II RT-PCR系统(Roche, Basel, Switzerland)进行qRT-PCR分析,步骤如下:95 ℃进行一次初始循环(30秒),然后95 ℃循环55次(每次15秒),60 ℃循环20秒,72 ℃循环15秒。以U6、β-actin为内参。基因相关序列(见表1)。反应结束后相对表达量采用2-ΔΔCt法计算。

表1 qRT-PCR引物序列
三、统计学方法

结 果
一、对照组、RSV感染组患儿临床特征
两组中的临床表现(发热、气促、喘息、呕吐、腹泻)和影像学胸片(散在斑片状影)之间有显著性差异(P<0.05)。且相较于对照组,RSV感染组患者血清中的IL-6、TNF-α、IL-1β水平显著升高(P均<0.05)。而年龄、性别、病程、发病季节、影像学胸片(纹理增多、大片阴影)之间没有显著性差异(见表2)。
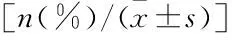
表2 对照组、RSV感染组患儿临床特征
二、对照组、RSV感染组血清中miR-19a-3p、SOCS1水平比较
相较对照组,RSV感染组患者血清中的miR-19a-3p、SOCS1水平显著升高(P<0.05)(见表3)。

表3 对照组、RSV感染组血清中miR-19a-3p、SOCS1水平比较
三、轻度组、重度组血清中miR-19a-3p、SOCS1水平比较
相较于轻度组,RSV重度组患者血清中的miR-19a-3p、SOCS1水平显著升高(P<0.05)(见表4)。

表4 轻度组、重度组血清中miR-19a-3p、SOCS1水平比较
四、血清miR-19a-3p、SOCS1与细胞因子水平的相关性
RSV患者血清miR-19a-3p与IL-6、TNF-α、IL-1β水平呈正相关(r=0.557、0.569、0.613,P均<0.05)。SOCS1与IL-6、TNF-α、IL-1β水平呈正相关(r=0.592、0.571、0.564,P均<0.05)。
五、血清中miR-19a-3p与SOCS1水平的相关性
RSV患者血清miR-19a-3p与SOCS1水平呈正相关(r=0.701,P<0.05)(见图1)。
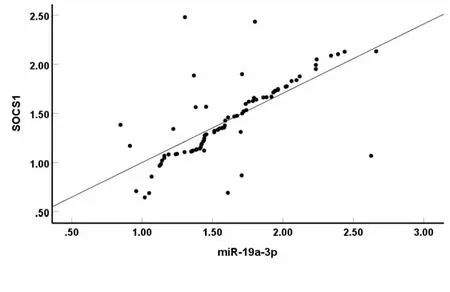
图1 血清中miR-19a-3p与SOCS1水平的相关性的散点图
六、血清中miR-19a-3p、SOCS1水平对RSV感染严重程度的诊断价值
以RSV患者血清中miR-19a-3p、SOCS1(具体值)水平为检验变量,以RSV感染严重程度为状态变量(轻度=0,重度=1)绘制ROC曲线,结果显示,RSV患者血清中miR-19a-3p、SOCS1水平及二者联合预测RSV感染严重程度的AUC分别为0.714、0.735、0.851,其中联合预测AUC显著高于二者单独预测AUC(Z二者联合-miR-19a-3p=3.217,P=0.024)(Z二者联合-SOCS1=3.679,P=0.048)(见图2、表5)。

图2 血清中miR-19a-3p、SOCS1水平预测RSV感染严重程度的ROC曲线

表5 血清中miR-19a-3p、SOCS1水平预测RSV感染严重程度的价值
讨 论
RSV是一种多态性阴性单链RNA病毒,属于肺炎病毒科,于1955年首次从患有呼吸系统疾病的黑猩猩中分离出来,是世界上婴儿住院的主要原因,也是仅次于疟疾的婴儿死亡的第二大原因[9-10]。RSV主要通过密切接触唾液或粘液飞沫传播,病毒在鼻咽和上呼吸道的上皮细胞中短时间复制后,释放的病毒颗粒转移到下呼吸道的细支气管或肺泡,发生免疫反应导致中性粒细胞浸润并缩小气道,进一步产生细支气管炎等呼吸系统疾病[10]。一般来说,感染后大约3至7天,患者开始出现一些发烧、流鼻涕、鼻塞、咳嗽、咽痒、干咳等常见的症状[11]。研究发现,RSV感染模式呈U形年龄曲线,5岁以下和65岁以上人群的发病率达到峰值。大多数儿童被认为在2岁之前就接触过RSV,且不会诱导终生免疫,因此会导致患儿反复被感染[9, 12]。全球内每年约有3381万婴幼儿患有ALRI疾病,主要是由RSV引起,造成约5.96~19.9万的患儿死亡,其中发展中国家死亡患儿占99%[7]。我国25%以上的ALRI住院患者被RSV感染,尤其在0~5岁婴幼儿中,约有24%肺炎及40%~50%毛细支气管炎是由RSV感染所致[7]。临床上对RSV细支气管炎的治疗主要是支持性治疗,包括适当的补液和必要时使用辅助供氧,目前唯一批准的抗病毒药物是利巴韦林,但由于其潜在的毒性,使其在治疗使用中受到限制[13]。尽管临床中一直致力于对RSV疫苗的开发,但目前尚无获得许可的疫苗[12]。因此,寻求能反映RSV感染严重程度的生物标志物,使RSV有望被及时防治,对提升患者的安全和健康方面有重大意义。
众所周知,miRNA参与调节广泛的生物活性,因此,miRNA最近已成为重要的临床生物标志物和治疗工具[14]。例如,miR-29c、miR-30c、miR-193a-5p和miR-885-5p是人类T细胞白血病病毒1型诊断重要的新型潜在生物标志物[15]。另一方面,在病毒感染期间,miRNA可能涉及感染的各个阶段,其中miRNA介导的抗病毒活性已被报道用于登革热病毒[16]。本研究结果显示,在RSV患者血液中,miR-19a-3p水平显著增高,且随着疾病的加重进一步增高,提示miR-19a-3p可促进RSV的发生。与Fayyad-Kazan等[17]人在急性呼吸综合征冠状病毒2引起的冠状病毒病实验中miR-19a-3p上调,且血浆miR-19a-3p表达水平可作为SARS-CoV-2感染期间的潜在诊断生物标志物结果一致。Zheng等[18]人也发现,在RSV中miR-19a-3p表达水平显著上调,且RSV NS1可能通过miR-19a-3p激活5-LO和随后的炎性细胞因子机制中发挥重要作用。此外,miR-19a-3p预测RSV严重程度的AUC为0.714,提示miR-19a-3p对RSV严重程度有一定的预测价值。在RSV小鼠实验中发现,SOCS1被木犀草素下调,且木犀草素通过调节miR-155/SOCS1/STAT1信号通路来抑制RSV的复制[19]。本实验结果中,RSV患者血清中SOCS1水平显著上调,RSV重度组显著高于轻度组,提示SOCS1可能在RSV中发挥促进作用,与上述实验结果类似。且SOCS1预测RSV严重程度的AUC为0.735,提示SOCS1对RSV严重程度有一定的预测价值。此外,本实验进一步研究表明,RSV患者血清中miR-19a-3p与SOCS1水平呈正相关,且二者联合对RSV严重程度预测的AUC和灵敏度高于单一预测,提示miR-19a-3p、SOCS1可能相互调节,共同参与RSV的发生发展,且二者联合对RSV严重程度预测的价值较高。
RSV感染的主要临床表现是过度炎症和组织损伤[20]。促炎细胞因子的释放通常会引起过度的炎症反应,主要包括白细胞介素IL-1β、IL-6、TNF-α,炎症小体的激活对RSV感染有很强的影响[21]。Shen等[20]人研究表明大黄能够减少RSV诱导的BALB/c小鼠血清和肺组织中IL-1β、IL-6、TNF-α因子的释放。类似的,本研究结果也显示出RSV患者血清中IL-1β、IL-6、TNF-α表达随着疾病严重程度显著上调。以上提示,RSV患者机体处于高度炎症状态。进一步分析显示,RSV患者血清中IL-1β、IL-6、TNF-α水平均与miR-19a-3p、SOCS1水平呈正相关,表明miR-19a-3p、SOCS1可能通过调节RSV相关炎症反应,影响RSV疾病发展。在小鼠实验中,大黄抑制RSV感染小鼠的免疫炎症反应,可能与通过NF-κB途径抑制NLRP3炎症小体激活有关[20]。IL-1β、IL-6、TNF-α可激活NF-κB途径,而miR-19a-3p、SOCS1则被证明受NF-κB通路的调控[20, 22-23]。因此本研究推测miR-19a-3p、SOCS1在RSV疾病中可能通过激活NF-κB通路调节机体免疫炎症,促进IL-1β、IL-6、TNF-α等炎症因子的释放,加重疾病进展,然而具体机制还需进一步研究。
综上所述,RSV患者血清miR-19a-3p、SOCS1水平较高,二者联合对RSV严重程度有较高的预测价值,可能通过促进IL-1β、IL-6、TNF-α等炎症因子的释放,加重疾病进展。但本实验样本量较少,有一定的局限性,后期将使用随机性大样本量进一步对其具体机制进行深入研究。

