宏基因组二代测序在免疫抑制患者肺部浸润病因诊断中的应用
吴琴 王葆青 余荣环 黄洁
感染是免疫抑制患者最常见的疾病,病死率极高[1-2],其中肺是最常见的靶器官,肺部影像常表现浸润阴影。免疫抑制患者出现肺部阴影的原因还包括化疗药物的使用[3](如利妥昔单抗[4])、肿瘤肺部浸润和转移、放射性肺炎、肺水肿等[5]。因此亟需一种快速精准的病原学检测方法进行鉴别诊断。宏基因组二代测序技术(metagenomic Next-Generation Sequencing, mNGS)不依赖培养,具有广而全的筛查特质[6]。对于难培养的微生物具有明显优势[7],同时也具有较好的阴性预测价值[8]。本研究通过对上海市徐汇区中心医院呼吸与危重症医学科出现肺部浸润的免疫抑制患者的一般资料、临床特点、常规实验室检测及mNGS结果予以前瞻性分析研究,探究mNGS在出现肺部浸润的免疫抑制患者病因诊断中的应用价值。
资料与方法
一、研究对象
前瞻性纳入2019年11月至2022年11月间我科收治的出现肺部浸润的免疫抑制患者60例。
二、纳入和排除标准
1 纳入标准:①年龄≥18岁。②所有患者均经免疫细胞计数检测明确存在不同程度的免疫抑制。③入院时胸片和(或)胸部 CT提示肺部新出现浸润阴影而病因诊断未明者。④入组前全身等部位无原发感染性疾病。
2 排除标准:①妊娠或哺乳期妇女。②合并精神异常者。③多脏器功能衰竭者。④mNGS等样本未通过质量控制。
三、本研究获得了上海市徐汇区中心医院伦理委员会的批准[伦理编号:(2020)科审第(126)号]。所有患者或家属均知情同意,并签署了知情同意书。
四、研究方法
1 样本的采集及处理 样本采集:(1)肺泡灌洗液:根据患者肺部影像学,对于病变局限者,选择病变部位引流进行支气管肺泡灌洗;对于弥漫性病变者,选择右肺中叶或左上叶舌段进行灌洗。(2)其它(血液、深部痰液、肺组织、胸水):部分患者经评估无法耐受或拒绝支气管镜时采集。
样本处理:所有入组患者入院后,采集合适部位样本按照医院流程进行常规实验室检测,包括:血常规、C-反应蛋白(C-Reaction Protein, CRP)、微生物培养、涂片镜检(革兰氏染色、抗酸染色、六胺银染色)、γ-干扰素释放试验(interferon-γ release assay, IGRA)、血隐球菌抗原检测、(1-3)-β-D葡聚糖检测(Glucan, G)、半乳甘露聚糖检测(Galactomannan, GM)、肿瘤细胞检查(组织病理、流式细胞术、免疫组化)等。同时该样本规范按照mNGS 送检标本流程进行样本核酸提取、文库制备、文库测序、序列与微生物数据库比对的检测。
2 mNGS阳性判定标准 参考mNGS在感染性疾病的专家共识[9]:(1)细菌(分枝杆菌、诺卡菌除外):检出细菌(种水平)的序列数是其余所有细菌的10倍以上。(2)真菌:检出真菌(种水平)的序列数是其余所有真菌的5倍以上。(3)结核分枝杆菌(mycobacterium tuberculosis, MTB):至少检出1条(种或属水平)结核分枝杆菌复合群序列[10]。(4)非结核分枝杆菌(nontuberculous mycobacteria, NTM):检出序列数(种或属水平)在原始细菌列表排名前10位。(5)病毒:检出序列数应至少覆盖全基因组的 3 个非重叠区域。
3 病原体鉴定及临床诊断 由有经验的临床专家结合患者临床表现、常规实验室检测、mNGS结果及治疗疗效进行综合诊断。
五、统计学处理
将纳入研究的60例患者的检测结果录入 Excel 表格,并用SPSS 24.0 软件分析。计数资料:统计例数和百分比;比较采用卡方检验或 Fisher 确切概率法。P<0.05 为差异有统计学意义。
结 果
一、患者一般资料及预后
研究共纳入60例患者,平均年龄65.9岁,中位年龄67.0岁。疾病类型主要包括:血液系统疾病(弥漫大B细胞淋巴瘤6例、霍奇金淋巴瘤2例、慢性骨髓增殖性肿瘤1例、骨髓增生异常综合征1例)、实体肿瘤(肺癌9例、食管癌9例、乳腺癌6例、结肠癌6例、鼻咽癌2例、膀胱癌、胆管癌、喉癌和胃癌各1例)、自身免疫病(干燥综合征3例、类风湿性关节炎2例、抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies, ANCA)相关性血管炎、混合性结缔组织病、原发性肾上腺皮质功能减退症、大疱性类天疱疮、自身免疫相关性脑病各1例)、糖尿病和获得性免疫缺陷综合征(acquired immunodeficiency syndrome, AIDS)患者。患者基本特征及预后(见表1)。
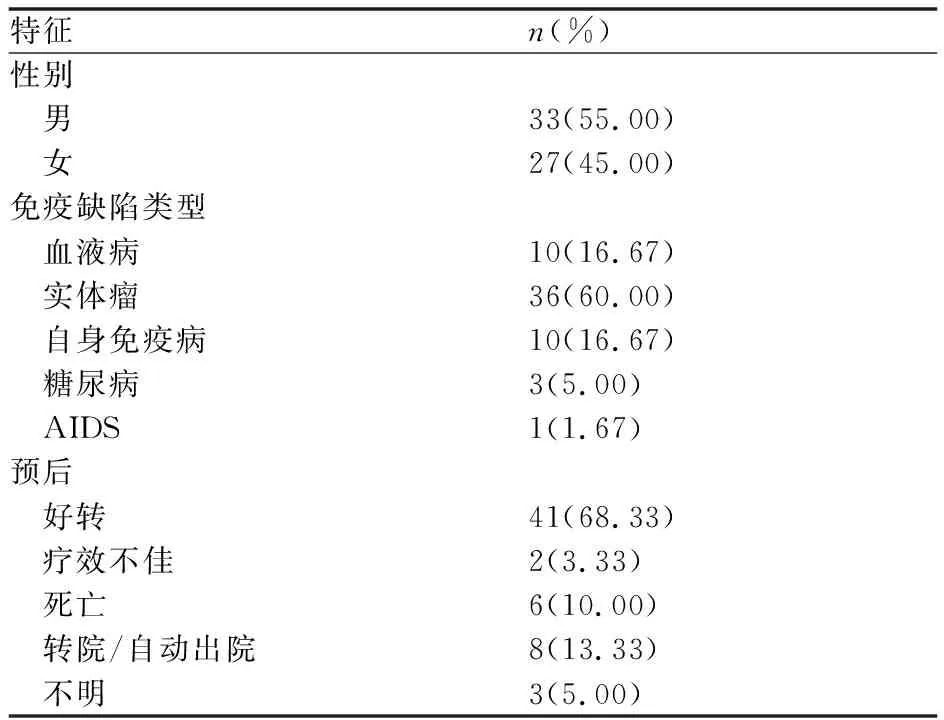
表1 患者基本信息及预后
二、mNGS检验效能及一致性分析
60例患者mNGS和常规实验室检测方法的阳性例数和阳性率分别为:mNGS:53例阳性,阳性率为88.3%;常规实验室检测方法:(1)涂片:16例阳性,阳性率为26.7%。(2)培养: 18例阳性,阳性率为30.0%。(3) G/GM试验:3例阳性,阳性率为5.0%。(4)γ干扰素释放试验 /血隐球菌抗原检测:5例阳性,阳性率为8.3%。(5)病理/流式:1例阳性,阳性率为1.7%。5种常规实验室检测方法的总体阳性率为55.0%,mNGS的阳性率与其相比差异有统计学意义(χ2=120.00,P<0.001)(见图1)。
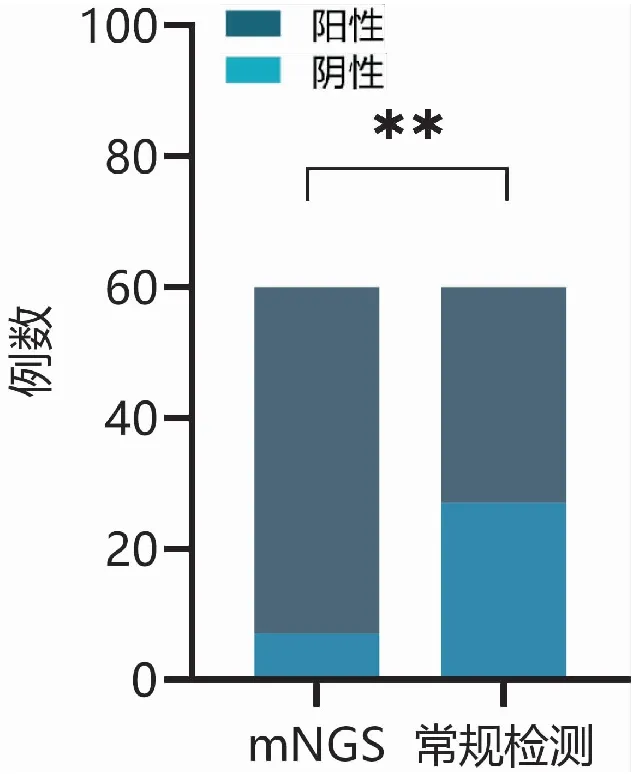
图1 mNGS与常规检测方法对比注:**表示两组间比较P<0.01
一致性结果显示(见图2,表2):55.0%(33/60)患者样本的mNGS检测结果与常规检测结果一致。(1)75.8%(25/33)患者样本的两种检测结果完全一致,6例患者两类检测结果均为阴性,最终临床分别诊断为2例脂质性肺炎,1例化学性肺炎,1例放射性肺炎,1例淋巴瘤肺内浸润和1例结缔组织病肺累及。19例患者两类检测结果均为阳性,14例为感染患者,责任病原分别为结核分枝杆菌5例、新生隐球菌2例、白色念珠菌2例、金黄色葡萄球菌1例、鲍曼不动杆菌1例和铜绿假单胞菌1例、Mycolicibacterium cosmeticum(非结核分枝杆菌之一)1例、马尔尼菲蓝状菌1例。其余5例患者阳性结果均为定植微生物,均排除感染。(2)24.2%(8/33)患者样本的检测结果部分一致,部分一致的原因是由于mNGS额外检出了常规检测未检出的病原微生物,其中3例额外检出病毒,2例额外检出细菌,2例额外检出细菌和真菌,1例额外检出真菌。

图2 常规实验室检测方法与mNGS结果的一致性分析注:中间橙色表示检测结果一致;中间蓝色表示检测结果不一致。左侧33例(55%)为mNGS与常规检测结果一致:75.8%(25/33)为两种检测结果完全一致,24.2%(8/33)由于mNGS的额外检出与临床检测结果部分一致;右侧27例(45%)为两种检测结果不一致:74.1%(20/27)mNGS阳性,常规检测阴性,22.2%(6/27)两种检测阳性,但阳性结果不一致,3.7%(1/27)mNGS阴性,常规检测阳性

表2 常规实验室检测方法与mNGS结果的一致性分析统计
45%(27/60)患者样本的mNGS检测结果与常规实验室检测结果不一致(见图2,表2):(1)74.1%(20/27)样本的mNGS检测结果为阳性,而临床常规实验室检测为阴性,最终17例根据mNGS检测结果与临床表现确诊为感染。(2)22.2%(6/27)样本的mNGS检测阳性结果与常规实验室检测阳性结果完全不一致,6例患者中有4例通过mNGS检测确诊为感染(病原微生物分别为脓肿分枝杆菌、烟曲霉、耶氏肺孢子菌和链球菌)。(3)3.7%(1/27)样本的mNGS检测结果为阴性,而临床常规实验室检测GM试验阳性,患者最终确诊为肺曲霉感染。
三、免疫抑制患者样本病原谱分析
60例患者样本共检出126株病原体(见图3),包括细菌62株,检出前三位分别为鲍曼不动杆菌9株、副流感嗜血杆菌8株,金黄色葡萄球菌7株;真菌41株:耶氏肺孢子菌5株、念珠菌24株、曲霉9株、新生隐球菌2株和马尔尼菲蓝状菌1株;分枝杆菌7株:结核分枝杆菌5株、非结核分枝杆菌2株;病毒16株。

图3 mNGS检出病原谱
四、病因分析
患者出现肺部浸润的最主要原因为感染,共42名患者确诊,占70.0%,其中混合感染11例,占感染患者总数的26.2%(11/42)。其它原因还包括化学性肺炎(5例,8.3%)、脂质性肺炎(2例,3.4%)、放射性肺炎(2例,3.4%)、淋巴瘤肺内浸润(2例,3.4%)、结缔组织病肺累及(2例,3.4%)、转移性肺癌(2例,3.4%)、机化性肺炎(2例,3.4%)、肺腺癌(1例,1.7%)。确诊为感染患者的白细胞和中性粒细胞值与非感染患者差异均无统计学意义(P>0.05),但CRP的t值为2.093,P=0.044(<0.05),两者之间差异有统计学意义。
确诊为感染的患者中有25例为细菌感染(包括5例结核分枝杆菌和2例非结核分枝杆菌),其中7例分枝杆菌mNGS全部检出,5例抗酸染色阳性和(或)γ-干扰素释放试验阳性;17例为真菌感染(包括5例合并细菌感染),其中死亡率为29.4%(5/17),占本研究死亡人数的83.3%(5/6)。在寻找肺部出现浸润的患者病因时mNGS的灵敏度为97.7%,特异度为52.9%,阳性预测值为84.0%,阴性预测值为90.0%。
讨 论
目前临床对于免疫抑制患者并发肺部浸润阴影的早期诊断率低,多采用经验性多种药物抗感染治疗,极易诱导细菌耐药、延长住院时间、增加患者经济负担、加重脏器功能损害等。因此,早期选择合适的病原学检测方法,是对患者快速诊断、精准治疗和决定预后的关键。mNGS在感染检测方面具有极大的优势,它直接从样本中提取全部微生物的核酸进行高通量测序,提供详尽的微生物图谱,能够有效的检测肺部混合感染并缩短检测时间[11],在血流感染[12-13]方面也有着比血培养更高的阳性率。对微生物诊断产生了革命性的影响[14]。
本研究通过将多种常规实验室检测方法与mNGS进行比较,结果显示mNGS具备多方面的优势。第一,mNGS对于感染的鉴别诊断明显优于传统检测,尤其是在耶氏肺孢子菌和曲霉的检测方面,传统方法只检出2例曲霉菌感染;第二,mNGS的阴性结果对于排除感染性疾病具有很大的价值,阴性预测值为90.0%;第三,在患者病因分析中,mNGS具有很高的灵敏度和较高的特异度,分别为97.7%和52.9%。
我们也发现免疫抑制患者肺部浸润的最主要病因是感染(70.0%),其中40.5%(17/42)的患者为肺部真菌感染,如耶氏肺孢子菌肺炎(pneumocystis pneumonia, PCP)和侵袭性肺曲霉病(invasive pulmonary aspergillosis, IPA)等。有研究报道急性淋巴细胞白血病或淋巴增殖性疾病患者PCP的发病率约40%[15]。而诊断为IPA的患者中,死亡率仍高达60%[16]。在本研究中真菌感染的死亡率为29.4%(5/17),占本研究全部死亡患者的83.3%(5/6),是造成患者死亡的主要原因。
由于本研究样本量较少,也未进行RNA病毒的检测,后续有待大样本同时进行DNA和RNA测序的研究验证mNGS在免疫缺陷宿主肺部浸润的诊断价值。
综合上述,免疫抑制患者肺部浸润的病因诊断是对临床工作者的重大考验,选择合适的病原学诊断方法尤为关键。对比传统方法,mNGS作为一种有效的检测手段,可提高肺部浸润的免疫抑制患者的病原微生物检出率,有效的区分感染与非感染,精准的诊断病因,从而指导抗感染药物的应用、提升治疗效果和改善预后。因此,mNGS在临床精准诊断肺部出现浸润的免疫抑制患者病因分析中有很高的应用价值。

